首页 > 医疗资讯/ 正文
急性髓系白血病(AML)是一种异质性血液癌症,主要影响老年人,死亡率很高,随着人口老龄化,AML的发病率不断上升,而患者的生存率却一直较低,目前,对于不适合接受高强度化疗的AML患者,治疗选择有限,疗效不佳,传统的治疗方法,如去甲基化药物(如阿扎胞苷)和低强度化疗,在老年AML患者中的反应率通常低于30%,近年来,靶向治疗药物的出现为AML治疗带来了新的希望,例如IDH1/IDH2抑制剂和FLT3抑制剂,但这些药物仅对特定基因突变的AML患者有效,因此,针对AML的异质性和遗传多样性,迫切需要开发新的治疗策略。Iadademstat(ORY-1001)是一种口服的、高选择性的LSD1抑制剂,能够有效抑制LSD1的酶活性和支架活性,LSD1是一种表观遗传调控因子,在维持白血病干细胞的干性方面发挥着重要作用,Iadademstat在AML细胞系中表现出良好的抗白血病活性,并且在临床前研究中与阿扎胞苷表现出协同作用。因此,研究者开展了ALICE研究,旨在评估Iadademstat联合阿扎胞苷治疗新诊断AML患者的安全性和有效性。

方法
ALICE研究是一项开放标签、IIa期剂量探索研究,旨在评估Iadademstat联合阿扎胞苷治疗新诊断AML患者的安全性和有效性,纳入患者年龄≥18岁,为新诊断的AML,不适合接受高强度化疗,ECOG体能状态为0-2。剂量递增阶段:患者接受Iadademstat 90 µg/m²/天(可降至60 µg/m²/天,最高可达140 µg/m²/天)口服,每周5天,停药2天,联合阿扎胞苷75 mg/m²/天皮下注射,每28天为1个周期,共7天;扩展阶段:在剂量递增阶段确定的最佳剂量下,扩大入组人数,进一步评估疗效和安全性。主要终点为安全性:评估剂量限制性毒性、不良事件以及生命体征、体重和实验室指标的变化以及确定II期推荐剂量;次要终点:疗效分析集(所有至少进行过一次疗效评估的患者)中的缓解率。
研究结果
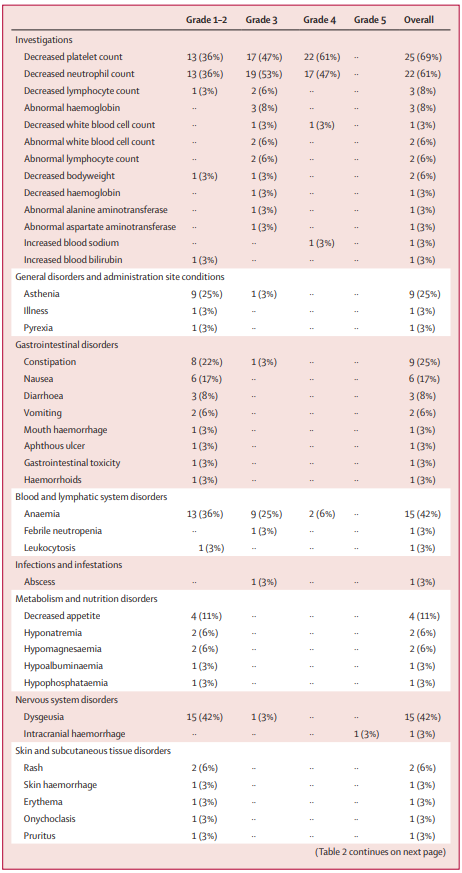
安全性:研究中未观察到剂量限制性毒性,最常见的不良事件为血液系统毒性,包括血小板减少(69%)、中性粒细胞减少(61%)和贫血(42%),大部分为3-4级,共报告3例严重不良事件,包括1例致命性颅内出血、1例分化综合征和1例发热性中性粒细胞减少,根据安全性、药代动力学、药效学和疗效数据,确定Iadademstat联合阿扎胞苷的II期推荐剂量为90 µg/m²/天。
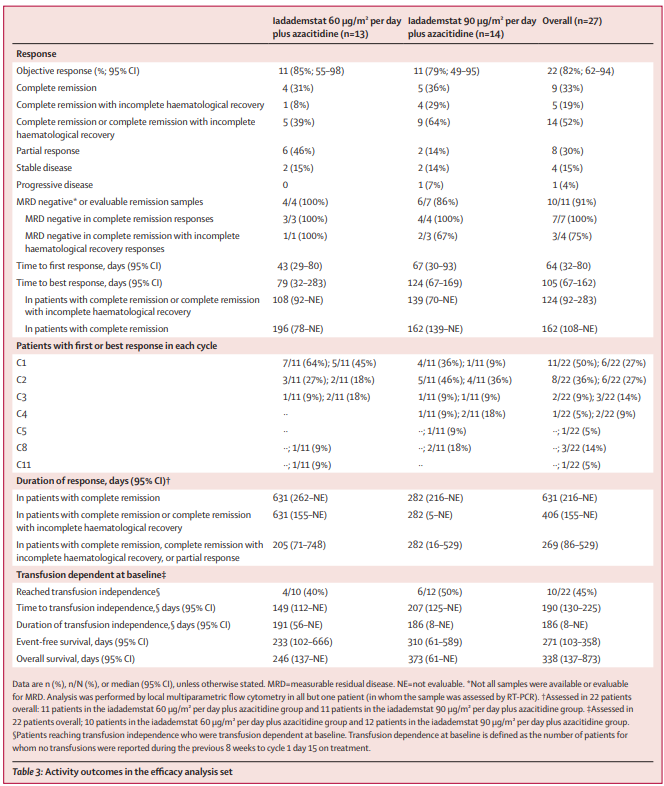
疗效:27 名疗效分析集中患者的 22 名 (82%; 95% CI 62-94) 出现了客观缓解,27 名患者中的 14 名 (52%) 达到完全缓解或完全缓解伴不完全血液学恢复;其中 11 名可评估微小残留疾病的患者中有 10 名达到阴性。

结论
Iadademstat联合阿扎胞苷治疗新诊断AML患者具有良好的安全性和有效性,包括高风险预后因素的患者,该联合方案可能为AML患者提供新的治疗选择。
原始出处
Salamero O, et al. 2024. Iadademstat in combination with azacitidine in patients with newly diagnosed acute myeloid leukaemia (ALICE): an open-label, phase 2a dose-finding study. The Lancet Haematology 11:e487-e498.
猜你喜欢
- Radiology:18F-FAPI PET/CT心肌活性在预测肥厚性心肌病心源性猝死方面的价值
- Diabetes:Teplizumab治疗后3个月内抑制1型糖尿病高危人群的快速代谢下降
- 靠喝水垫肚子?想瘦身 吃饭时不要喝水
- Clin Oral Investig:低磨料空气抛光的工作角度对离体猪牙龈损伤有影响
- Microsystems & Nanoengineering:新技术为试管婴儿筛选出更加健康的精子
- 感冒可以吃榴莲吗?
- 【BCJ】揭示一千例≥60岁新诊断AML的分子特征
- 突破传统!NEJM:乳腺癌可少切除,还可降低水肿风险
- 【Transplant Cell Ther】急性白血病异基因移植后的远期复发率和结局
- 总投资40亿元 药物安全性评价机构昭衍新药落户重庆
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)