首页 > 医疗资讯/ 正文
表阿霉素(EPI)可以在残留的肿瘤细胞中引发轻度保护性自噬,从而产生免疫抑制微环境。这加速了残余肿瘤的复发,并导致抗程序性死亡配体1(抗PD-1)/PD-L1治疗耐药性,对肿瘤免疫疗法提出了重大的临床挑战。因此,靶向PD-1/PD-L1通路的检查点抑制剂和扩增自噬的组合为肿瘤治疗提供了一种创新的方法,有望防止肿瘤免疫逃逸并增强治疗性识别。
在本研究中,四川大学张兴栋院士团队樊渝江教授和青岛大学梁燕教授等人旨在合成一种氧化还原触发并可诱导自噬的纳米平台,具有SA/EA诱导的PD-L1抑制作用。透明质酸(HA)骨架和精氨酸片段促进了纳米平台的主动靶向、细胞摄取和渗透。PLGLAG肽在肿瘤微环境中被过表达的基质金属蛋白酶-2(MMP-2)切割,并释放PD-L1抑制剂D-PPA以抑制肿瘤免疫逃逸。此外,强烈的自噬诱导剂STF-62247(STF)和EPI是由于肿瘤细胞中高谷胱甘肽(GSH)浓度影响的二硫键断裂而释放的。EPI和STF的组合诱导细胞凋亡和自噬细胞死亡,有效地消除了大多数肿瘤细胞。这表明SA&EA纳米平台比单一的STF@AHMPP和EPI@AHMPTP组具有更好的治疗效果。这项研究提供了一种方法来建立氧化还原触发的自噬诱导的具有PD-L1抑制作用的纳米平台,以增强化学免疫治疗。相关工作以“A Redox-Triggered Autophagy-Induced Nanoplatform with PD-L1 Inhibition for Enhancing Combined Chemo-Immunotherapy”为题发表在ACS Nano。

【文章要点】
如图1所示,作者设计了一种具有PD-L1抑制作用的氧化还原触发诱导自噬的纳米平台,STF@Arg-HA-PLGLAG-PPA/PCL&EPI@Arg-HA-PLGLAG-PPA/TAT-PCL(STF@AHMPP&EPI@AHMPTP,SA&EA),以增强化学免疫疗法。SA&EA纳米平台由两个聚合物纳米颗粒组成,即STF@AHMPP和EPI@AHMPTP纳米颗粒。这些纳米颗粒均基于阴离子多糖透明质酸(HA),具有良好的生物相容性,避免了血清蛋白吸附,并可在体内主动靶向肿瘤细胞。此外,精氨酸(Arg)与HA共价连接,以借助精氨酸的胍基与细胞膜表面的磷脂形成氢键,以帮助纳米平台进入肿瘤细胞,并通过在细胞膜中形成孔促进对肿瘤组织的渗透。
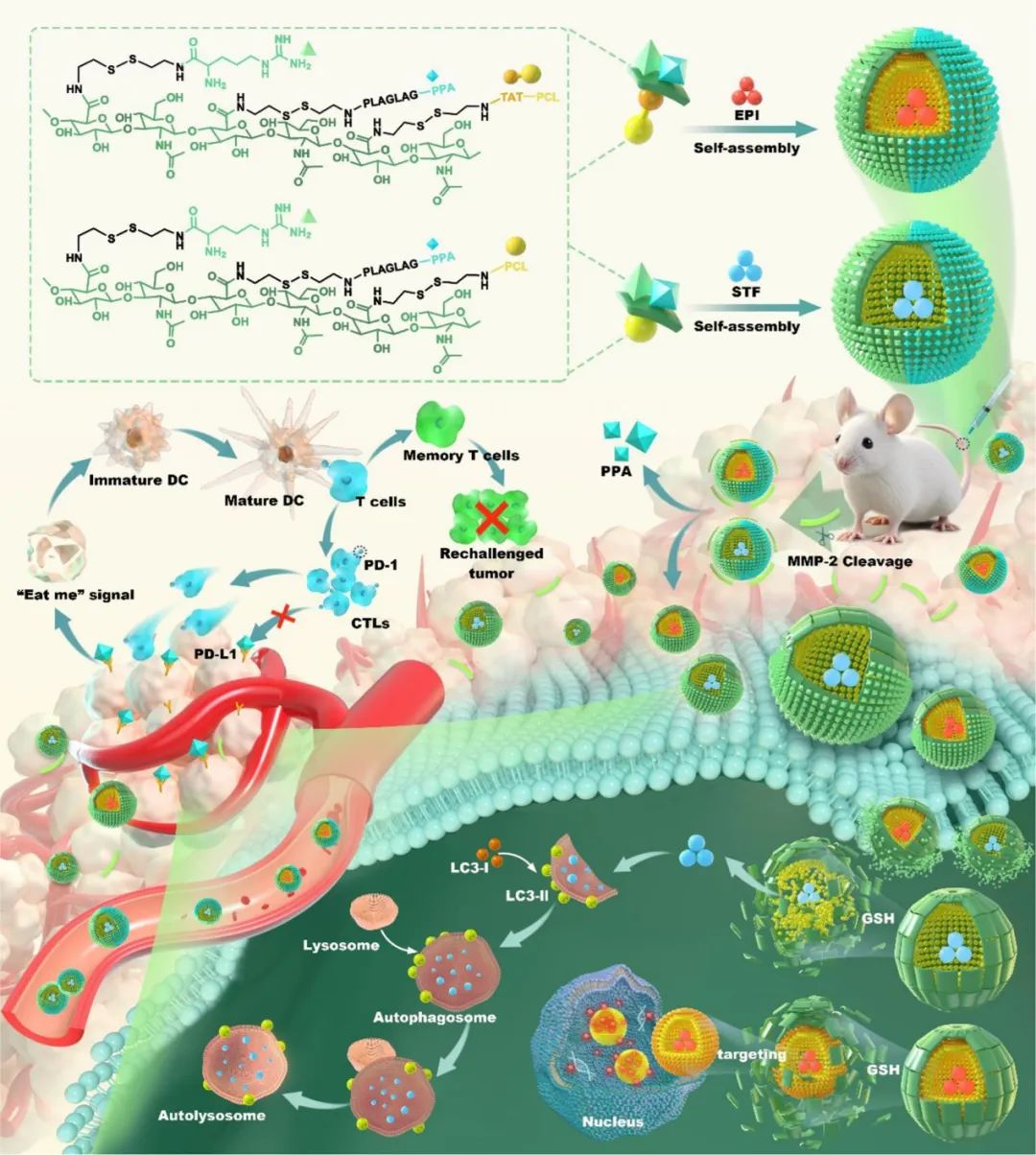
图1 SA&EA的设计及其实现化疗-免疫疗法示意图
此外,由于肿瘤微环境(TME)中具有较高的基质金属蛋白酶-2(MMP-2)水平,结合了MMP-2敏感多肽PLGLAG的PD-L1抑制剂D-PPA(附着于HA)被释放,以抑制免疫逃逸。STF@AHMPP和EPI@AHMPTP分别负载自噬诱导剂STF(通过聚(ε-己内酯)(PCL)作为疏水末端)和EPI(通过与PCL偶联的核靶向TAT肽(TAT-PCL,TP))。同时,PCL和TP片段通过二硫键与HA偶联。肿瘤组织谷胱甘肽(GSH)含量远高于血液和正常组织;因此,二硫键在肿瘤细胞中断裂,导致EPI和EPI@TP纳米颗粒的释放。紧接着,EPI@TP可进一步靶向细胞核诱导细胞凋亡。同时,STF被释放以触发自噬细胞死亡(图1)。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.4c00227
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)