首页 > 医疗资讯/ 正文
01 对于AD,除了早发现、早预防,别无它法
阿尔茨海默症(Alzheimer,s disease,AD),即老年痴呆症,是与年龄相关且不可逆转的神经退行性疾病。据2018年《世界阿尔茨海默症报告》显示,全球约有5000万痴呆症患者,平均约3秒将新增一名患者。据估算,中国60岁上人口中痴呆患者约1507万,其中AD约983万,MCI约3877万人[1],每年新增超60万,是世界上阿尔兹海默症患病人口最多、增长速度最快的地区;65岁以上老年人阿尔兹海默症患病率为5.3%。
痴呆症是包括中国在内的全球65岁以上老年人的主要致残原因,且死亡率高,目前阿尔茨海默症死亡率排第五,仅次于脑卒中、心脏病、慢阻肺和肺癌。
阿尔茨海默症导致的经济负担重。对超过3000名痴呆症的调查显示,每人每年护理总费用近2万美元。全国每年因阿尔茨海默病造成的费用更是高达1680亿美元,其中超过一半为非直接成本,比如患者和家人因护理而误工产生的损失。而这一数值预计还将不断上升,到2030年再增加几乎2倍,到2050年则是现在的10倍多!中国阿尔茨海默病目前的社会经济负担占国内生产总值(GDP)的1.47%,高于全球平均水平(1.09%)[2]。
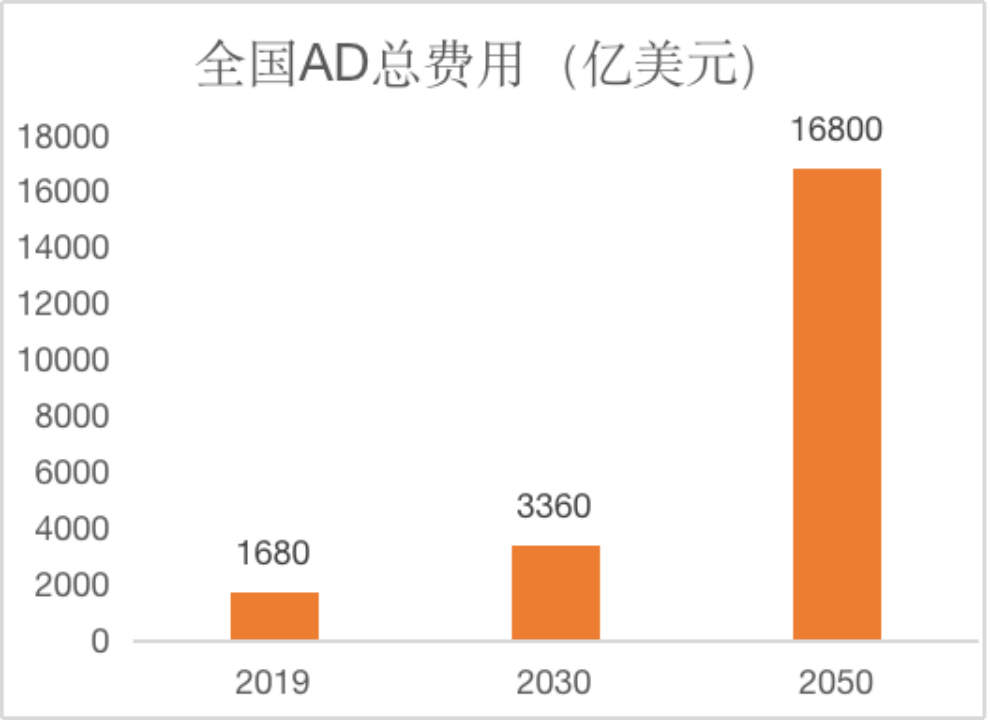
图1 全国阿尔茨海默症造成费用预测[2]
阿尔茨海默病是一个独立疾病,有其完整连续的疾病谱。从临床前期、轻度认知功能障碍期到痴呆期,有长达20-25年左右的演化过程。
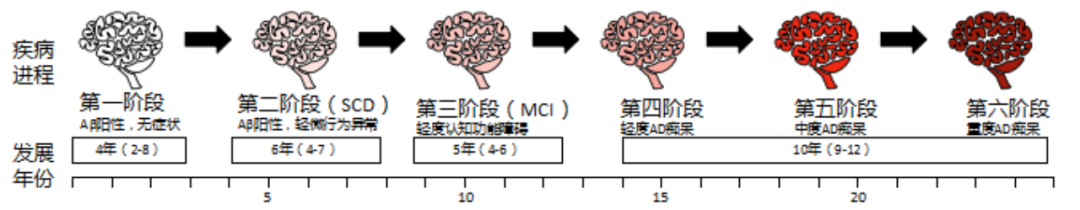
图2 阿尔茨海默症发展进程[5]
目前,阿尔茨海默症不能被治愈,药物治疗仅能延缓病程发展、缓解症状,但无法逆转。
研究显示:将患者由MCI发展为AD的进程延缓五年,就能将AD患者人数减少约50%[4]。因此,早期发现致病风险并预防是目前应对阿尔茨海默症的最佳方案。
02 阿尔茨海默症遗传性分析
阿尔茨海默症以65岁为界可分为早发性(early-onset AD,EOAD)和晚发性(late-onset AD,LOAD)两种,其中LOAD大约占94%。AD还可划分为家族性(familiar AD,FAD)和散发性(sporadic AD,SAD)2种。在EOAD中以FAD居多,在LOAD中则以SAD为主。
早发FAD多为常染色体显性遗传,其特点是发病率低、起病早、进展迅速、后果严重。目前已确认位于14、1、21号染色体上的PSEN1基因、PSEN2基因、APP基因为AD致病基因;其中PSEN1基因突变占75%~80%,APP基因突变占15%~20%,PSEN2基因突变不足5%[1]。FAD通常在65岁之前(最早可在30岁之前)发病,其家庭成员有50%概率携带一种致病变异,其中携带APP或PSEN1基因变异的人患病概率为100%,携带PSEN2基因变异的人患病概率为95%[5]。
2.1 APP基因突变
由APP编码的APP蛋白经过加工水解产生β淀粉样蛋白(β amyloid,Aβ)。病理情况下,APP经过β分泌酶和γ分泌酶分解生成Aβ40和Aβ42,其中Aβ42与AD患者脑中Aβ沉积和神经元的变性密切相关。
APP基因的大部分突变位于外显子16和17的分泌酶裂解位点或APP跨膜区,可以通过外显子16和17的序列分析或整个编码区测序来筛查突变。
APP突变改变了APP的加工过程,导致具有神经毒性作用的Aβ42产生,减少了Aβ40,此过程可通过多种病理机制,选择性的促使部分神经细胞凋亡或死亡,最终导致AD的发生。例如,错义的APP瑞典突变(APPswe:APPK670N和M671L)、伦敦突变(APPlon:APPV717I)和在澳大利亚家系发现的L723P可导致Aβ42水平增加,并发展为AD。
2.2 PSEN1基因突变
PSEN1和PSEN2基因编码的PS蛋白为γ分泌酶的重要组成部分,在生成Aβ的过程中起重要作用。PSEN1突变是引起早发FAD的最主要原因。PSEN1突变使其编码的蛋白亲水性环状结构域缺失,导致其构象改变,进而影响γ-分泌酶的活性,使Aβ42生成增多。
大部分PSEN1突变是错义突变。首都医科大学宣武医院贾建平课题组在我国汉族7个家族性AD家系共218名成员中发现了2个新的PS1基因突变 (Val97Leu和Ala136Gly错义突变),并建立了Val97Leu转基因小鼠模型,初步证实了其致病性[6]。
2.3 PSEN2基因突变
PSEN2与PSEN1有高度的同源性(80.5%),它也参与Aβ的裂解。PSEN2基因突变与PSEN1相比,有较低的外显率,因此可能受其他基因的修正或受环境因素影响。PSEN2可通过对C末端肽水解酶的影响而作用于APP的水解过程,使聚集性Aβ42产生增多而发生沉积,形成神经炎性斑,并增加细胞内钙,加重氧自由基的产生,促进线粒体膜电位下降,从而引起细胞凋亡。PSEN2突变只在少数几个家系被发现,而PSEN1突变在几百个家系被发现。
SAD病因复杂,涉及到遗传、环境、代谢、病毒感染等多种因素。载脂蛋白E(apolipoprotein E,APOE)基因是目前唯一被公认的SAD易感基因。
2.4 APOE基因多态性
APOE包括3个等位基因ε2、ε3、ε4,其中ε2起保护作用,可降低AD的发病风险,推迟发病年龄;ε4是AD的危险因素,与AD发病率呈剂量依赖性关系。
研究显示,约58%的阿尔茨海默症患者携带至少1个APOE ε4等位基因,携带一个ε4等位基因的个体被诊断患有AD可能性是非携带者的3-4倍,而携带两个ε4等位基因的个体患AD的风险增加12-15倍[5-7];APOE ε4参与调节Aβ的生成,并且影响星形胶质细胞和神经元对Aβ的清除,促进淀粉样蛋白的形成和其在脑内的沉积,并进一步导致神经炎性斑和神经元死亡。同时APOE4蛋白不能有效地维持tau蛋白与微管蛋白的连接,导致tau蛋白异常磷酸化,从而降低了微管组装的能力。随之损害轴浆流,致使递质及一些不被迅速降解的神经元成分聚集在受累神经元内,导致神经功能减低、丧失,直至神经元破坏。
2.5 其他SAD易感基因
GTP环化水解酶1(GCH1)基因(rs72713460)和钾内向整流通道亚家族J成员15(KCNJ15)基因(rs928771)的常见变异首次被确定为中国人群AD的危险因素,它们可能影响免疫相关通路,导致AD的发病年龄提前[8]。
03 病例分享
(1)患者情况:患者,男性,47岁,小学老师,大专文化。因“反应迟钝,记忆力下降2年”为主诉入院。患者两年前开始无明显诱因地出现反应迟钝、记忆力下降,主要为近记忆力下降:不记得刚刚讲过的话,不记得刚刚吃过的饭,远期记忆力相对保留。近一年来患者不喜交流,语言减少,表达能力下降,找词困难,能听懂别人说的话,但是不能完整表达自己的意思。
(2)家族史:患者的奶奶和父亲有痴呆病史,兄弟姐妹7人中部分有记忆问题。
(3)相关检查:
-
体格检查:意识清楚,言语表达困难,注意力差,远记忆力尚保留,近记忆力差计算力较差:连续计算100-7计算题中有三次错误理解力尚保留,时间和空间定向力完整。患者行动迟缓。颅脑神经检查无阳性体征。四肢运动、感觉、反射正常。共济运动不配合。
-
实验室检查:血常规,尿常规,大便常规,肝肾功能,血脂,血糖电解质,糖化血红蛋白,贫血四项,甲状腺功能,梅毒抗体、HIV抗体均无显著异常。
-
神经心理检查:进行认知评估,评估内容主要包括:1)总体认知评估:简明精神状态量表(MMSE)、阿尔茨海默病认知行为量表(ADAS-cog)和临床痴呆评定量表(CDR);2)精神行为评估:神经精神量表(NPI);3)日常生活能力:日常生活能力量表(ADL);4)语言评估:语音流畅性,语义流畅性,波士顿命名。MMSE评分为13,ADAS-cog评分为18,CDR评分2,ADL评分为30。
-
影像学检查:对患者进行头部MRI平扫,与正常对照相比,患者有不同程度的脑萎缩。
(4)基因检测。医生怀疑患者为家族性阿尔茨海默症,建议进行基因检测。检出1个匹配受检者临床表型的致病性的基因变异:APP基因c.G2149A:p.V717I杂合变异。APP编码的APP蛋白经过加工水解产生β淀粉样蛋白(Aβ)。病理情况下,APP 经过β分泌酶和γ分泌酶分解生成Aβ40和Aβ42,其中Aβ42与AD患者脑中Aβ沉积和神经元的变性密切相关。APP基因c.G2149A:p.V717I杂合变异,被ClinVar数据库收录为致病性的基因变异,且在多个家族中报道了该致病性变异位点,根据ACMG遗传变异分类标准与指南,判定为致病性的变异。
04 改善AD的治疗方案
目前,所有药物治疗AD只能在一定程度上改善AD的症状(如:调节神经元兴奋传导、减缓AD患者认知障碍等),并不能改变AD患者的发病进程从而治愈AD。
(1)乙酰胆碱酯酶抑制剂(ChEIs)。胆碱酯酶抑制剂增加突触间隙乙酰胆碱含量,是现今治疗轻中度AD的一线药物,主要包括多奈哌齐、卡巴拉汀、加兰他敏。多奈哌齐10mg/d可产生最佳维持效果,认知获益突出,安全性好(1A);卡巴拉汀9.5mg/d贴剂可产生最佳维持效果,认知与总体获益与12mg/d胶囊相当,安全性优于胶囊(1A);加兰他敏24mg/d可产生最佳维持效果,总体获益明显,安全性好(1A);应用某一胆碱酯酶抑制剂治疗无效或因不良反应不能耐受时,可根据患者病情及出现不良反应程度,调换其他ChEIs或换作贴剂进行治疗,治疗过程中严密观察患者可能出现的不良反应(3C)。
(2)谷氨酸受体拮抗剂。N-甲基-D-天冬氨酸受体(NMDA)拮抗剂通过减缓兴奋性神经递质谷氨酸的传递,降低对神经细胞的过度持续兴奋度,保护神经细胞。盐酸美金刚是AD治疗一线药物,是FDA批准的第一个用于中重度痴呆治疗的药物。美金刚对中重度AD患者妄想、激越等精神行为异常有一定治疗作用。美金刚20mg/d对中重度AD痴呆的认知和总体有一定疗效(1A);美金刚联合胆碱酯酶抑制剂治疗中重度AD痴呆的认知、总体、行为有协同效应(1A)。
(3)中医药。中医药治疗AD痴呆具有一定效果。与患者交代治疗益处和可能风险后,可以适当选用银杏叶提取物、清宫寿桃丸等中药联合常规西药共同治疗AD痴呆。
参考文献:
[1]中华医学会神经病学分会痴呆与认知障碍学组. 阿尔茨海默病源性轻度认知障碍诊疗中国专家共识2021[J]. 中华神经科杂志, 2022, 55(5): 421-440.
[2] Jia L, Quan M, Fu Y, et al. Dementia in China: epidemiology, clinical management, and research advances[J]. Lancet Neurol. 2020;19(1):81-92.
[3] Clifford R JJ, David AB, Kaj B, et al.NIA-AA Research Framework: Toward a biological definition of Alzheimer's disease[J].Alzheimers Dement. 2018,14(4):535-562.
[4] Julie Zissimopoulos, Eileen Crimmins, Patricia St Clair. The Value of Delaying Alzheimer's Disease Onset.Forum Health Econ Policy. 2014 Nov;18(1):25-39.
[5] 田金洲,解恒革,王鲁宁,王荫华,王华丽,时晶,秦斌,樊东升,倪敬年,孙永安,中国老年保健协会阿尔茨海默病分会(ADC)指南小组.中国阿尔茨海默病痴呆诊疗指南(2020年版)[J].中华老年医学杂志,2021,40(3):269-283
[6] Jia L, Fu Y, Shen L, Zhang H, et al. PSEN1, PSEN2, and APP mutations in 404 Chinesepedigrees with familial Alzheimer's disease. Alzheimers Dement.2020;16(1):178-91.
[7] Chen-Ling Gan, Tao Zhang, Tae Ho Lee.The Genetics of Alzheimer’s Disease in the Chinese Population[J]. Int J Mol Sci. 2020 Apr; 21(7): 2381.
[8] Zhou X., Chen Y., Mok K.Y.,et al. Identification of genetic risk factors in the Chinese population implicates a role of immune system in Alzheimer’s disease pathogenesis[J]. Proc. Natl. Acad. Sci. USA. 2018;115:1697–1706.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)