首页 > 医疗资讯/ 正文
HBV感染是全球公共卫生领域的重大挑战,流行病学数据显示全球慢性HBV感染者已逾3.16亿例。慢加急性肝衰竭(ACLF)是慢性肝病病程中由多种诱因导致的急性肝功能失代偿,具有临床进程凶险、病死率高的特征。值得注意的是,HBV-ACLF的疾病进程呈现显著时相异质性,近年研究证据表明,动态监测关键生物标志物的演变规律较单时点基线参数更能精确评估疾病进展及预后转归。现有ACLF预测模型多聚焦于28 d及90 d预后评估,而缺乏针对恢复期患者肝纤维化甚至肝硬化进展风险的纵向研究,且分析方法多采用单一时间点数据,对生物标志物动态演变轨迹的关注相对不足。基于轨迹的动态变化进行不同趋势分类在多个领域得到了广泛应用,这些方法考虑了个体之间的异质性,相比单一时间点的数据,更能准确反映病情的变化,从而为评估预后和制订治疗决策提供临床实用性指导。本研究通过分析非肝硬化背景的HBV-ACLF患者1年的不同临床结局及其生化指标和预后评分28天内的不同轨迹变化,阐明指标动态变化与结局之间的关联性,以期指导临床制订精准化治疗策略。
1资料与方法
1.1 研究对象
前瞻性选取2016年1月—2023年12月就诊于首都医科大学附属北京佑安医院的非肝硬化HBV-ACLF患者,纳入标准包括:(1)年龄≥18周岁;(2)HBsAg和/或HBV DNA阳性持续6个月以上;(3)依据中国重型乙型肝炎研究组(COSSH)ACLF标准诊断为HBV-ACLF;(4)住院期间完成腹部CT检查;(5)随访时间≥1年。排除标准:(1)肝硬化基础上发生的ACLF;(2)合并肝细胞癌或其他恶性肿瘤;(3)合并其他类型(甲型、丙型、戊型、丁型)肝炎病毒感染;(4)存在自身免疫性肝病;(5)酒精性肝病、药物性肝损伤等其他因素为基础病因的ACLF;(6)存在严重的肝外器官慢性基础病。按照指南中的诊断标准定义肝硬化。
1.2 资料收集
收集患者的人口学资料、病历资料、检查化验指标,化验指标随访时间点包括第1、3、7、14、21、28天,至少随访3次,同时随访记录1年终点事件。根据患者结局分为肝硬化组、非肝硬化组和死亡或肝移植组。
2结果
2.1 一般资料
本研究共纳入154例患者,平均年龄(43.9±10.9)岁,其中男性130例(84.4%),经1年随访观察,27.9%(43/154)的患者发生死亡或接受肝移植(死亡或肝移植组),14.9%(23/154)进展为肝硬化(肝硬化组),57.2%(88/154)维持非肝硬化状态(非肝硬化组)。根据表1可知,154例非肝硬化基础上发生HBV-ACLF患者的主要诱因包括停药后病毒再激活、自发激活、肝毒性药物的使用以及感染和劳累等其他因素,组间差异无统计学意义(P>0.05)。诊断ACLF后,抗病毒药物主要为恩替卡韦和替诺福韦,所有患者依从性良好,组间差异无统计学意义(P>0.05)。3组间腹水和肝性脑病发生率,MELD、MELD-Na、CLIF-C ACLF和COSSH-ACLF Ⅱ评分,以及TBil、INR、血钠、AFP、ALT和PCT水平比较差异均有统计学意义(P值均<0.05)。针对存活的患者,1年时检测LSM并计算FIB-4分数,肝硬化组与非肝硬化组比较差异均有统计学意义(P<0.001)。
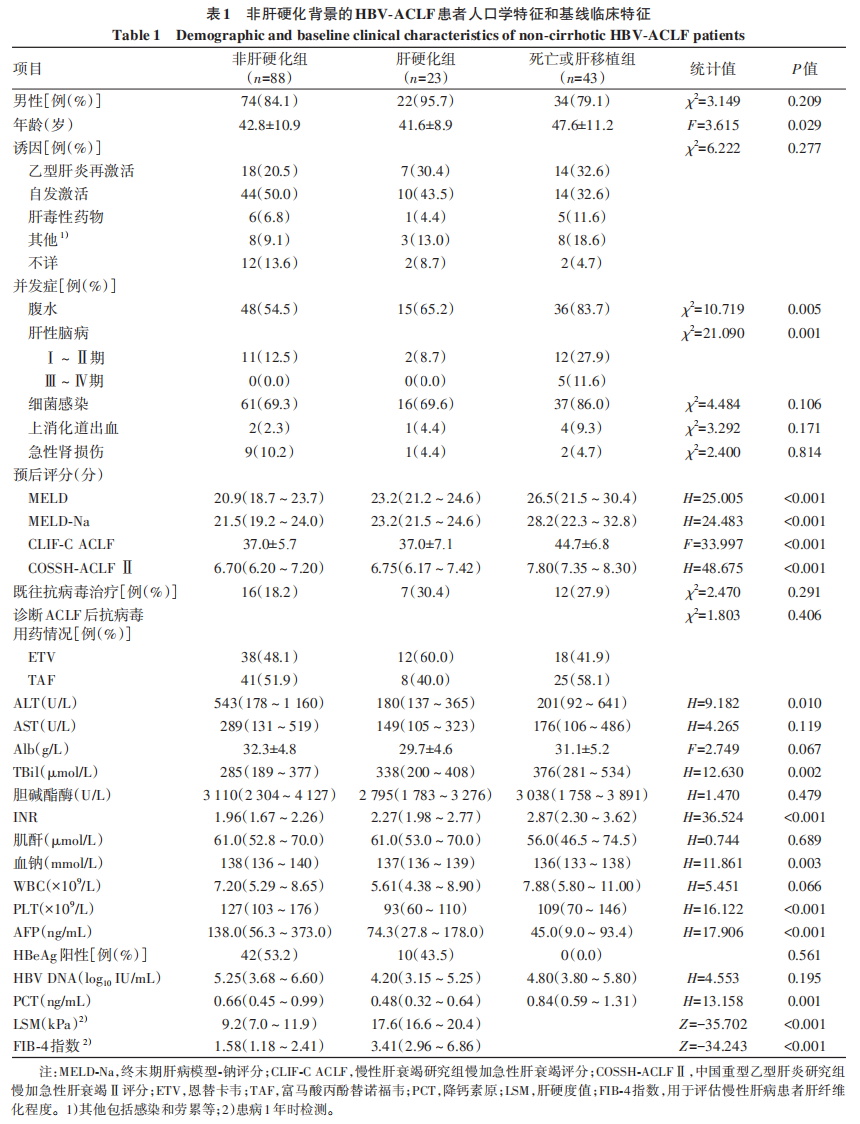
2.2 非肝硬化HBV-ACLF患者不同转归的临床指标纵向轨迹特征
2.2.1 28天内预后评分纵向变化趋势
3组患者从基线至随访28天MELD-Na、MELD、COSSH-ACLF Ⅱ及CLIF-C ACLF评分的动态变化趋势见图1。4个评分在3组患者中均呈现显著的时间趋势异质性(P值均<0.001)。进一步组间分析表明,MELD-Na与MELD评分的组间差异显著(P值均<0.001);COSSH-ACLF Ⅱ与CLIF-C ACLF评分在肝硬化组与非肝硬化组相较于死亡或肝移植组差异显著(P值均<0.05),而肝硬化组与非肝硬化组间无统计学差异(P值均>0.05)。死亡或肝移植组在所有评分上均维持最高水平,表现为早期上升后维持或缓慢下降;肝硬化组评分次之,且呈现相对稳定或缓慢下降的趋势;非肝硬化组评分最低,并随着时间推移持续下降。具体而言,死亡或肝移植组的MELD和COSSH-ACLF Ⅱ评分在10 d后呈缓慢下降趋势,而MELD-Na和CLIF-C ACLF评分维持稳定;肝硬化组的MELD-Na和MELD评分在随访10~14 d有所升高,随后下降,COSSH-ACLF Ⅱ和CLIF-C ACLF评分呈现较为平稳的下降趋势;非肝硬化组的MELD-Na和MELD评分自基线起持续降低,COSSH-ACLF Ⅱ和CLIF-C ACLF评分呈现较为平稳的下降趋势。
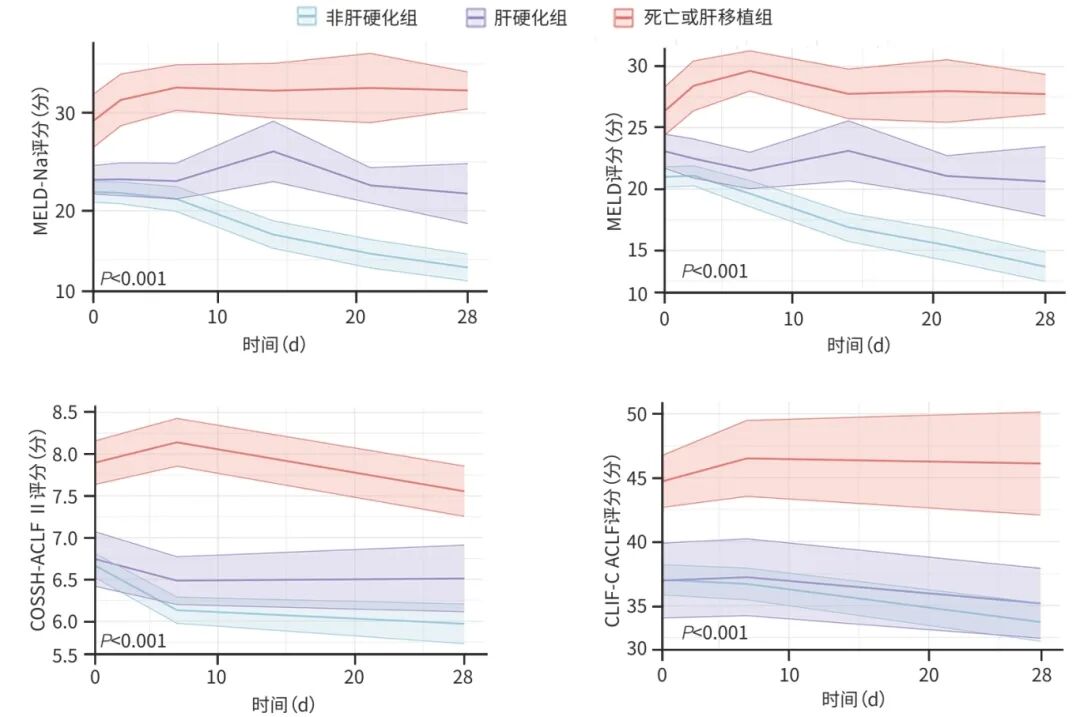
图1 28天内预后评分在不同结局患者中的纵向变化趋势
2.2.2 28天内临床指标纵向变化趋势
进一步分析3组患者重要临床指标的动态变化趋势(图2)。
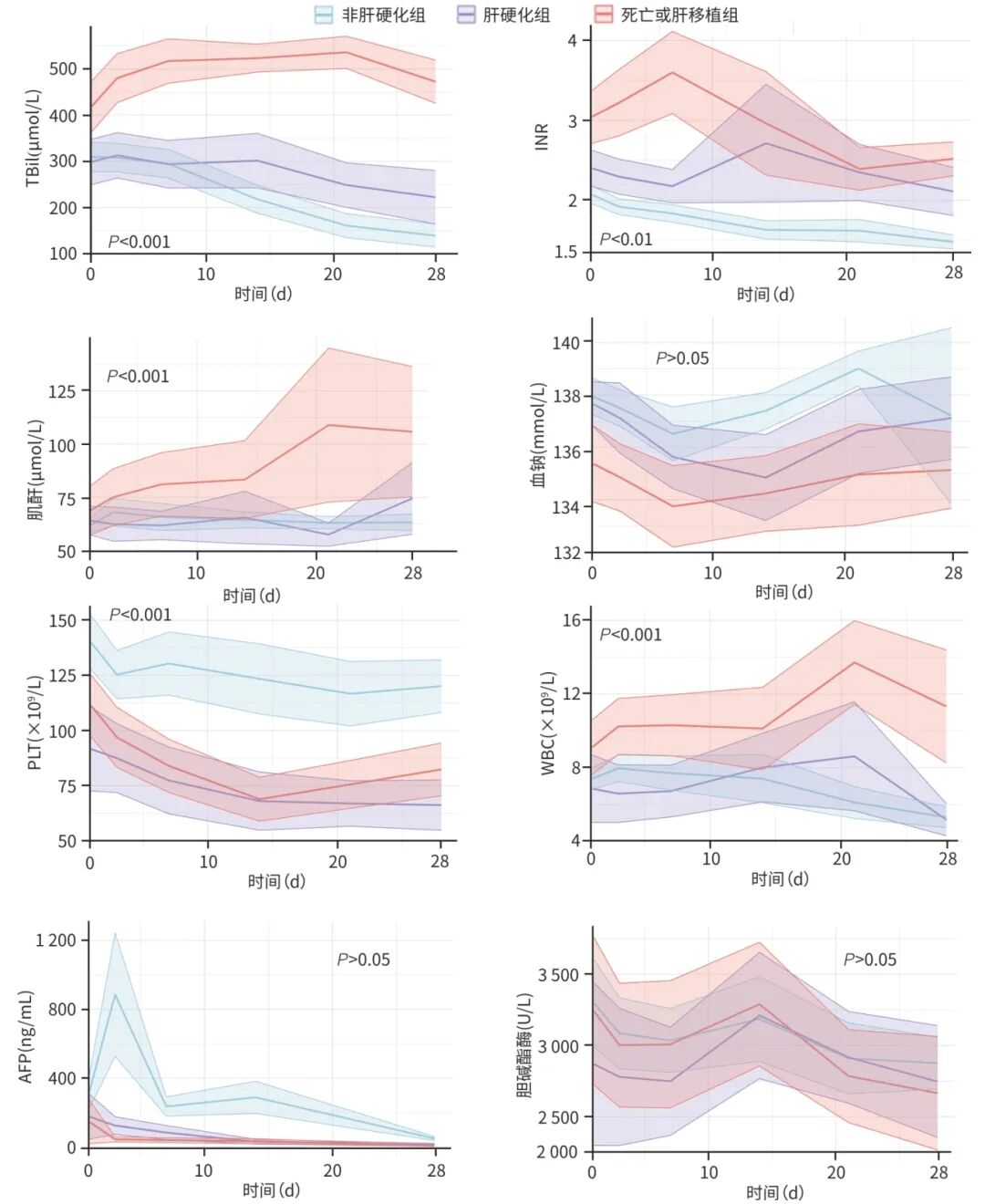
图2 28天内各指标在不同结局患者中的纵向变化趋势
2.2.2.1 TBil
3组TBil水平的时间趋势存在整体差异(P<0.001),进一步两两比较,各组间差异均显著(P值均<0.001)。死亡或肝移植组的TBil水平显著高于其他两组,且在随访早期(0~10 d)进行性升高至稳定后呈现缓慢下降趋势,但始终高于400 μmol/L;肝硬化组TBil水平次之,非肝硬化组最低,两组均呈逐步下降趋势,28天时非肝硬化组均值低于200 μmol/L,而肝硬化组高于200 μmol/L。
2.2.2.2 INR
3组INR的时间趋势存在整体差异(P<0.01),进一步两两比较,非肝硬化组与死亡或肝移植组间差异有统计学意义(P<0.05)。死亡或肝移植组的INR水平在基线时高于其他两组,并在随访早期(1周内)进一步升高,随后呈下降趋势,但均值始终仍高于其他两组,且28天时均值高于2.5;肝硬化组INR水平次之,14天达到峰值,随后逐步下降,但始终高于2.0;而非肝硬化组自基线起持续降低,28天时低于1.5。
2.2.2.3 肌酐
3组肌酐的时间趋势存在整体差异(P<0.001),进一步两两比较,肝硬化组和非肝硬化组与死亡或肝移植组相比,差异均有统计学意义(P值均<0.01)。在死亡或肝移植组随访14~28 d时肌酐显著升高,肝硬化组和非肝硬化组持续低水平,无明显波动。
2.2.2.4 血钠
3组血钠的时间趋势差异无统计学意义(P>0.05)。死亡或肝移植组血钠浓度最低,第7天达最低值后持续低于基线水平且均值低于正常水平(137~147 mmol/L);非肝硬化组血钠平均水平最高,肝硬化组介于2组之间。
2.2.2.5 PLT
3组PLT的时间趋势均存在显著差异(P<0.001),进一步两两比较,非肝硬化组、肝硬化组与死亡或肝移植组相比,差异均有统计学意义(P值均<0.05)。在基线时,非肝硬化组的PLT水平最高,随后呈现缓慢下降趋势,但仍持续高于其他两组。具体而言,非肝硬化组的PLT水平从基线时的140×109/L逐渐下降至28天时的120×109/L,且始终维持在100×109/L以上。死亡或肝移植组的PLT水平次之,肝硬化组最低,分别从110×109/L降至80×109/L和从90×109/L降至60×109/L。
2.2.2.6 WBC
3组WBC的时间趋势均存在显著差异(P<0.001),进一步两两比较,非肝硬化组、肝硬化组与死亡或肝移植组相比,差异均有统计学意义(P值均<0.05)。死亡或肝移植组的WBC计数在14天以后较基线时明显升高,而肝硬化组和非肝硬化组的WBC计数均值波动在正常范围水平(3.5×109~9.5×109/L)。
2.2.2.7 AFP
非肝硬化组在基线时高于其他2组,并在早期快速上升后下降;死亡或肝移植组及肝硬化组的起始AFP水平较低,随时间呈轻微下降趋势,但3组的时间趋势差异无统计学意义(P>0.05)。
2.2.2.8 胆碱酯酶
3组患者的胆碱酯酶水平无明显差异(P>0.05)。
3讨论
目前,众多研究结果显示,ACLF患者在短期(28天)和中期(90天)预后较差的情况下,其基线指标比存活患者更差,且不良预后评分更高。本研究通过分析非肝硬化HBV-ACLF患者的基线数据、多个时间点的预后评分及临床重要指标发现,死亡或肝移植组患者在28天内的预后评分及关键指标整体维持较高水平,并在早期呈现恶化趋势;而非肝硬化组的各项指标则持续改善。生化指标动态监测显示,死亡或肝移植组的TBil与INR水平显著高于肝硬化组及非肝硬化组,其中TBil在随访早期快速升高后持续>400 μmol/L,INR在28天时仍>2.5,PLT始终处于低水平(<100×109/L)。非肝硬化组的PLT水平始终高于其他2组,且其TBil与INR在28天分别降至200 μmol/L和1.5以下。上述指标在3组患者之间形成显著分层。
目前临床上常用的预后评分包括MELD-Na、MELD、COSSH-ACLF Ⅱ及CLIF-C ACLF,多项研究已证实上述评分对ACLF患者短中期结局的预测性能良好。与上述结果一致,本研究发现,相对于肝硬化和非肝硬化组,死亡或肝移植组在所有评分上均维持最高水平。进一步详细分析动态变化趋势,对于死亡或肝移植组患者,MELD-Na和CLIF-C ACLF评分达到高峰后呈现稳定或上升趋势,与病情进展严重程度相符合,而MELD和COSSH-ACLF Ⅱ评分在1周左右达到高峰后出现一定程度的下降。这可能是因为ACLF病情进展后出现顽固性低钠血症和肝外器官衰竭,故病程中MELD-Na和CLIF-C ACLF相对MELD和COSSH-ACLF Ⅱ更能反映病情严重程度。本研究分析得出,对于1年是否肝硬化,MELD-Na和MELD评分能更好地区分此结局,未发生肝硬化的患者,呈现持续下降,28天时低于15分,而肝硬化的患者未见明显下降,波动于20分左右。死亡或肝移植组患者MELD-Na和MELD评分始终高于25分。与本研究结果一致,既往多项研究证实MELD、MELD-Na评分对肝硬化患者预后有良好的预测效能,如果MELD-Na和MELD评分28天时较基线无明显下降,发生肝硬化的概率比下降的患者显著升高。
本研究动态监测了非肝硬化HBV-ACLF不同转归患者的血液指标变化,结果显示,死亡或肝移植组患者TBil、INR水平显著高于存活的患者,而PLT低于无肝硬化患者,这与既往结果一致,TBil、INR和PLT是预测ACLF死亡风险的重要指标。对于存活的患者,肝硬化组相对于未发生肝硬化的患者,其TBil、INR更高,PLT更低。TBil是反映肝细胞功能及胆汁代谢的重要指标,其升高提示肝功能受损、肝细胞坏死及胆汁淤积,是ACLF最常见的变化。胆汁淤积持续存在可发展为肝纤维化和肝硬化。INR是衡量肝脏合成功能和凝血功能的关键指标,INR升高是ACLF不良预后的独立危险因素,也是肝硬化患者病情进展的标志。PLT计数可能与门静脉高压导致的脾功能亢进、促血小板生成素减少以及弥散性血管内凝血等多因素相关。血PLT减少不仅是肝硬化严重程度的标志,还与门静脉血栓形成及出血风险增加相关,可作为预后评估的关键指标。本研究通过纵向分析进一步验证了TBil、INR、PLT在HBV-ACLF患者不同临床结局中呈现显著不同的变化趋势。
本研究对于其他与ACLF患者预后相关的指标进行纵向分析,结果显示,死亡或肝移植组的WBC、肌酐水平显著高于存活的患者,而血钠、AFP水平低于存活的患者。死亡或肝移植组患者WBC的异常升高可能与继发感染或全身炎症反应加重有关,而感染是ACLF患者病情恶化的重要诱因,易引发脓毒症或多器官衰竭,从而导致患者死亡。ACLF患者的AFP水平与肝细胞再生有关,研究表明,在急性肝损伤过程中,AFP可作为肝细胞再生的标志物,短暂升高可能提示更强的肝再生能力及相对较好的预后。终末期肝病常合并肝肾综合征,肾功能恶化,尿素氮与肌酐的进行性升高,其病理生理机制可能为肾血管收缩及有效循环血容量不足,是肝硬化和ACLF患者不良预后的独立危险因素。死亡或肝移植组患者血钠持续低于基线,可能与门静脉高压及容量紊乱相关,难治性腹水与稀释性低钠血症形成了恶性循环,进一步加剧ACLF病情进展。本研究结果进一步验证了感染、肾功能恶化与电解质紊乱在ACLF患者中的病理生理作用,强调了动态监测临床重要指标对评估病情进展、指导个体化治疗及改善预后的重要临床价值。
总之,本研究表明,动态监测预后评分及关键临床指标在HBV-ACLF患者管理中具有重要临床价值。研究强调,在患者病程演进过程中,应密切监测病情动态变化,并在适宜时机实施个体化干预措施,以优化临床决策并改善预后。此外,利用多项生物标志物的动态监测,建立动态预后评估模型,可助力精准病情评估,优化治疗策略,从而提高患者生存率,提升整体治疗效果。
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCp50911

猜你喜欢
- Nat Commun:科学家识别出驱动结肠癌发生的关键新型基因
- 中医舌诊:常见体质舌诊解析(欢迎收藏)
- 蒸脸器冷喷可以当加湿器用吗 不建议这么做
- 【磷丙新知】扒一扒磷丙泊酚二钠对老年患者围手术期管理的影响
- Nat Immunol:迟洪波团队发现大脑中特化的T细胞减缓了阿尔茨海默病的进展
- 24小时抗流感,支持中国公共卫生事业发展 | 罗氏携手多方开启“以患者为中心” 流感健康生态
- 昆中药参苓健脾胃颗粒荣登“年度中华民族医药优秀品牌榜”
- 重症胰腺炎肠内营养支持方案及途径
- 没食欲不想吃饭是什么原因
- Am J Rhinol Allergy:慢性鼻窦炎伴鼻息肉患者嗅觉丧失、疾病负担与度匹鲁单抗疗效之间的关系
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)