首页 > 医疗资讯/ 正文
婴儿(年龄≤36个月)急性髓系白血病具有独特的生物学特征和较差的预后,但目前缺乏针对该年龄段的精准风险分层工具。约80%的婴儿AML患者被归为中危组,治疗选择面临挑战。因此,重庆医科大学附属儿童医院游华教授团队利用大规模临床和转录组数据,开发并验证了一个基于mRNA表达的、专门针对婴儿AML的预后模型(infant-prognostic-score,IPSscore/IPGroup),以改进风险分层,指导临床决策。研究结果近日发表于《Hemasphere》。

图文摘要
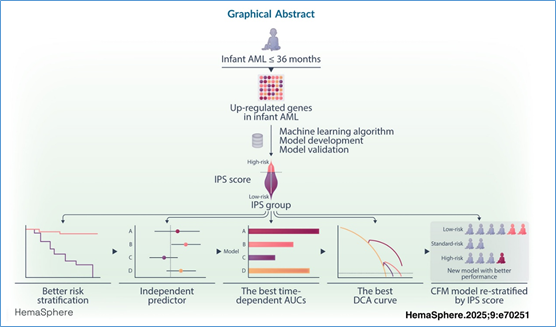
研究方法
数据来源:
发现集与内部验证集: 来自儿童肿瘤协作组(COG)四项儿科AML临床试验的TARGET项目数据(共340例婴儿AML患者,分为发现集213例和内部验证集127例)。
外部验证集: 来自中国重庆医科大学附属儿童医院和中山大学附属第一医院的63例婴儿AML患者数据。
健康对照: 70例健康儿童骨髓样本的转录组数据。
关键方法:
差异表达分析:识别婴儿AML相对于健康对照及年长儿童AML的差异表达基因。
机器学习模型构建:整合10种经典机器学习算法,生成40种算法组合,利用上调基因构建预后模型。
模型选择与验证:根据一致性指数(C-index)选择最佳模型(RSF+GBM组合,包含24个基因),并在内部和外部验证集中评估其预测无事件生存期(EFS)和总生存期(OS)的性能。
风险分层:根据IPSscore将患者分为低危组和高危组。
统计分析:比较IPGroup与现有分层模型(如COG风险组、LSC17评分、APS评分、CFM模型)的性能,评估其独立预后价值及临床效用。
研究结果
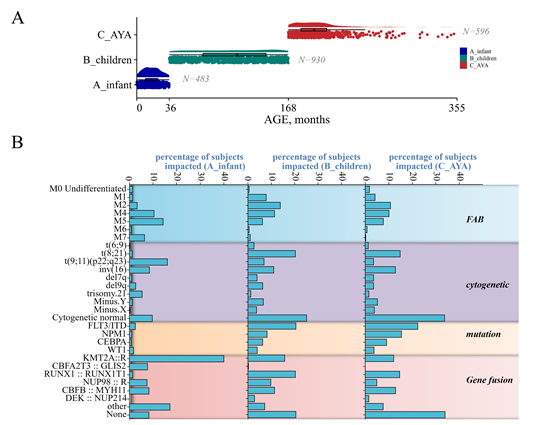
婴儿AML的独特性:与年长儿童和青少年/年轻成人患者相比,婴儿AML在临床特征(如更高白细胞计数、更多绿色瘤)、分子特征(如高频率KMT2A重排、CBFA2T3::GLIS2融合,低频率RUNX1::RUNX1T1融合)和预后(EFS和OS更差)方面均存在显著差异。
独特的转录组特征:婴儿AML表现出独特的基因表达谱,差异表达基因在免疫炎症反应、补体通路、移植物排斥、上皮-间质转化等癌症特征通路上显著富集。
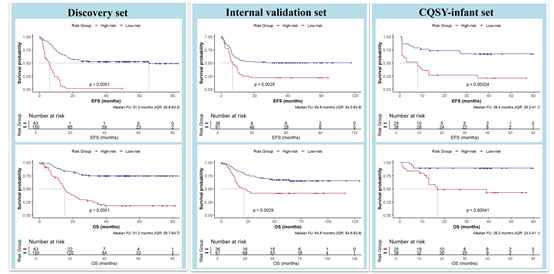
IPSscore/IPGroup模型的性能:
在发现集和验证集中,IPGroup均能有效区分婴儿AML的预后(EFS和OS),高危组预后显著较差。IPGroup是婴儿AMLEFS的独立预后因素。
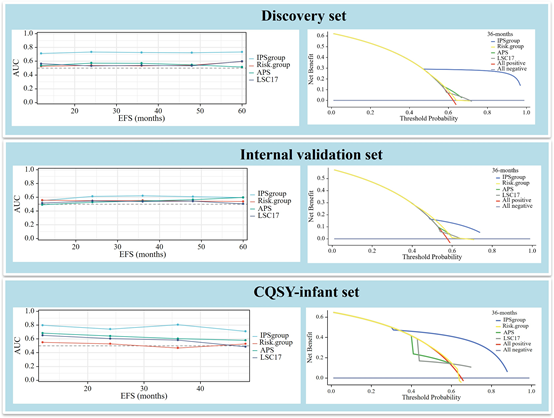
与COG、LSC17、APS等现有RNA表达模型相比,IPGroup在预测婴儿AML预后方面表现出更优或相当的判别能力(时间依赖性AUC更高)。决策曲线分析表明IPGroup具有临床实用性。
临床意义与价值
指导HSCT决策:分析显示,对于低危组患者,在第一次完全缓解期进行HSCT反而显著增加了复发/死亡风险;对于高危组患者,HSCT未显示出显著获益。表明IPGroup有助于识别可能无法从HSCT中获益甚至可能受害的低危患者。
优化现有分层:将IPSscore与当前临床使用的CFM细胞分子风险模型结合,能够对43%的婴儿AML患者进行重新分层,使风险分组更精确,从而改善了CFM模型的风险区分能力。
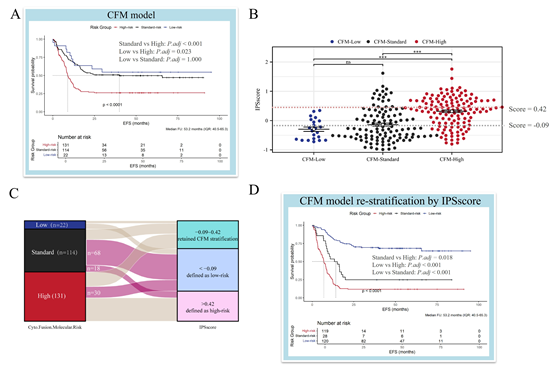
应用潜力:基于基因表达的工具可能比需要复杂遗传评估的模型更易在资源有限地区推广应用。
总结
该研究构建并验证了一个稳健的、基于mRNA表达的婴儿AML特异性预后模型(IPSscore/IPGroup)。
该模型能有效预测婴儿AML预后,性能优于或相当于现有模型,并显示出指导治疗决策(如HSCT)和优化现有风险分层体系的临床潜力。
研究成果有望助力婴儿AML的精准医疗,通过改进风险分层,最终目标是降低治疗相关毒性并改善预后。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/hem3.70251
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)