首页 > 医疗资讯/ 正文
光动力治疗(PDT)因微创、高选择性、低副作用等优势,已成为肿瘤治疗的重要手段。目前,PDT(光动力治疗)存在两个主要的局限性:一方面,光敏剂在细胞内的分布是随机的,而活性氧(ROS)的半衰期极短,且扩散距离有限(仅为0.01-0.02微米),使其难以有效地损伤核DNA;另一方面,肿瘤细胞的DNA修复机制(如PARP酶介导的单链断裂修复)会减少受损DNA片段的积累与释放。以上问题导致PDT无法诱导充足的肿瘤细胞免疫原性死亡(ICD),并削弱其对STING通路的激活效率,最终导致免疫反应不足。鉴于此,北大深圳医院孙德胜、北大戴志飞团队设计新型纳米光敏剂PNOR,通过核靶向光动力治疗与DNA修复抑制的协同作用,诱导剧烈的肿瘤免疫原性细胞死亡(ICD),同时激活STING通路介导的先天免疫,显著提升抗肿瘤疗效。相关成果以“Synergistic Nucleus-targeting Photodynamic Therapy andDNA Repair Inhibition to Activate Innate and AdaptiveAntitumor Immunity for Amplifying Photoimmunotherapy”为题发表在Nano Letters。
PNOR表面修饰肿瘤靶向的RGD肽,内部共载核靶向光敏剂Ppa-Nuc与DNA修复抑制剂奥拉帕利(Ola)(图1)。PNOR实现了“核DNA精准靶向损伤-抑制修复”的双重作用:PNOR被肿瘤细胞摄取后,Ppa-Nuc与细胞核DNA靶向结合,光照下局部生成大量ROS造成核DNA氧化损伤;同时Ola抑制PARP酶活性,阻断DNA修复过程,进一步放大损伤效应。大量的DNA损伤,同步激活先天免疫与适应性免疫,显著提升抗肿瘤疗效,相关成果为恶性肿瘤提供了全新的治疗策略。
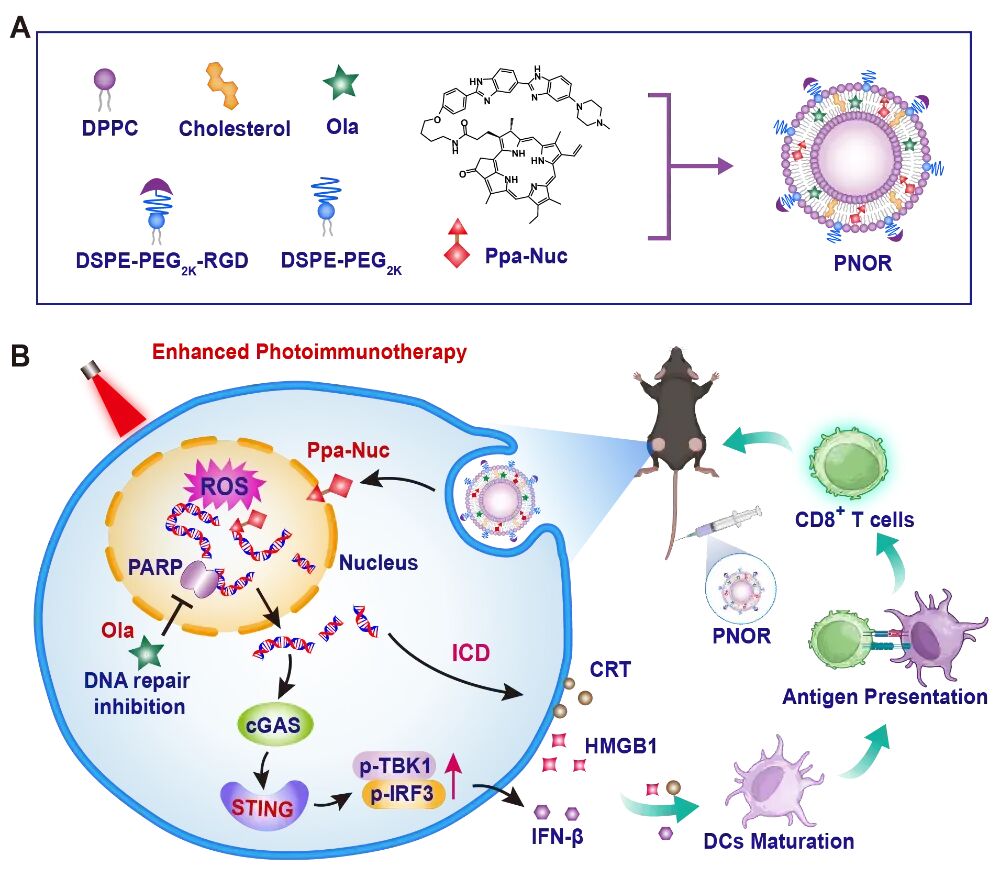
图1. PNOR介导的肿瘤光免疫疗法示意图。(A) PNOR自组装。(B)光动力疗法联合DNA修复抑制剂,通过同时激活免疫原性细胞死亡(ICD)诱导的适应性免疫及STING通路介导的先天免疫,增效肿瘤光免疫治疗。
体外细胞的荧光共聚焦结果显示,PNOR的红色荧光与细胞核探针PI的橙色荧光高度共定位,而与线粒体、溶酶体等其他细胞器几乎无重叠,证明了PNOR优异的核靶向能力。在细胞光毒性测试中,PNOR诱导的细胞凋亡率近50%,远高于未载Ola的对照组PNR。PNOR组肿瘤细胞表面钙网蛋白(CRT)与细胞外ATP分泌量为PNR组的1.5倍,证明PNOR能高效诱导肿瘤ICD。另外,利用γ-H2AX荧光探针证明PNOR组的DNA损伤是PNR组的2.9倍。Westernblot结果显示PNOR组的TBK1和IRF3磷酸化水平显著升高,p-TBK1/TBK1比值是其他组的2倍以上,p-IRF3/IRF3比值是其他组的5倍以上。以上结果表明PNOR通过诱导细胞核DNA损伤并抑制修复,有效激活了cGAS-STING通路(图2)。
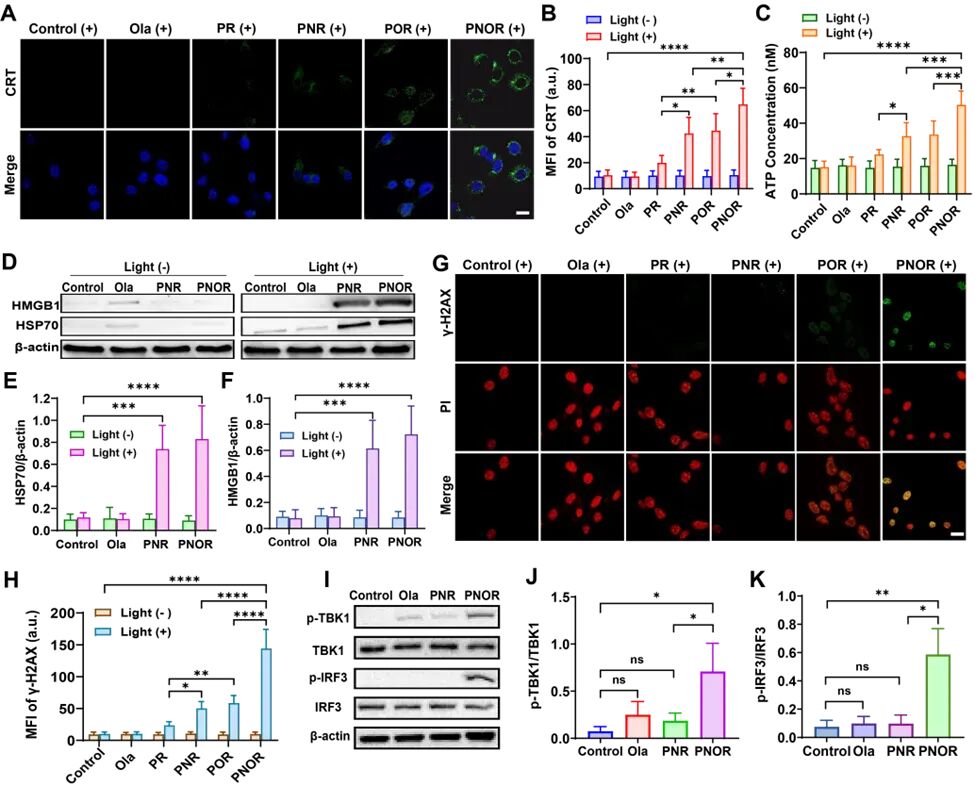
图2. 免疫原性细胞死亡(ICD)的诱导及STING通路的激活
在双侧皮下胰腺癌模型中,PNOR组的原发肿瘤在观察期内被完全清除且无复发,而PNR组虽初期能抑制肿瘤生长,但治疗后迅速复发;对于远端未光照肿瘤,PNOR组不仅延缓了复发时间,且肿瘤体积显著小于PNR组。通过探究免疫机制发现,PNOR可显著提升肿瘤微环境中免疫细胞的浸润与活化:成熟树突细胞(CD11c⁺CD80⁺CD86⁺)比例较对照组提高29%,较PNR组提高15%;活化CD8⁺T细胞比例较对照组提高21%,较PNR组提高11%;且CD8⁺T细胞中颗粒酶B阳性细胞比例达对照组的5倍,同时血清中IL-6、TNF-α等炎症细胞因子水平显著升高。以上结果证明PNOR成功激活了系统性抗肿瘤免疫响应(图-3)。
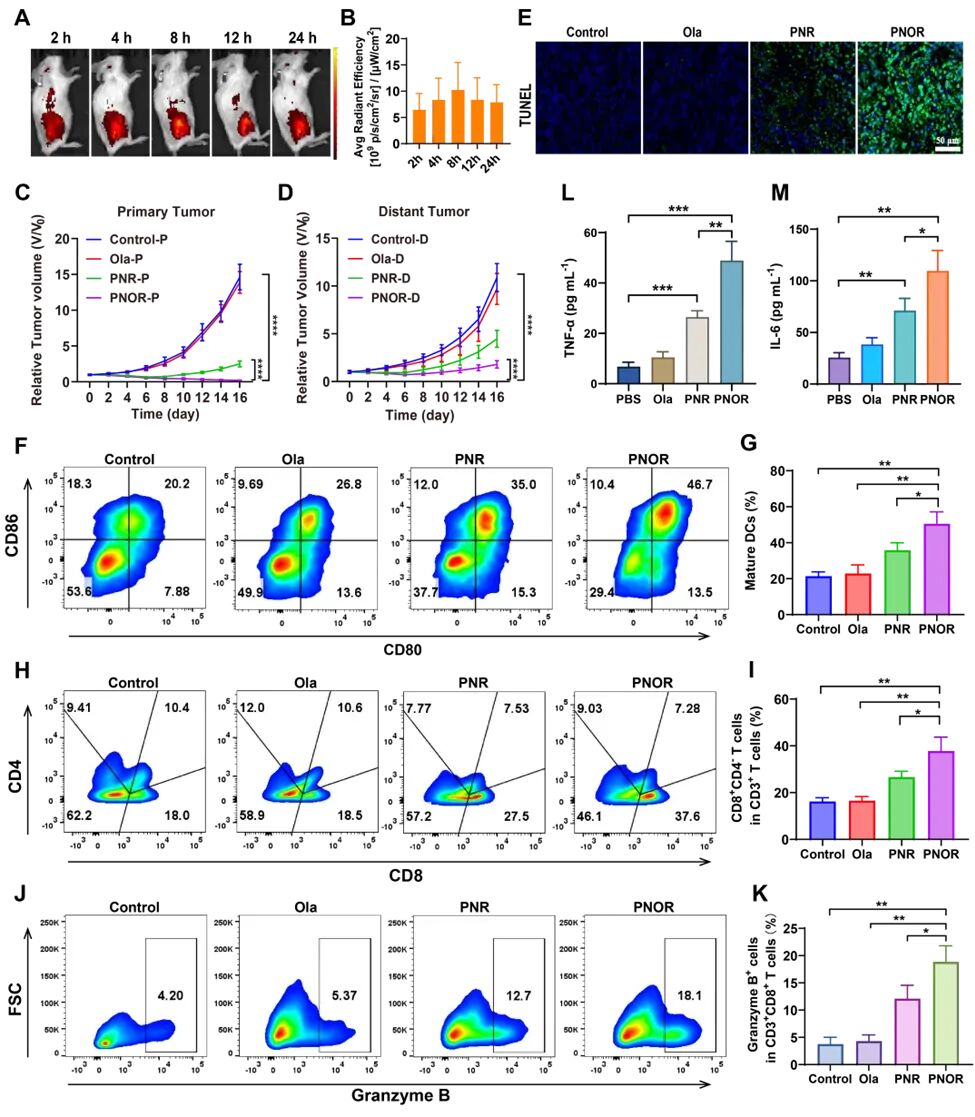
图-3 PNOR体内抗肿瘤疗效及免疫应答评估
【总结】
该研究创新性地将核靶向光敏剂与DNA修复抑制剂整合于同一纳米载体,通过“精准损伤核DNA+阻断修复”的协同策略,突破了传统PDT对肿瘤免疫激活不足的瓶颈。一方面,核靶向PDT提高了ROS对核DNA的损伤效率,促进更多氧化损伤DNA片段释放到细胞质,强效激活STING通路;另一方面,Ola抑制DNA修复,进一步放大损伤效应,增强ICD诱导效果。两者共同作用,同步激活先天免疫与适应性免疫,实现对原发肿瘤的清除和远端转移的抑制。这一研究不仅开发出具有临床转化潜力的新型光敏剂PNOR,更确立了“核靶向光敏剂+DNA修复抑制剂”的联合策略在肿瘤光免疫治疗中的核心价值,为后续恶性肿瘤治疗方案的优化提供了重要理论与实验依据。
原文链接:
https://pubs.acs.org/doi/10.1021/acs.nanolett.5c04141
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)