首页 > 医疗资讯/ 正文
主动脉瘤是一种严重的心血管疾病,起病隐匿,一旦破裂可危及生命,目前尚缺乏能够延缓瘤体进行性扩张或预防其破裂的干预手段。主动脉中层病变,包括平滑肌细胞凋亡、表型转化、炎症细胞浸润及细胞外基质降解是驱动主动脉瘤发生发展的关键病理环节[1]。生理状态下,血管平滑肌细胞通过维持收缩表型介导血管的结构和功能稳态,这一过程依赖于基质力学微环境与TGFβ信号的协同调控。其中,TGF-β通过磷酸化Smad复合体,促进SMAD2/3复合体核转位并驱动收缩表型标志基因的转录活化[2]。同时,整合素(如α5β1、αvβ3)通过介导平滑肌细胞与细胞外基质(如纤维连接蛋白、胶原等)的黏附,将机械力信号传递至平滑肌细胞骨架,维持平滑肌细胞收缩表型[3]。而在病理条件下,上述信号转导途径的异常会诱发平滑肌细胞发生表型转化,由收缩表型转变为合成表型,释放炎症介质和基质金属蛋白酶。
本团队在前期研究中系统揭示了TGFβ和整合素信号转导异常驱动主动脉瘤平滑肌细胞表型转化的机制。发现SLC44A2通过介导NRP1与ITGB3互作,释放TGFβ,减轻血管平滑肌细胞表型转化及主动脉瘤病变(J Clin Invest. 2025;135(11):e186628.)。同时,发现HINT1通过上调整合素6表达,激活FAK/STAT3信号转导通路,驱动血管平滑肌细胞表型转化和主动脉瘤进展(J Clin Invest. 2024;134(16):e173690.)。Ras信号是整合素与TGFβ信号转导通路下游的关键节点,其是否能够影响血管平滑肌细胞表型转化并参与主动脉瘤,目前尚不清楚。
2025年10月27日,南京医科大学和哈尔滨医科大学研究团队季勇教授、谢利平教授和韩艺教授在Nature Communications发表了题为“Ras-related protein 2 limits vascular smooth muscle cell phenotypic switching and abdominal aortic aneurysm development”的文章。系统分析了不同Ras家族成员在血管平滑肌细胞表型转化中的表达及变化情况,揭示了Ras相关蛋白2 (RRAS2)通过维持血管平滑肌细胞收缩表型,改善腹主动脉瘤的作用及其具体分子机制。

首先,研究团队在血管平滑肌细胞中系统分析了不同Ras亚型(HRAS、KRAS、NRAS、RRAS1、RRAS2、RRAS3)的表达情况,并在Ang II刺激诱导的平滑肌细胞表型转化模型中检测了不同Ras亚型的表达变化,同时,基于腹主动脉瘤患者血管组织及动物样本,通过多组合联合分析进一步筛选发现RRAS2是参与主动脉瘤相关平滑肌表型转化的核心基因。进一步结合临床样本、动物模型和细胞实验,证实主动脉瘤过程中平滑肌细胞中RRAS2的表达水平显著下降。
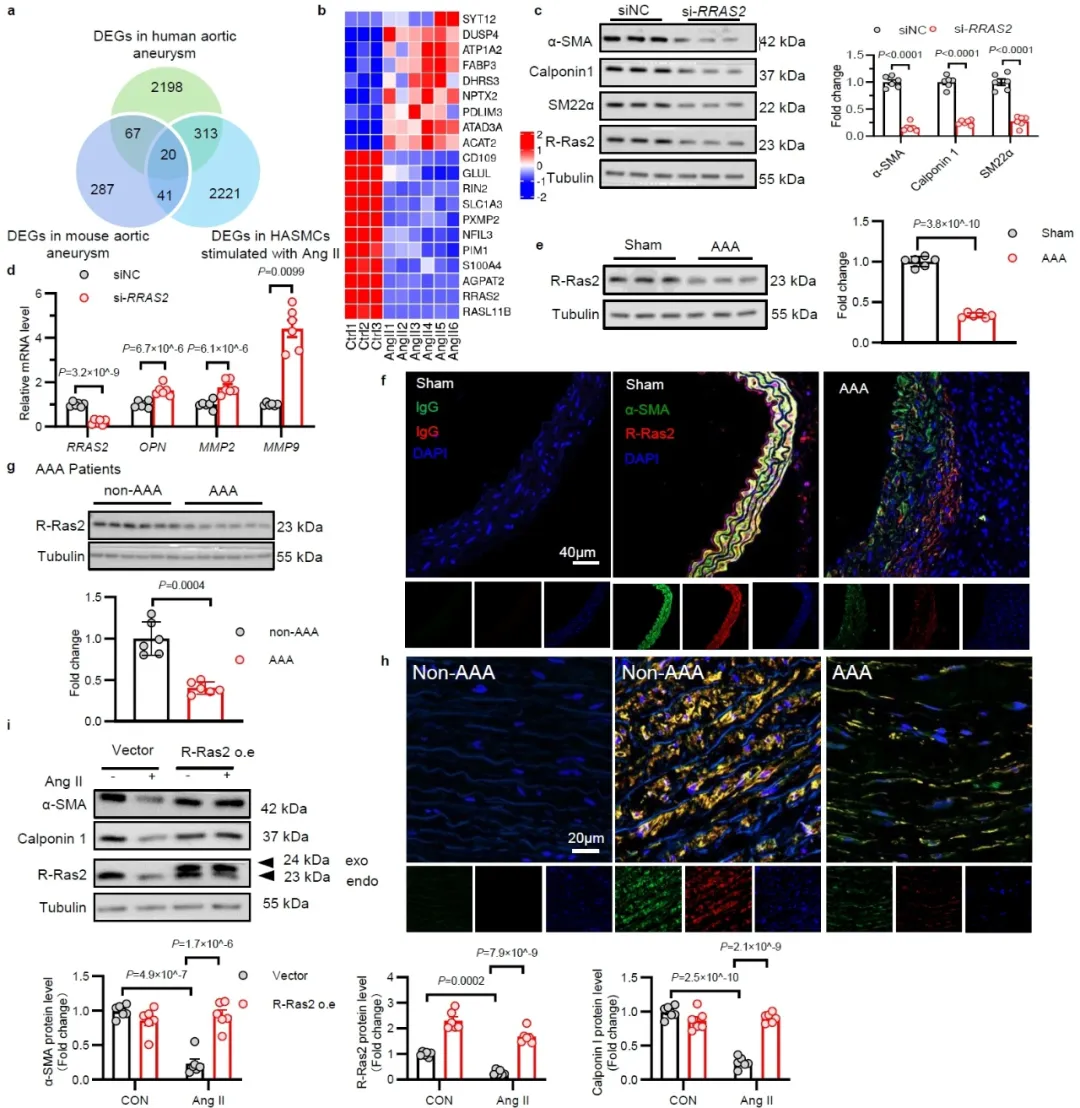
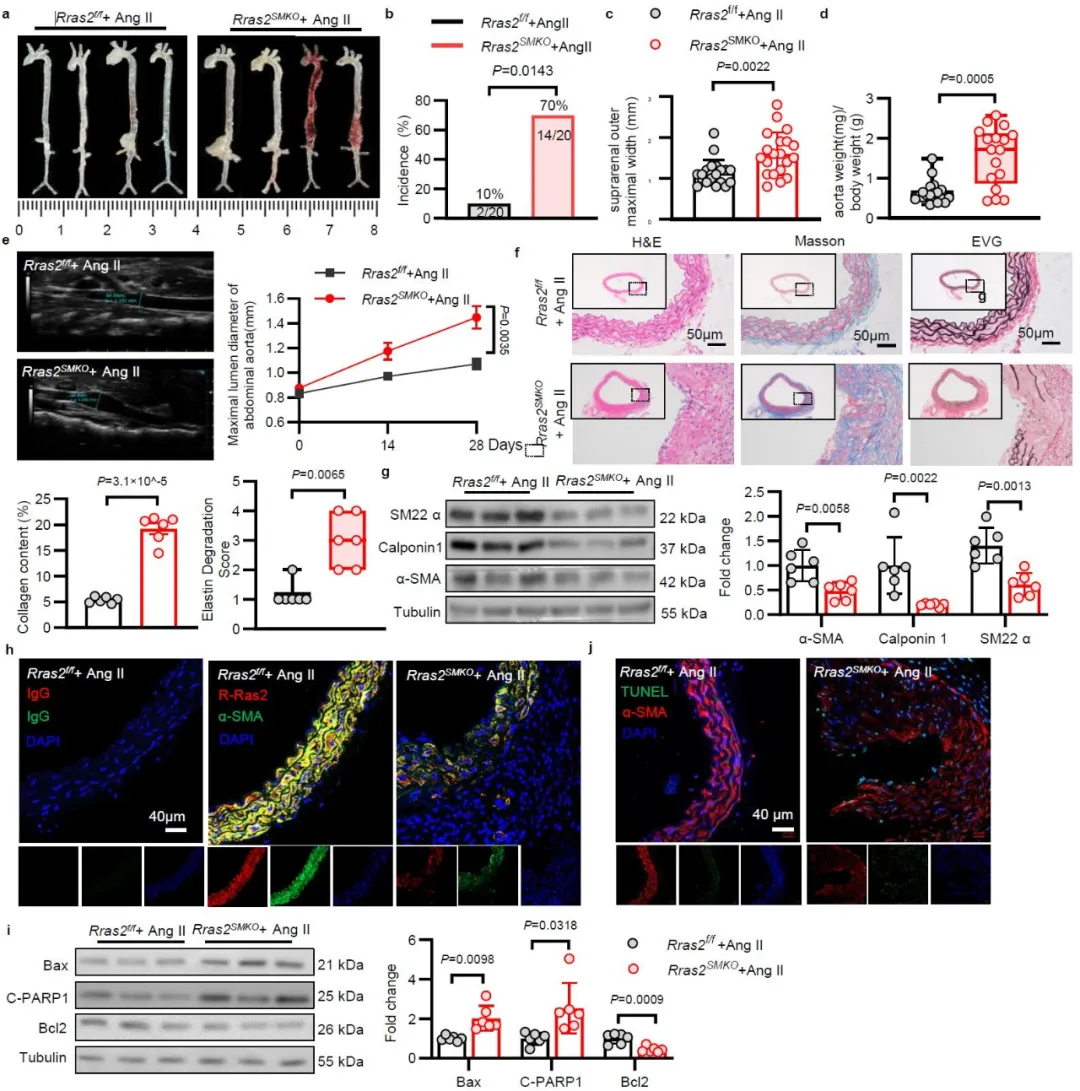
为了确定平滑肌细胞中RRAS2在腹主动脉瘤中的作用,研究团队构建了RRAS2平滑肌特异性敲除小鼠,或慢病毒诱导的RRAS2过表达小鼠。利用3种腹主动脉瘤模型(Ang II皮下埋置微渗泵、弹性蛋白酶(PPE)孵育及β-氨基丙腈联合PPE孵育),系统评价了RRAS2通过维持血管平滑肌细胞收缩表型,抑制主动脉瘤发生的作用。
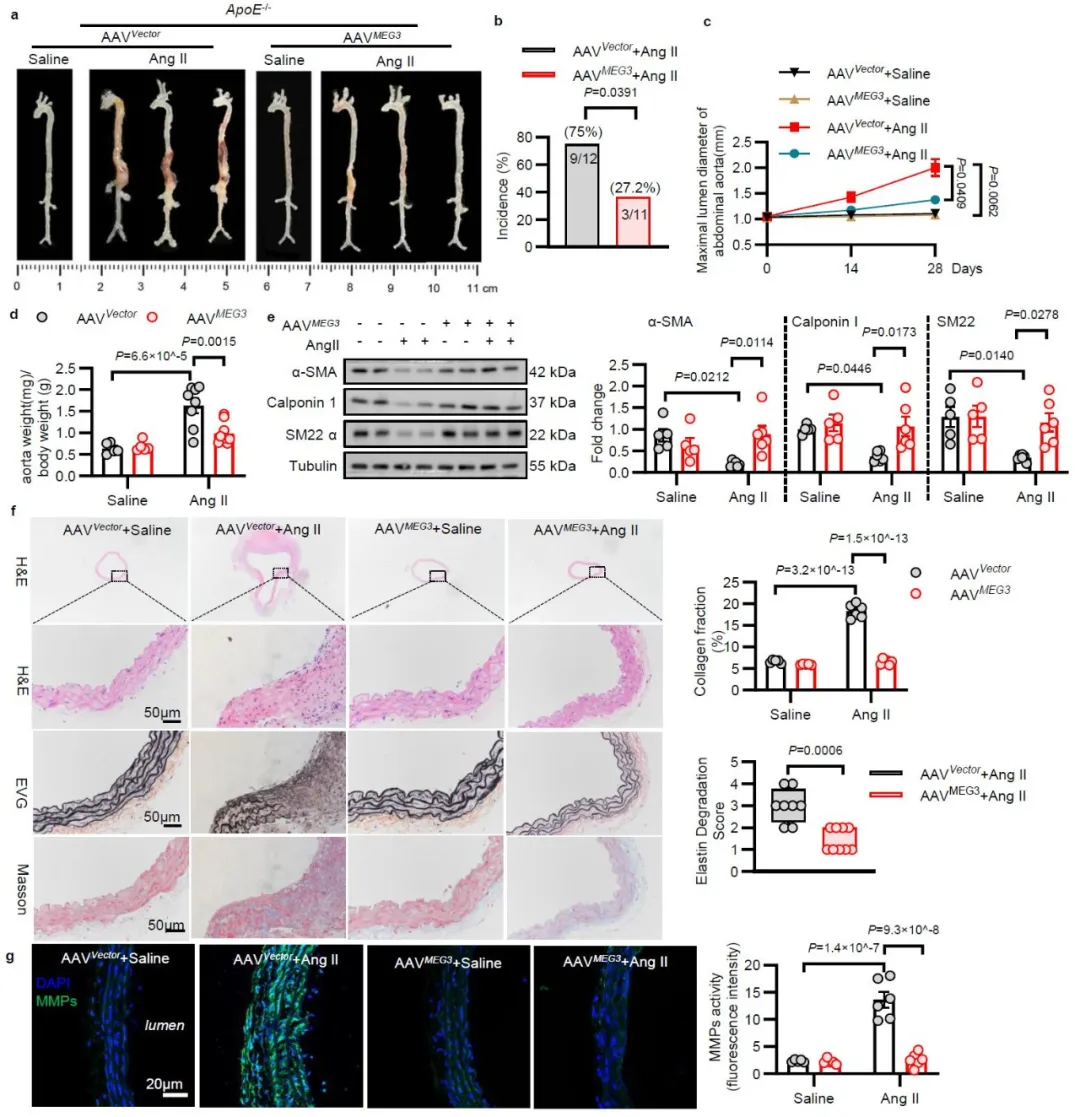
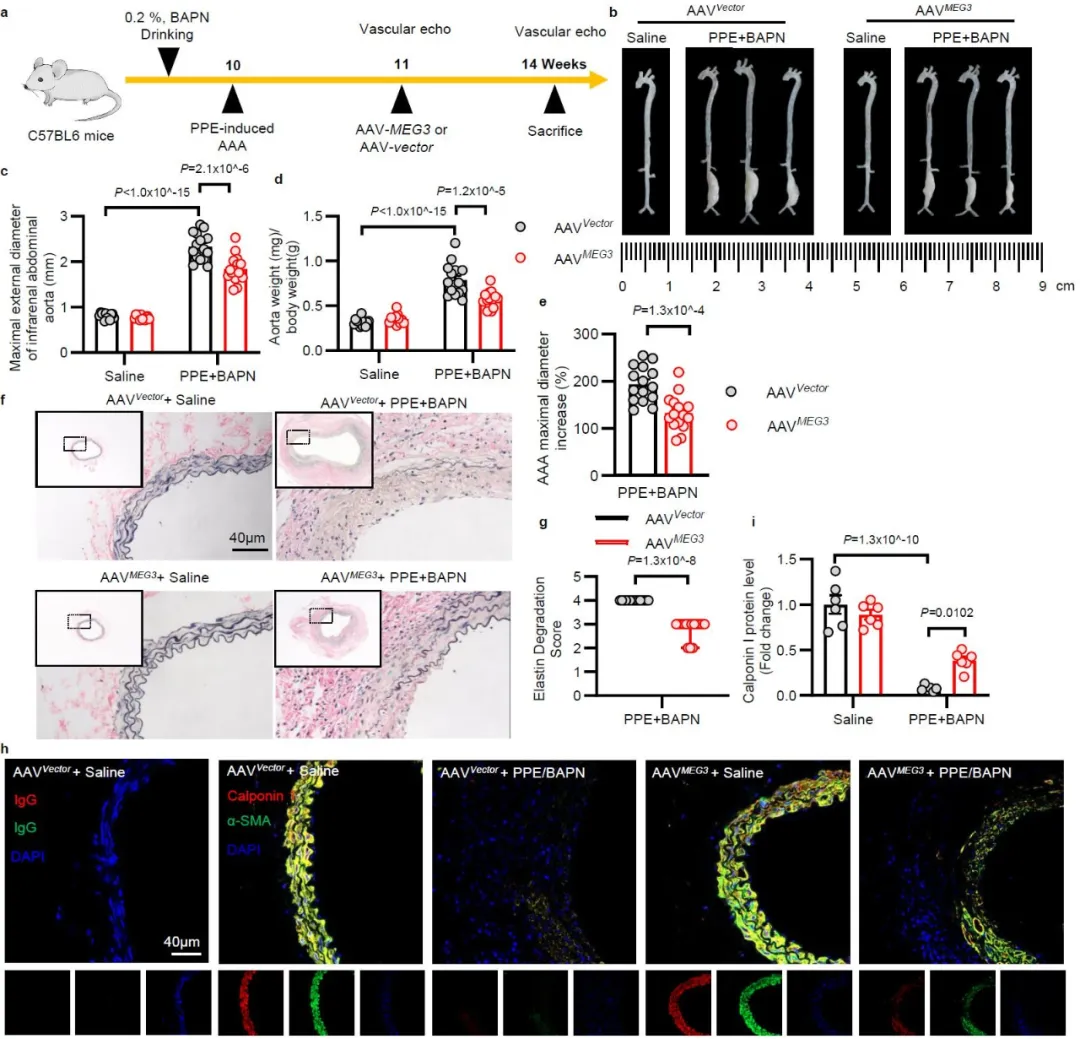
研究团队进一步发现血管平滑肌表型转化过程中,Rras2 mRNA稳定性下降,多组学联合分析结合分子生物学验证,发现RNA结合蛋白ELAVL1介导长链非编码RNA MEG3与Rras2 mRNA上ARE元件结合,从而维持其mRNA的稳定性。MEG3水平下降诱导Rras2 mRNA降解。
无论是在造模前,还是在腹主动脉瘤形成后,过表达MEG3均能够显著抑制中膜平滑肌细胞表型转化,并延缓小鼠腹主动脉扩张。
研究团队随后通过BioID联合质谱筛选,鉴定了RRAS2的上游激酶c-MET及下游效应分子TFII-I,通过定点突变、荧光素酶报告基因及染色质免疫沉淀等手段,证实RRAS2的F75/M78/Y82是RRAS2与c-MET-SOS系统结合的关键位点,两者结合能够诱导转录因子TFII-I磷酸化及核转位,促进平滑肌细胞收缩表型相关基因TAGLN、ACTA2、CNN1的表达,维持平滑肌细胞收缩表型。
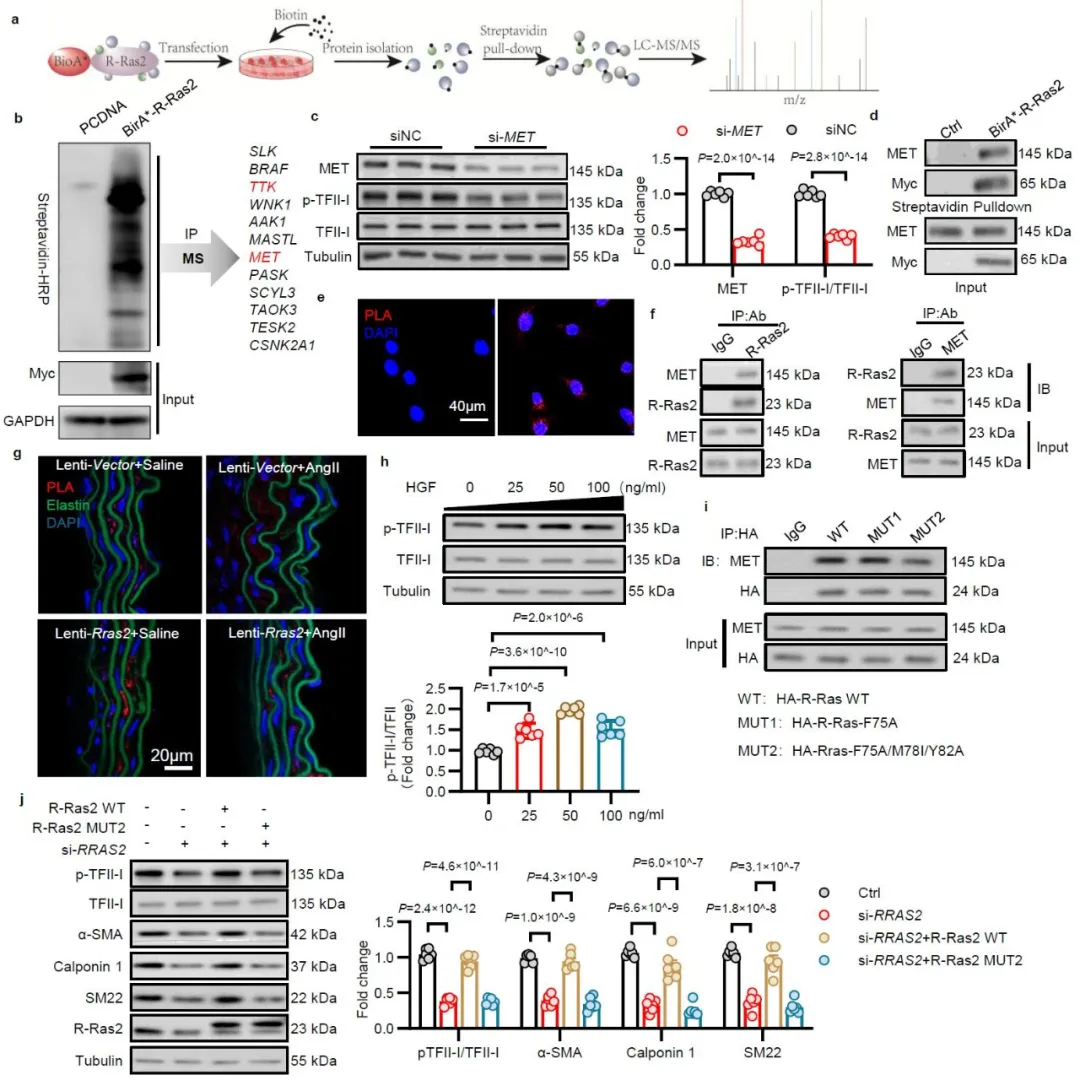
综上所述,本研究从临床样本、整体动物和细胞水平揭示了RRAS2在调控血管平滑肌细胞表型转化及腹主动脉瘤中的关键作用及其分子机制。研究发现RRAS2介导转录因子TFII-I的磷酸化及核转位,激活平滑肌收缩相关基因的转录表达; LncRNA MEG3通过抑制RRAS2的降解来维持血管平滑肌细胞稳态,进而延缓腹主动脉瘤的进展。该研究不仅揭示了RRAS2通过调节血管平滑肌细胞的稳态在腹主动脉瘤中的核心作用,也为临床治疗提供了具有转化潜力的干预靶点。
除血管平滑肌细胞外,季勇教授团队近年来系列研究工作还全面解析了血管内皮细胞及巨噬细胞在主动脉夹层及主动脉瘤中的作用和分子机理。发现PLS3巯基亚硝基修饰能够促进血管内皮细胞炎症反应,并诱导内皮屏障功能的破坏,促进主动脉夹层的发生(Arterioscler Thromb Vasc Biol. 2020;40(1):175-188.)。首次揭示了气体信号分子H2S与主动脉夹层的相关性,发现了H2S可通过介导PDI巯基硫化修饰,抑制内质网应激并改善内皮功能,并提出了基于蛋白巯基硫化修饰的新干预策略(Circulation. 2023;147(18):1382-1403.)。此外,发现巨噬细胞中GTP结合蛋白家族成员Septin2的活化通过激活TIAM1/RAC1/NF-kB信号轴,促进炎症因子释放和细胞外基质降解,加重主动脉夹层病变,并基于此提出了提出酮咯酸老药新用策略(Circulation. 2024;149(24):1903-1920.)。
哈尔滨医科大学寒地心血管病全国重点实验室和南京医科大学心脑血管重大疾病新靶标与转化研究重点实验室季勇教授、南京医科大学谢利平教授、哈尔滨医科大学附属第二医院韩艺教授为该论文的共同通讯作者。南京医科大学罗姗姗教授、陈际宇博士、钟可博士为该论文共同第一作者。该工作得到了中国科学院重庆绿色智能技术研究院李礼教授,南京医科大学顾爱华教授、陈峰教授, 南京大学医学院附属鼓楼医院王东进教授、汤鑫龙教授,上海交通大学医学院仁济医院卜军教授,哈尔滨医科大学于波教授、张志仁教授及田进伟教授大力支持。
参考文献:
[1] Chou, E., Pirruccello, J. P., Ellinor, P. T. & Lindsay, M. E. Genetics and mechanisms of thoracic aortic disease. Nat. Rev. Cardiol. 20, 168–180 (2023).
[2] Shen, Y. H. et al. Aortic Aneurysms and Dissections Series Part II: Dynamic Signaling Responses in Aortic Aneurysms and Dissections. Arterioscler. Thromb. Vasc. Biol. 40, e78–e86 (2020).
[3] Davis, M. J., Earley, S., Li, Y.-S. & Chien, S. Vascular mechanotransduction. Physiol. Rev. 103, 1247–1421 (2023).
原文链接:
https://www.nature.com/articles/s41467-025-64496-7
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)