首页 > 医疗资讯/ 正文
洋葱伯克霍尔德菌复合群(Bcc) 的发现可追溯至 1949年,康奈尔大学的 Burkholder 教授从腐烂的洋葱鳞茎中首次分离出该菌,并命名为 洋葱假单胞菌(Pseudomonas cepacia)[1]。早期研究认为其仅是一种植物病原菌,但后续发现该菌广泛分布于自然环境及医院环境中,具有潜在致病性。
随着分子生物学技术的发展,假单胞菌属(Pseudomonas)的分类经历了一系列调整。1992年,Yabuuchi 等[2-3]基于 16S rRNA 序列分析、DNA-DNA 同源性及细胞脂质组成等研究,提出将部分菌种重新归类为伯克霍尔德菌属(Burkholderia),其中包括洋葱伯克霍尔德菌(Burkholderia cepacia)、鼻疽伯克霍尔德菌(B.mallei)及类鼻疽伯克霍尔德菌(B.pseudomallei)等7个菌种。
此后,随着新菌种的不断发现,进一步将22个亲缘关系相近的菌种归类为 Bcc,而根据美国国家生物技术信息中心Taxonomy数据库最新数据,该复合群已扩展至28个明确菌种[4]。
近年来,由于广谱抗菌药物和免疫抑制剂的广泛使用、侵入性医疗操作增加以及医院消毒措施不规范等因素,Bcc 引起的医院感染比例显著上升,已成为临床上面临的重要条件致病菌。本文围绕Bcc的流行病学特征、临床表现、耐药现状及其分子机制进行系统阐述,旨在加深临床医生对该病原菌的认识,并为临床诊断与治疗提供参考。
1 流行病学特征
Bcc广泛分布于水、土壤和潮湿环境中[5],常通过飞沫吸入或接触受污染的医疗器械、药物、环境表面等途径传播[6-9]。Marolda等[10]研究发现,变形虫可能为Bcc的天然宿主,其通过定植于人体鼻黏膜并释放含有Bcc的小囊泡(直径约2~5 μm)进入下呼吸道引发感染。Bcc包含多个表型相似但基因型不同的菌种,如洋葱伯克霍尔德菌(B.cepacia,模式种)、多噬伯克霍尔德菌(B.multivorans)以及新洋葱伯克霍尔德菌(B.cenocepacia)等[11]。其中,新洋葱伯克霍尔德菌的致病性最强,其致死率可达其他基因型的 5 倍以上[12-13]。研究表明,该菌的Ⅵ型分泌系统(T6SS)在其毒力表达中发挥关键作用[14-15]。由于Bcc的分类方法多样且命名规则不统一,Baldwin等[16]于2005年提出了多位点序列分型(MLST)方案,对已有的基因型分类方法进行了统一。目前的研究显示,不同克隆型菌株的分布具有区域性特征,但部分高致病性克隆(如 ST28/ET12)已呈现跨国甚至全球传播趋势[17]。表1汇总了部分Bcc常见流行菌株及其主要分布区域。
表1 伯克霍尔德菌复合体常见菌种及流行病学特征
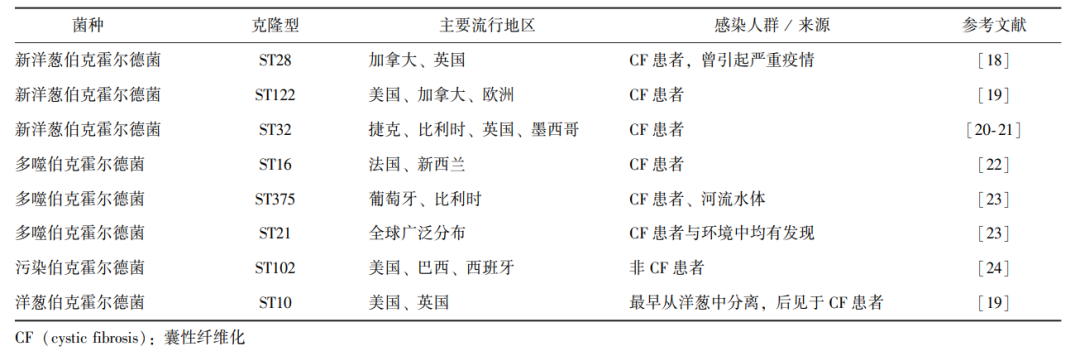
尽管这些流行菌株尚未表现出独特的生物学特性,但研究者已鉴定出三种特征性遗传标记:编码巨型索状菌毛的cblA基因、由两个插入序列(IS1356和IS402)组成的混合体,以及1.4 kb的开放阅读框BCESM(B.cepacia epidemic strain marker)。Clode团队[25]对英国40家医院的117株Bcc分离株进行特异性PCR检测,发现所有流行菌株均同时携带cblA基因和BCESM标记,这一重要发现提示,对囊性纤维化(CF)患者的Bcc分离株进行PCR筛查,可能为早期识别流行菌株、实施隔离措施以及阻断院内传播提供有效的分子诊断策略。
2 感染相关临床表现
2.1 易感人群
Bcc是一类具有高度致病性的革兰阴性菌,可引发多种感染,在CF患者的痰液标本中检出率较高。CF作为白种人最常见的常染色体隐性遗传病,其发病率约为1/(2500~3500),主要致病机制为囊性纤维化跨膜电导调节因子(CFTR)基因突变[26]。该基因缺陷导致氯离子通道功能异常,引发气道黏液黏稠度显著增高,进而造成腺体分泌物潴留和纤毛清除功能障碍,最终形成有利于病原体粘附与定植的微环境。值得注意的是,Bcc菌株具有强大的生物膜形成能力,可通过构建药物渗透屏障和免疫逃逸机制,显著增强其在CF患者气道中的持续感染能力。
近年研究发现,Bcc在非CF人群中亦逐渐成为重要的机会致病菌,尤其在伴有基础疾病、免疫功能受损或ICU住院患者中更易引发严重感染[27]。我国一项针对儿童患者的临床调查研究显示,在50例非CF相关的Bcc感染患者中,68%合并基础疾病,其中以心血管疾病占比最高(23.5%),其次分别为呼吸系统疾病(17.6%)、神经系统疾病(14.7%)和恶性肿瘤(14.7%)[28]。国外一项回顾性研究报道,64例非CF相关的Bcc感染患者中34.4%合并糖尿病,其他常见合并症包括慢性肾脏病、冠心病和高血压[29]。值得关注的是,该研究中93.8%的患者曾有ICU住院史,提示ICU环境可能是Bcc感染的重要危险因素。
2.2 常见感染类型
2.2.1 呼吸系统感染
Bcc感染最常见于CF患者,主要表现为慢性气道感染。典型临床症状包括持续性咳嗽、咳痰、呼吸急促等,由于病原菌长期定植,患者肺功能往往呈进行性下降。部分患者可进展至急性加重期,表现为喘息、咳血、体重减轻及低氧血症。研究表明,新洋葱伯克霍尔德菌感染与不良预后显著相关,尤其是合并Cepacia综合征的患者,该综合征以高热、菌血症及快速进展的呼吸衰竭为主要特征,临床病死率较高[30-32]。在免疫抑制患者中,Bcc是医院获得性肺炎的重要病原体,且常呈现多重耐药性,导致临床治疗面临严峻挑战[33-34]。此外,Bcc的生物膜形成能力是其致病关键因素之一,生物膜不仅增强细菌对宿主防御机制和抗菌药物的抵抗能力,还促进其在肺组织中的长期定植,从而导致慢性感染。
2.2.2 血流感染
血流感染是Bcc感染最严重的并发症之一,常发生于免疫功能低下、长期住院或接受侵入性医疗操作的患者。其典型临床表现包括持续高热、寒战、低血压及呼吸急促,重症患者可进展为脓毒性休克或急性呼吸窘迫综合征(ARDS),甚至并发弥散性血管内凝血(DIC)及多器官功能衰竭。美国一项为期17年的全国性研究显示,Bcc血流感染的主要感染源为中心静脉导管相关感染(41%)和肺炎(20%)[35]。流行病学分析表明,62%的患者为医院获得性感染,28%为医疗相关感染,其病死率呈现时间依赖性特征:14 d、30 d和90 d累积死亡率分别达16%、25%和36%。
Bcc在血流感染中表现出的高致病性与其独特的病原学特征密切相关,首先,Bcc强大的生物膜形成能力显著增强了细菌在血液环境中的生存能力;其次,血培养分离株通常呈现多重耐药表型[36],极大限制了临床治疗选择。近年研究还发现,Bcc的Ⅵ型分泌系统(T6SS)通过促进细菌持续感染,进一步增强了其耐药性和毒力[14],为理解该菌的致病机制提供了新视角。
2.2.3 泌尿系统感染
尽管Bcc并非泌尿生殖道感染的常见病原体,但Zeeshan等[37]的研究指出,该菌可通过泌尿外科手术操作或导尿过程(尤其是长期留置导尿)侵入泌尿系统,在免疫功能低下或肾移植等特殊人群中可能引起慢性或复发性感染。值得注意的是,导尿管相关尿路感染(CAUTI)患者往往缺乏典型的临床症状,这使得临床诊断难度增加。
Bcc在泌尿系统感染中的致病性与其独特的生物学特性密切相关,该复合群能够通过形成导尿管表面生物膜实现长期定植,这种特殊的生存方式不仅可帮助病原体逃避免疫清除且使其持久存活能力增强,显著提高了对多种抗菌药物的耐受性,导致Bcc相关泌尿系统感染的治疗面临严峻挑战[38-39]。
2.2.4 其他感染
Bcc感染亦可累及皮肤软组织,导致蜂窝织炎、皮下脓肿形成,甚至进展为坏死性筋膜炎,表现为剧烈疼痛、皮肤坏死及系统性炎症反应综合征(SIRS)。此外,该复合群还可引起一种特殊类型的皮肤病变——“腐蹄病”,表现为足部浸渍和过度角化。Lancet 曾报道1例与Bcc相关的足部感染,发现在数百名沼泽地训练的美军士兵趾蹼中分离出Bcc,流行病学调查证实污染水源为其感染来源[40]。尽管Bcc引起的中枢神经系统感染较为罕见,但在神经外科术后或颅脑创伤患者中仍可能发生脑膜炎或脑脓肿,临床表现包括持续性高热、剧烈头痛伴颈项强直、进行性意识障碍、癫痫发作等神经症状。2024年,Kimura等[41]首次报道了1例COVID-19康复期患者继发Bcc脉络丛炎的病例,该患者在经历长期抗菌药物治疗后最终痊愈,这一发现拓展了对Bcc神经侵袭性的认识。
3 耐药现状及相关耐药机制
3.1 耐药现状
Bcc对多种抗菌药物具有天然耐药性和获得性耐药性,其耐药机制复杂多样,主要包括细胞外膜低通透性、RND(Resistance-Nodulation-Division)家族主导的多药外排泵系统、生物膜形成、酶介导的抗菌药物失活以及耐药基因的水平转移等。这些机制往往协同作用,导致Bcc对常用抗菌药物(如β-内酰胺类、喹诺酮类、氨基糖苷类等)表现出高度耐药,严重限制了临床治疗选择。由于Bcc的固有耐药性及药敏试验与临床疗效的不一致性,其经验性治疗极具挑战性[42]。
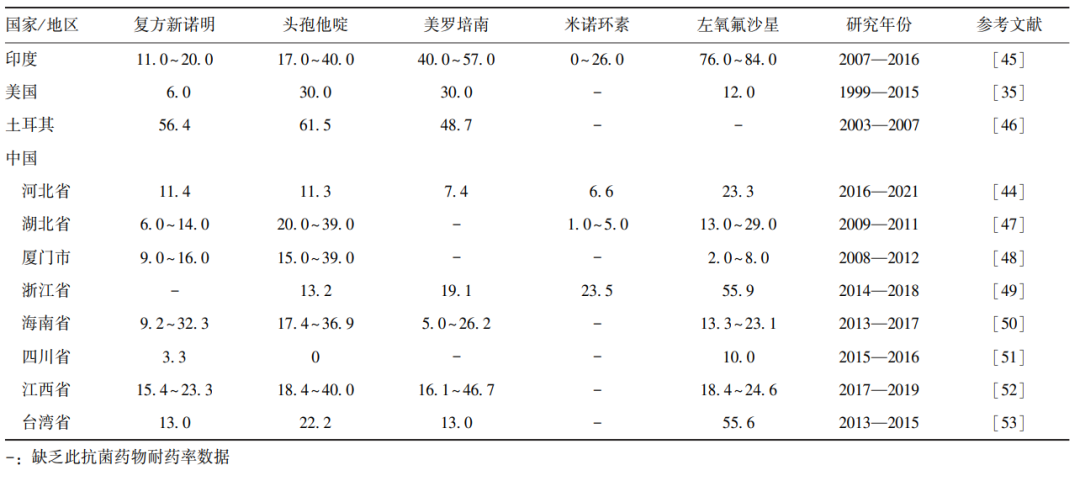
目前,头孢他啶等广谱头孢菌素仍是主要治疗药物,但耐药率逐年上升。一项针对CF患者的大规模临床分离株(n>1000)研究显示,超过50%的菌株对氯霉素、复方新诺明、环丙沙星、哌拉西林、利福平、亚胺培南及复方替卡西林-克拉维酸等药物表现出高度耐药[43]。然而,Bcc的耐药谱存在显著地域差异,如河北省近6年来左氧氟沙星、头孢他啶和复方新诺明的耐药率呈下降趋势,而美罗培南、氯霉素和米诺环素的耐药率保持稳定,湖北省及其他地区的耐药率则存在较大波动,这可能与当地抗菌药物管理政策、耐药监测体系及感染控制措施存在差异有关[44]。
鉴于Bcc耐药性的高度异质性,临床治疗应结合地区耐药监测数据,合理选择抗菌药物,同时加强感染控制措施,以减少耐药菌株的传播并优化患者的治疗预后。未来需建立全球统一的耐药监测网络,以更准确地评估Bcc的耐药流行病学特征,并指导临床合理用药。表2为部分国家和中国部分地区的Bcc耐药分布情况。
表2 洋葱伯克霍尔德菌复合群在部分国家/地区的耐药率分布(%)
3.2 耐药机制
革兰阴性菌通过多种机制介导耐药性,主要包括:β-内酰胺酶的产生、药物靶点修饰、外排泵系统过度表达,以及外膜蛋白缺失或结构改变,这些机制常协同作用,尤其在介导碳青霉烯类抗菌药物耐药方面表现突出,极大增加了临床治疗的复杂性[54-55]。Bcc的耐药机制在一定程度上与该机制相似,但也具有其独特的耐药特征。
首先,外膜通透性屏障是Bcc耐药性的关键因素,主要包括脂多糖(LPS)结构修饰和外膜孔蛋白限制。其次,不同菌种普遍表达周质及膜结合型β-内酰胺酶,参与介导对广谱β-内酰胺类抗菌药物的内在/获得性耐药。抗菌药物靶位突变则是氟喹诺酮类耐药的主要机制,同时也可能涉及对甲氧苄啶等药物的耐受形成。Bcc通过结构屏障(LPS/孔蛋白)-外排泵-酶系统的三重防御体系,建立了比普通革兰阴性菌更完善的耐药网络。理解这些特异性机制对开发新型抗菌策略至关重要。
3.2.1 外膜通透性屏障
Bcc对氨基糖苷类和多黏菌素具有天然耐药性,这得益于其特殊的LPS结构[56-57]。Bcc能够合成4-氨基-4-脱氧-L-阿拉伯糖 (Ara4N),并将该修饰基团添加至LPS的脂质A组分中,这一修饰过程导致LPS表面电荷改变,显著降低阳离子抗菌药物(如氨基糖苷类、多黏菌素)的膜结合效率。Loutet等[57]研究发现,替代性σ因子RpoE调控应激反应基因,在37 ℃时介导新洋葱伯克霍尔德菌的多黏菌素耐药性,而在30 ℃时则无此现象。这一发现揭示了Bcc耐药性的环境适应性调控机制。
除LPS修饰外,孔蛋白对于Bcc菌株耐药性的产生也起到重要作用。亲水性的抗菌药物必须依赖跨膜通道(孔蛋白)才能穿透细菌外膜,因此包括Bcc在内的部分细菌通过限制孔蛋白的渗透性实现耐药。Nicas等[58]基于Zimmermann等的研究方法对洋葱伯克霍尔德菌PC715J的外膜渗透性进行了评估[59],结果显示,该菌外膜渗透系数仅为大肠埃希菌的十分之一,而与铜绿假单胞菌相当,证实其存在显著的亲水性药物渗透屏障。Aronoff[60]通过电泳分析确定了耐药突变体表现为36 kDa外膜蛋白表达下调和 27 kDa孔蛋白缺失,明确了其与耐药性的直接关联。
3.2.2 β-内酰胺酶
Trepanier等[61]于1997年在洋葱伯克霍尔德菌中首次发现了编码A类β-内酰胺酶的基因penB(在Bcc中极其保守)。该基因与产酸克雷伯菌的染色体β-内酰胺酶基因高度相似,同时在其上游发现了开放阅读框penR(AmpR),二者构成的penB-penR系统共同调节细菌内β-内酰胺酶基因的表达。2015年,Hwang等[62]研究发现,细胞壁循环酶 AmpD对penB-penR系统具有调节作用,阐明了该调节机制。在细菌生长过程中细胞壁被不断破坏和再生成,其中多数肽聚糖降解产物被回收[63]。
AmpR是一种双向调节因子,可平衡细胞壁的生成与破坏,正常情况下其与肽聚糖前体结合,抑制β-内酰胺酶基因的表达,但当细胞壁因外来抗菌药物被大量破坏,肽聚糖降解产物(如1,6-脱水MurNAc-肽)即与LysR 型转录调节因子 AmpR结合,使其发挥激活剂作用,促进penB和AmpC(可水解广谱头孢菌素)的表达。而AmpD作为细胞壁回收系统中的重要酶,其相关基因突变同样干扰正常的肽聚糖回收,从而影响AmpR 的活性,导致相关β-内酰胺酶基因的高水平表达。
3.2.3 外排泵
Tseng等[64]通过对临床分离株进行分析发现,94.4% (17/18)的头孢他啶耐药分离株和 72.7%(16/22) 的氯霉素耐药分离株表现出外排泵高表达,提示外排泵过度表达在Bcc的多药耐药机制中发挥关键作用。
Biot等[65]通过特异性抑制剂实验证实,当加入RND外排泵抑制剂(PAβN)后,Bcc对氯霉素、喹诺酮类和氯唑西林的敏感性部分恢复;而ABC 转运蛋白抑制剂(维拉帕米)则未显示类似效果,这一结果证实RND外排泵是Bcc中的主要耐药相关外排系统。该泵通过质子动力势驱动的H+逆向转运机制实现底物外排。分子机制研究揭示,新洋葱伯克霍尔德菌至少编码6种与耐药相关的RND外排泵(RND-1、RND-3、RND-4、RND-8、RND-9和RND-10),其中RND-3 和 RND-4的表达上调与临床耐药表型密切相关[64,66-67]。
Tseng等[64]提出,RND-3 调节编码基因的突变可能是临床分离株中该泵普遍高表达及其伴随的高水平耐药的原因。Buroni团队通过基因敲除实验进一步阐明,RND-3外排泵特异性介导对环丙沙星和妥布霉素的耐药性,而RND-4则负责环丙沙星、妥布霉素、米诺环素和氯霉素的外排[67]。这些发现为理解Bcc的多药耐药机制提供了重要的分子基础。
3.2.4 药物靶点改变
在Bcc中,药物作用靶点改变是喹诺酮类和磺胺类药物耐药的主要机制之一。喹诺酮类抗菌药物通过抑制细菌的DNA旋转酶(DNA gyrase)和拓扑异构酶Ⅳ(topoisomerase Ⅳ),干扰DNA复制与修复,从而发挥抗菌作用。然而,细菌可通过逐步积累拓扑异构酶基因喹诺酮耐药决定区 (QRDR) 的突变,降低药物与靶点的结合能力,最终形成耐药性[68-69]。
2007年,Pope等[70]利用洋葱伯克霍尔德菌10661及其衍生突变体进行环丙沙星诱导耐药实验,发现随着环丙沙星浓度的增加,菌株在gyrA基因(编码DNA旋转酶A亚基)上逐渐出现Thr83Ile和Asp87Asn突变。这些突变可能导致临床治疗过程中耐药菌株的筛选,从而降低药物疗效,若持续提高环丙沙星浓度,部分菌株还会在parC(编码拓扑异构酶IV亚基)上发生额外突变,最终导致更高水平的喹诺酮耐药。这一发现提示,Bcc可能通过逐步累积gyrA和parC突变来增强耐药性,从而对临床治疗构成挑战。
3.2.5 生物膜
在Bcc所致的慢性感染中,生物膜的形成是一个关键特征[71-73]。生物膜是由细菌、胞外多糖、蛋白质和细胞碎片构成的复杂层状结构。研究发现,与浮游状态相比,生物膜内的Bcc表现出较强的耐药性。这种耐药性不仅源于生物膜的物理屏障作用,还与其形成的低氧、低pH微环境、耐药基因的水平转移以及细菌代谢状态的适应性改变等多种机制密切相关。值得注意的是,生物膜中的细菌即使未发生遗传突变,仍可通过表型异质性产生耐药亚群。这些亚群在抗菌药物作用下进入生长停滞状态而非死亡,一旦药物浓度降低即可重新生长繁殖,导致感染复发[74]。
与环境中分离的菌株相比,临床分离株通常具有更强的生物膜形成能力,但其持久性存活的分子机制尚未完全阐明。现有研究表明,毒素-抗毒素系统 (TA) 可能在这一过程中发挥重要作用。Van Acker等[75]通过比较洋葱伯克霍尔德菌J2315在生物膜(固定)和浮游状态下的基因表达差异,证实生物膜状态下的毒素编码基因表达水平显著升高。更有意义的是,在妥布霉素或环丙沙星处理后,生物膜内细菌的TA系统表达进一步上调,提示TA系统可能参与介导了Bcc在生物膜状态下的药物耐受性。这些发现为理解Bcc慢性感染的难治性提供了新视角。
4 小结与展望
综上所述,Bcc作为一种具有多重耐药特性的重要条件致病菌,其临床危害性正日益受到全球关注。在临床实践中,早期识别和准确诊断Bcc感染,以及制定个体化治疗策略,将是减少其致病性和改善预后的关键,同时应加强全球范围内的耐药监测网络建设。随着分子生物学技术的发展以及对Bcc耐药机制的深入理解,为开发新型抗菌药物和治疗方法提供了潜在靶点。未来研究方向应着重于:
1 建立快速准确的分子诊断技术;
2 开发针对外排泵和生物膜的特异性抑制剂;
3 探索TA系统在持留菌形成中的作用;
4 通过多学科协作,有望为Bcc感染防治提供更有效的策略。
参考文献
[1]Burkholder W H. Sour skin, a bacterial rot of onion bulbs[J]. Phytopathology, 1950, 40(1): 115-117.
[2]Palleroni N J, Kunisawa R, Contopoulou R, et al. Nucleic acid homologies in the genus Pseudomonas[J]. Int J Syst Evol Microbiol, 1973, 23(4): 333-339.
[3]Yabuuchi E, Kosako Y, Oyaizu H, et al. Proposal of Burkholderia gen. nov. and transfer of seven species of the genus Pseudomonas homology group II to the new genus, with the type species Burkholderia cepacia (Palleroni and Holmes 1981) comb. nov.[J]. Microbiol Immunol, 1992, 36(12): 1251-1275.
[4]Coenye T, Vandamme P, Govan J R, et al. Taxonomy and identification of the Burkholderia cepacia complex[J]. J Clin Microbiol, 2001, 39(10): 3427-3436.
[5]Miller S C M, LiPuma J J, Parke J L. Culture-based and non-growth-dependent detection of the Burkholderia cepacia complex in soil environments[J]. Appl Environ Microbiol, 2002, 68(8): 3750-3758.
[6]Sommerstein R, Führer U, Lo Priore E, et al. Burkholderia stabilis outbreak associated with contaminated commercially-available washing gloves, Switzerland, May 2015 to August 2016[J]. Euro Surveill, 2017, 22(49): 17-00213.
[7]Tavares M, Kozak M, Balola A, et al. Burkholderia cepacia complex bacteria: a feared contamination risk in water-based pharmaceutical products[J]. Clin Microbiol Rev, 2020, 33(3): e00139-19.
[8]Al Zunitan M, Aldawood F, El-Saed A, et al. Two consecutive outbreaks caused by chlorhexidine mouthwash contaminated with Burkholderia contaminans in a two-hospital tertiary care system[J]. J Hosp Infect, 2023, 142: 96-104.
[9]Aytaç Ö, Tanriverdi E S, Gündağ Ö, et al. An intensive care outbreak caused by Burkholderia cepacia from bacterial filters[J]. Pathogens, 2025, 14(3): 266.
[10]Marolda C L, Hauröder B, John M A, et al. Intracellular survival and saprophytic growth of isolates from the Burkholderia cepacia complex in free-living amoebae[J]. Microbiology (Reading), 1999, 145(7): 1509-1517.
[11]Sfeir M M. Burkholderia cepacia complex infections: more complex than the bacterium name suggest[J]. J Infect, 2018, 77(3): 166-170.
[12]Miller R R, Hird T J, Tang P, et al. Whole-genome sequencing of three clonal clinical isolates of B. cenocepacia from a patient with cystic fibrosis[J]. PLoS One, 2015, 10(11): e0143472.
[13]Boussaud V, Guillemain R, Grenet D, et al. Clinical outcome following lung transplantation in patients with cystic fibrosis colonised with Burkholderia cepacia complex: results from two French centres[J]. Thorax, 2008, 63(8): 732-737.
[14]Spiewak H L, Shastri S, Zhang L, et al. Burkholderia cenocepacia utilizes a type Ⅵ secretion system for bacterial competition[J]. Microbiologyopen, 2019, 8(7): e00774.
[15]Loeven N A, Dabi C, Pennington J P, et al. A type Ⅵ secretion system in Burkholderia species cenocepacia and orbicola triggers distinct macrophage death pathways independent of the pyrin inflammasome[J]. Infect Immun, 2024, 92(12): e0031624.
[16]Baldwin A, Mahenthiralingam E, Thickett K M, et al. Multilocus sequence typing scheme that provides both species and strain differentiation for the Burkholderia cepacia complex[J]. J Clin Microbiol, 2005, 43(9): 4665-4673.
[17]Drevinek P, Mahenthiralingam E. Burkholderia cenocepacia in cystic fibrosis: epidemiology and molecular mechanisms of virulence[J]. Clin Microbiol Infect, 2010, 16(7): 821-830.
[18]Sun L, Jiang RZ, Steinbach S, et al. The emergence of a highly transmissible lineage of cbl+ Pseudomonas (Burkholderia) cepacia causing CF centre epidemics in North America and Britain[J]. Nat Med, 1995, 1(7): 661-666.
[19]Baldwin A, Mahenthiralingam E, Drevinek P, et al. Environmental Burkholderia cepacia complex isolates in human infections[J]. Emerg Infect Dis,2007, 13(3): 458-461.
[20]Drevinek P, Mahenthiralingam E. Burkholderia cenocepacia in cystic fibrosis: epidemiology and molecular mechanisms of virulence[J]. Clin Microbiol Infect,2010, 16(7): 821-830.
[21]Drevinek P, Baldwin A, Lindenburg L, et al. Oxidative stress of Burkholderia cenocepacia induces insertion sequence-mediated genomic rearrangements that interfere with macrorestriction-based genotyping[J]. J Clin Microbiol, 2010, 48(1): 34-40.
[22]Segonds C, Bingen E, Couetdic G, et al. Genotypic analysis of Burkholderia cepacia isolates from 13 French cystic fibrosis centers[J]. J Clin Microbiol, 1997, 35(8): 2055-2060.
[23]Baldwin A, Mahenthiralingam E, Drevinek P, et al. Elucidating global epidemiology of Burkholderia multivorans in cases of cystic fibrosis by multilocus sequence typing[J]. J Clin Microbiol,2008, 46(1): 290-295.
[24]Medina-Pascual MJ, Valdezate S, Carrasco G, et al. Increase in isolation of Burkholderia contaminans from Spanish patients with cystic fibrosis[J]. Clin Microbiol Infect, 2015, 21(2): 150-156.
[25]Clode F E, Kaufmann M E, Malnick H, et al. Distribution of genes encoding putative transmissibility factors among epidemic and nonepidemic strains of Burkholderia cepacia from cystic fibrosis patients in the United Kingdom[J]. J Clin Microbiol, 2000, 38(5): 1763-1766.
[26]Myer H, Chupita S, Jnah A. Cystic fibrosis: back to the basics[J]. Neonatal Netw, 2023, 42(1): 23-30.
[27]Datta P, Gupta M, Kumar M B, et al. Burkholderia cepacia complex causing pneumonia in an immunocompetent non-cystic fibrosis patient: case report and review of literature[J]. Infect Disord Drug Targets, 2020, 20(1): 106-110.
[28]Shi H X, Chen X R, Chen L L, et al. Burkholderia cepacia infection in children without cystic fibrosis: a clinical analysis of 50 cases[J]. Front Pediatr, 2023, 11: 1115877.
[29]Ibrahim T, Abdallah T A, Abdallah A, et al. Epidemiology, microbiological, clinical characteristics, and outcome of Burkholderia cepacia complex infections in non-cystic fibrosis adult patients from Qatar[J]. IJID Reg, 2024, 11: 100355.
[30]Jones A M, Dodd M E, Govan J R W, et al. Burkholderia cenocepacia and Burkholderia multivorans: influence on survival in cystic fibrosis[J]. Thorax, 2004, 59(11): 948-951.
[31]Daccò V, Alicandro G, Consales A, et al. Cepacia syndrome in cystic fibrosis: a systematic review of the literature and possible new perspectives in treatment[J]. Pediatr Pulmonol, 2023, 58(5): 1337-1343.
[32]Somayaji R, Yau Y C W, Tullis E, et al. Clinical outcomes associated with Burkholderia cepacia complex infection in patients with cystic fibrosis[J]. Ann Am Thorac Soc, 2020, 17(12): 1542-1548.
[33]Peng F, Zhong L L, Lin X J, et al. Burkholderia cepacia infection in children: a clinical analysis of 16 cases[J]. Chin J Contemp Pediatr, 2018, 20(2): 112-115.
[34]Gautam V, Shafiq N, Singh M, et al. Clinical and in vitro evidence for the antimicrobial therapy in Burkholderia cepacia complex infections[J]. Expert Rev Anti Infect Ther, 2015, 13(5): 629-663.
[35]El Chakhtoura N G, Saade E, Wilson B M, et al. A 17-year nationwide study of Burkholderia cepacia complex blood-stream infections among patients in the United States veterans health administration[J]. Clin Infect Dis, 2017, 65(8): 1253-1259.
[36]Siddiqui T, Sahu C, Patel S S, et al. Clinical and microbiological profile of patients with bloodstream infections caused by Burkholderia cepacia complex[J]. J Lab Physicians, 2022, 14(3): 312-316.
[37]Zeeshan M, Aziz T, Naqvi F. Recurrent urinary tract infection by Burkholderia cepacia in a live related renal transplant recipient[J]. J Pak Med Assoc, 2012, 62(5): 496-498.
[38]Nimri L, Sulaiman M, Hani O B. Community-acquired urinary tract infections caused by Burkholderia cepacia complex in patients with no underlying risk factor[J]. JMM Case Rep, 2017, 4(1): e005081.
[39]Ogundipe O A, Pearson R C, Campbell A, et al. Burkholderia cepacia complex infection complicating long-term urethral catheterisation[J]. BMJ Case Rep, 2019, 12(11): e230342.
[40]Taplin D, Bassett D C, Mertz P M. Foot lesions associated with Pseudomonas cepacia[J]. Lancet, 1971, 2(7724): 568-571.
[41]Kimura M, Fujiwara S, Kuroda H, et al. Choroid plexitis caused by Burkholderia cepacia complex after COVID-19[J]. Int J Infect Dis, 2024, 147: 107201.
[42]Moore J E, McCaughan J, Rendall J C, et al. Case report: the conundrum of what to pick? Antibiotic susceptibility variability in Burkholderia cenocepacia in cystic fibrosis: implications for antibiotic susceptibility testing and treatment[J]. Br J Biomed Sci, 2024, 81: 12749.
[43]Zhou J Y, Chen Y H, Tabibi S, et al. Antimicrobial susceptibility and synergy studies of Burkholderia cepacia complex isolated from patients with cystic fibrosis[J]. Antimicrob Agents Chemother, 2007, 51(3): 1085-1088.
[44]Liu Y C, Li J H, Wen H N, et al. Multicenter investigation of drug-resistance in Burkholderia cepacia bloodstream infections in Hebei Province, China, from 2016 to 2021[J]. Infect Drug Resist, 2024, 17: 1731-1739.
[45]Sethi S, Sharma M, Kumar S, et al. Antimicrobial susceptibility pattern of Burkholderia cepacia complex & Stenotrophomonas maltophilia from North India: trend over a decade (2007—2016)[J]. Indian J Med Res, 2020, 152(6): 656-661.
[46]Dizbay M, Tunccan O G, Sezer B E, et al. Nosocomial Burkholderia cepacia infections in a Turkish university hospital: a five-year surveillance[J]. J Infect Dev Ctries, 2009, 3(4): 273-277.
[47]陈晓玲. 4850例痰标本洋葱伯克霍尔德菌分布与耐药分析[J]. 国际检验医学杂志, 2012, 33(11): 1379-1380.
[48]杨色娟, 刘小六. 洋葱伯克霍尔德菌耐药性变迁[J]. 中国卫生产业, 2013, 10(17): 157.
[49]顾天英. 洋葱伯克霍尔德菌临床耐药分析[J]. 中国卫生检验杂志, 2019, 29(15): 1835-1836.
[50]陆春婉, 苏爱康, 王丹凤. 急诊ICU洋葱伯克霍尔德菌感染的分布与耐药分析[J]. 中华医院感染学杂志, 2019, 29(18): 2759-2762.
[51]解春宝, 罗江蓉, 罗天华, 等. 临床分离洋葱伯克霍尔德菌的耐药谱分析[J]. 中国医药指南, 2019, 17(27): 1.
[52]鲍桂乐. ICU洋葱伯克霍尔德菌感染趋势及耐药率分析[J]. 实验与检验医学, 2021, 39(2): 343-345.
[53]Chien Y C, Liao C H, Sheng W H, et al. Clinical characteristics of bacteraemia caused by Burkholderia cepacia complex species and antimicrobial susceptibility of the isolates in a medical centre in Taiwan[J]. Int J Antimicrob Agents, 2018, 51(3): 357-364.
[54]Arzanlou M, Chai W C, Venter H. Intrinsic, adaptive and acquired antimicrobial resistance in Gram-negative bacteria[J]. Essays Biochem, 2017, 61(1): 49-59.
[55]Breijyeh Z, Jubeh B, Karaman R. Resistance of Gram-negative bacteria to current antibacterial agents and approaches to resolve it[J]. Molecules, 2020, 25(6): 1340.
[56]Gunn J S, Lim K B, Krueger J, et al. PmrA-PmrB-regulated genes necessary for 4-aminoarabinose lipid A modification and polymyxin resistance[J]. Mol Microbiol, 1998, 27(6): 1171-1182.
[57]Loutet S A, Valvano M A. Extreme antimicrobial peptide and polymyxin B resistance in the genus burkholderia[J]. Front Microbiol, 2011, 2: 159.
[58]Nicas T I, Hancock R E. Pseudomonas aeruginosa outer membrane permeability: isolation of a porin protein F-deficient mutant[J]. J Bacteriol, 1983, 153(1): 281-285.
[59]Zimmermann W, Rosselet A. Function of the outer membrane of Escherichia coli as a permeability barrier to beta-lactam antibiotics[J]. Antimicrob Agents Chemother, 1977, 12(3): 368-372.
[60]Aronoff S C. Outer membrane permeability in Pseudomonas cepacia: diminished porin content in a beta-lactam-resistant mutant and in resistant cystic fibrosis isolates[J]. Antimicrob Agents Chemother, 1988, 32(11): 1636-1639.
[61]Trépanier S, Prince A, Huletsky A. Characterization of the penA and penR genes of Burkholderia cepacia 249 which encode the chromosomal class A penicillinase and its LysR-type transcriptional regulator[J]. Antimicrob Agents Chemother, 1997, 41(11): 2399-2405.
[62]Hwang J, Kim H S. Cell wall Recycling-linked coregulation of AmpC and PenB β-Lactamases through ampD mutations in Burkholderia cenocepacia[J]. Antimicrob Agents Chemother, 2015, 59(12): 7602-7610.
[63]Park J T. Identification of a dedicated recycling pathway for anhydro-N-acetylmuramic acid and N-acetylglucosamine derived from Escherichia coli cell wall murein[J]. J Bacteriol, 2001, 183(13): 3842-3847.
[64]Tseng S P, Tsai W C, Liang C Y, et al. The contribution of antibiotic resistance mechanisms in clinical Burkholderia cepacia complex isolates: an emphasis on efflux pump activity[J]. PLoS One, 2014, 9(8): e104986.
[65]Biot F V, Valade E, Garnotel E, et al. Involvement of the efflux pumps in chloramphenicol selected strains of Burkholderia thailandensis: proteomic and mechanistic evidence[J]. PLoS One, 2011, 6(2): e16892.
[66]Buroni S, Pasca M R, Flannagan R S, et al. Assessment of three resistance-nodulation-cell division drug efflux transpor-ters of Burkholderia cenocepacia in intrinsic antibiotic resistance[J]. BMC Microbiol, 2009, 9: 200.
[67]Bazzini S, Udine C, Sass A, et al. Deciphering the role of RND efflux transporters in Burkholderia cenocepacia[J]. PLoS One, 2011, 6(4): e18902.
[68]Gocke E. Mechanism of quinolone mutagenicity in bacteria[J]. Mutat Res, 1991, 248(1): 135-143.
[69]Chen F J, Lo H J. Molecular mechanisms of fluoroquinolone resistance[J]. J Microbiol Immunol Infect, 2003, 36(1): 1-9.
[70]Pope C F, Gillespie S H, Pratten J R, et al. Fluoroquinolone-resistant mutants of Burkholderia cepacia[J]. Antimicrob Agents Chemother, 2008, 52(3): 1201-1203.
[71]Suppiger A, Schmid N, Aguilar C, et al. Two quorum sensing systems control biofilm formation and virulence in members of the Burkholderia cepacia complex[J]. Virulence, 2013, 4(5): 400-409.
[72]Ibrahim M, Tang Q M, Shi Y, et al. Diversity of potential pathogenicity and biofilm formation among Burkholderia cepacia complex water, clinical, and agricultural isolates in China[J]. World J Microbiol Biotechnol, 2012, 28(5): 2113-2123.
[73]Van den Driessche F, Vanhoutte B, Brackman G, et al. Evaluation of combination therapy for Burkholderia cenocep-acia lung infection in different in vitro and in vivo models[J]. PLoS One, 2017, 12(3): e0172723.
[74]Van Acker H, Sass A, Bazzini S, et al. Biofilm-grown Burkholderia cepacia complex cells survive antibiotic treatment by avoiding production of reactive oxygen species[J]. PLoS One, 2013, 8(3): e58943.
[75]Van Acker H, Sass A, Dhondt I, et al. Involvement of toxin-antitoxin modules in Burkholderia cenocepacia biofilm persistence[J]. Pathog Dis, 2014, 71(3): 326-335.
猜你喜欢
- 7月1日零时起,上海市调整离沪来沪返沪人员管控措施
- 磁共振成像的优势及适应症
- BMC Med.:自闭症成年人全因死亡率升高 90%:中老年群体疾病轨迹与多重共病特征
- 施剑林院士团队最新JACS展望: 纳米药物重塑肿瘤微环境用于实体瘤免疫治疗
- 专访美国北达科他州立大学Md Najmo Hoque博士:从产量优先到健康导向,氮肥管理助力提升硬红春小麦营养与抗氧化能力 | NUTRITION 2025
- 餐厅收顾客一元“空气净化费”被物价局警示
- 肌肤抵抗力UP 初夏预防肌肤“公主病”
- 清炒芹菜的作法-家常味炒菜谱
- 素炒栀子花的做法-香辣味炒菜谱
- 我国学者研究发现,这种常见的食物,减轻脂肪肝,促进肠道健康
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)