首页 > 医疗资讯/ 正文
抗菌药物作在感染性疾病的治疗中发挥着举足轻重的作用。然而,由于抗菌药物的滥用和误用以及感染性疾病谱的变化,细菌耐药性问题日益严峻。世界卫生组织发布的报告预测, 2050年全球每年因滥用抗菌药物而造成的死亡人数将超过1000万[1]。英国权威医学期刊Lancet发表的研究显示,2019年约127万人死亡与抗菌药物耐药性有直接关系,495万人死亡与抗菌药物耐药性有间接关系;预测由2025年到2050年,由于细菌耐药性直接导致死亡人数将超过3900万,间接相关死亡人数可高达1.69亿[2]。
细菌耐药性是指细菌在接触抗菌药物后,通过一系列机制使得外界因素对其杀菌或抑菌作用减弱或失效的能力,而抗菌药物耐药性是指细菌对某一或某部分药物的敏感性降低的现象。细菌耐药性的发生机制包括产生灭活酶、抗菌药物作用靶位改变、改变细菌外膜通透性、细菌生物被膜形成及交叉耐药性等多个方面,传统的抗菌药物研发模式已难以满足当前临床需求,寻找新的抗菌策略和治疗手段迫在眉睫。
中药具有天然、低毒、多靶点等优势,其有效成分在抑菌及逆转抗菌药物耐药性方面展现出巨大潜力。近年来,国内外学者对中药及其有效成分与抗菌药物的联合应用进行了大量研究,发现二者联合使用不仅能增强抗菌药物的抗菌活性,还能有效抑制或逆转细菌耐药性,为临床抗感染治疗提供新的策略。本文深入总结中药抑菌机制与逆转抗菌药物耐药性的研究进展,以期为指导临床合理用药、开发新型抗菌药物提供更多思路。
1 中药抑菌机制
中药以其多样化、低毒、经济等多种优势,已成为治疗细菌感染类疾病的新突破口。研究显示,中药可通过破坏细菌细胞壁和细胞膜完整性、抑制细菌核酸和蛋白质合成、抑制细菌能量生成及代谢、调节机体的免疫功能、抑制体内酶活性、抑制群体感应等多种途径实现对细菌的抑制。
1.1 破坏细菌细胞壁和细胞膜完整性
中药活性成分与细菌接触后,可促使细菌分泌分解细胞壁和细胞膜的蛋白酶,改变其渗透压,致使电解质外渗,引发细胞萎缩、崩溃,最终导致细菌死亡,达到抑菌效果[3]。刘昊等[4]研究显示,黄芩苷的分子结构特征,特别是A环上的羟基,与其抗菌活性密切相关。这些官能团可通过增强与细菌细胞膜的相互作用,破坏大肠杆菌的细胞膜结构,增强其细胞膜渗透性,导致细胞内部物质渗漏,从而发挥抗菌作用。
芳樟醇是一种单萜醇类化合物,郭俸钰等[5]实验发现,该物质因其疏水性质可在细菌细胞膜上大量积聚,引起细胞膜表面皱缩并形成穿孔,导致细胞内小分子物质渗漏,进而妨碍细菌内部ATP产生体系的正常运行,扰乱质子动力,并抑制细菌细胞功能,且随着其作用时间延长和药物浓度增加,细菌细胞被破坏的程度不断加深。
潘旭迟等[6]通过电导率测试和扫描电子显微镜观察,发现柠檬花、茶叶和留兰香的挥发性油具有明显的抑菌效果,这与其分子结构中含有疏水性和亲水性基团有关。疏水性基团能促使油性分子插入细胞膜中,而亲水性基团则可与细胞膜上的极性头基团形成氢键或离子键,从而破坏细胞膜完整性,造成细菌内容物渗漏,最终抑制细菌生长和繁殖。综上所述,多种中药的有效成分可通过多种机制破坏细菌的细胞壁和细胞膜结构,增加细胞通透性,从而导致细胞内外物质交换异常和细菌死亡。
1.2 抑制细菌核酸和蛋白质合成
蛋白质与核酸是维持细菌生长与繁殖的必需物质,中药成分可通过改变细菌核酸的双螺旋结构、影响ATP合成等途径,有效抑制细菌生长和繁殖。娄在祥[7]在研究中揭示了香豆酸与绿原酸的抗菌作用与原理。香豆酸的苯环和羧酸基团使其可与DNA的疏水性和亲水性区域相互作用,而绿原酸的多羟基结构则通过形成氢键与DNA结合。这些相互作用导致细菌DNA双螺旋结构松弛,并影响DNA复制、转录和修复等生理活动,从而抑制细菌生长和繁殖。
胡椒中的单萜类化合物通常由1个或多个异戊二烯单元组成,具有不饱和的碳骨架和多种官能团。不饱和碳骨架可介导与细菌细胞膜的相互作用,而官能团则可影响化合物与细菌蛋白质的结合能力。李兆亭等[8]通过同位素标记相对和绝对定量技术监测了胡椒中的单萜类化合物与细菌接触后蛋白质表达变化,发现这些化合物可阻止单核增生李斯特菌合成关键的ATP依赖性蛋白,扰乱细菌的正常生理机能,最终引起细菌死亡,并且随着时间推移,受影响的蛋白质种类和数量均有所增加。综上所述,多种中药成分可通过影响细菌核酸和蛋白质合成,进而抑制其生长和繁殖,这些研究为中药在抗菌领域的应用提供了科学依据,也为开发新的抗菌策略提供了新思路。
1.3 抑制细菌能量生成及代谢
能量代谢是细菌生长繁殖的关键环节,中药中的多种成分可通过改变胞膜通透性、抑制细菌呼吸等途径干扰细菌的能量代谢途径,继而削弱细菌的生存能力。Yu等[9]研究发现,中药黄芩主要成分黄芩苷分子中的羟基可以非竞争性方式与幽门螺杆菌(Hp)脲酶活性位点附近的巯基相结合,导致该酶丧失催化能力,从而抑制细菌能量生成。张赟彬等[10]利用扫描电子显微镜观察发现,肉桂醛的苯环结构具有疏水性,可与细菌细胞膜的双层脂质发生相互作用,而醛基(-CHO)可增加肉桂醛的自由基亲和性,使该物质可与细菌细胞膜上的极性氨基酸残基形成氢键或发生共价键结合,从而导致细胞膜结构被破坏;且随着肉桂醛浓度增加,细菌悬液的电导率急剧上升,对细菌细胞膜通透性产生重要影响。同时,肉桂醛还可引起细菌膜电位下降,影响细菌的代谢活性,进而抑制细菌生长。这些发现表明肉桂醛可通过干扰细菌的能量代谢过程来发挥抗菌作用。
Song等[11]研究发现,牛至精油中的酚类化合物,尤其是香芹酚和百里香酚含有羟基(-OH)连接于苯环上,这使得其具有较高的反应性和抗氧化性,能与细菌细胞内的蛋白质和酶发生相互作用,抑制耐甲氧西林金黄色葡萄球菌(MRSA)的呼吸代谢过程,这与丙二酸、碘乙酸和十二水合磷酸三钠等代谢抑制剂的作用机制相似。进一步将丙二酸与牛至精油共同作用时,未观察到叠加的抑制效果,这意味着牛至精油和丙二酸可能作用于相同的代谢途径,即通过三羧酸循环抑制MRSA的呼吸功能,从而达到抗菌效果。综上所述,中药可通过多种机制抑制细菌的能量生成和代谢,进而达到抑制细菌生长和繁殖的效应。
1.4 中药的其他抑菌机制
免疫调节是指机体内部的免疫细胞和分子与其他系统相互协作,共同微调免疫反应,确保其保持在一个平衡且适宜的水平。该过程对于维持机体的健康状态至关重要。通过此种精细的调控机制,机体可有效应对各种内外环境的变化,保持免疫功能的稳定和有效。机体在面对外来细菌的侵袭时,其防御机制可能会受到影响,识别和排除外来抗原的能力减弱,进而影响整体的免疫防御功能,削弱对病原体的抵抗力,使感染更难被控制和清除。因此,维持和增强机体的免疫识别与清除能力对于有效抵抗感染至关重要。
中药因其多样的药理作用,如抗病毒感染和抑制肿瘤生长等,能够激发机体产生多种免疫反应,进而增强防御能力;同时,中药在抗击细菌时还能阻碍有害毒素的产生,为机体提供更加全面的保护,这些特性使得中药在调节免疫和抗菌领域具有独特优势[12]。杨轶涵等[13]研究发现,中成药化湿败毒颗粒可通过抑制脂多糖、氧自由基和干扰素-γ在内的多条信号通路,从而发挥抗炎、抗病毒和免疫调节作用。Ding等[14]研究表明,中成药连花清瘟胶囊可阻断病毒诱导的核因子-κB活化,并减少病毒诱导的白细胞介素-6、白细胞介素-8等细胞因子表达,有效发挥抗炎、抗病毒、提高免疫调节的作用。
群体感应是指在微生物生长过程中,随着种群密度增大,会出现一些单独个体或小群体所不具备的新特性,其能够调节生物质粒的传递、生物被膜的形成、毒素的合成、DNA的转录、胞外蛋白酶的分泌、色素的生物合成、次级代谢物的产生等[15]。
Tapia-Rodriguez[16]等研究发现,香芹酚结构中存在的羟基增加了分子极性,而苯环结构则增加了分子的稳定性和亲脂性,综合作用下使该物质易于穿透细胞膜,进而通过降低铜绿假单胞菌中LasI活性值、减少菌株生物被膜中与集群运动相关的基因表达、抑制LasR基因表达等途径,削弱酰基高丝氨酸内酯产生、抑制群体感应发生、阻碍毒力因子分泌,最终达到抑菌效果。
Sharifi等[17]以肺炎链球菌作为研究对象,发现百里香酚的苯环和羟基可对该菌与群体感应相关的pfs基因和LuxS基因表达水平进行抑制,从而破坏细菌生物被膜结构,最终导致细菌死亡。综上所述,中药的部分活性成分可通过抑制细菌的群体感应,来发挥其抗菌效果(表1),为临床进行抗菌治疗提供了更多思路。
表1 中药有效提取物的抑菌菌类及相关机制

2 中药逆转抗菌药物耐药性的机制
中药逆转抗菌药物耐药性的机制是一个复杂的过程,涉及消除细菌耐药质粒、抑制细菌酶的活性、抑制外排作用、改变细菌细胞膜通透性、破坏细菌生物被膜等多个方面。这些机制共同作用,使得中药在耐药菌感染的治疗中具有广阔的优势和潜力。
2.1 消除细菌耐药质粒
耐药质粒是细菌耐药性传播的重要途径,其携带耐药基因,并可通过水平基因转移在细菌间传播。中药成分可通过多种方式消除耐药质粒或抑制耐药基因表达,从而减轻细菌的耐药性。彭元丽等[20]认为,中药对抗细菌耐药质粒的策略可能包含多层次干预:
一是通过调节质粒与细胞膜的结合位点,干扰质粒精确复制过程;
二是促使与质粒DNA分配相关的蛋白质功能部分甚至全部丧失,进而造成质粒DNA复制中间体大量累积,但无法形成子代DNA;
三是实现质粒DNA双链的嵌入,从而影响其复制流程;四是与质粒DNA双链结合,抑制复制起始蛋白A(RepA)与DNA的结合活性,并抑制拓扑异构酶Ⅰ和Ⅱ的合成及其功能,减少质粒生成,同时诱发DNA复制抑制剂合成,阻断质粒DNA复制,从而逆转细菌耐药性。
此外,中药还可引发质粒DNA抗药性基因突变,从而阻止抗药性传播等。
多种中药成分对细菌耐药质粒具有消除作用。研究表明,黄芩苷能有效消除鲍曼不动杆菌(AB)的耐药质粒,恢复菌株对相关抗菌药物的敏感性[21]。汪东海等[22]在实验中以16株携带多重耐药质粒、对庆大霉素(GEN)和环丙沙星(CIP)高度耐药的AB为对象,在培养20 h加入黄芩苷后,通过碱裂解技术对菌株的质粒进行检测,结果显示耐药质粒携带率由100%降至37.5%,质粒介导的耐药决定簇水平转移被显著阻断,提示黄芩苷可通过质粒清除机制,实现对AB抗菌药物耐药性的逆转。
汪晶等[23]体外实验表明,五倍子具备消除携带超广谱β-内酰胺酶(ESBLs)大肠埃希菌耐药质粒的能力,且消除效果与五倍子的作用时长相关。李仲兴等[24]研究发现,乌梅水煎剂不仅能直接抑制大肠埃希菌生长,更关键的是当乌梅水煎剂干重浓度达1.44 g/L(1:160稀释液)时,可显著逆转该菌对头孢曲松的耐药性。
2.2 抑制细菌酶的活性
酶是生物体内的重要催化剂,对维系生命过程至关重要。中药对细菌酶活性有着强大的抑制作用,特别是针对β-内酰胺酶(β-LE)以及氨基糖苷类修饰酶(AMEs)。此两种酶是构成细菌耐药性的核心成员,具体而言,β-LE可水解β-内酰胺类抗菌药物( β-lactams),使之丧失抗菌效应;而AMEs则通过对氨基糖苷类药物进行化学修饰,削弱了其与细菌核糖体的结合亲和力,进而弱化了抗菌效果。中药通过干扰β-LE和AMEs功能,为抑制细菌耐药性的发展提供了有效解决途径。
多项研究揭示了中药成分对细菌的特定酶活性具有抑制效果。例如,将清开灵注射液与双黄连冻干粉共同配合头孢哌酮-舒巴坦钠使用时,对耐药肺炎克雷伯菌( KP)的抗菌效果显著提升,最小抑菌浓度值从单用头孢哌酮-舒巴坦钠时的128 mg/L逆转至8 mg/L,降幅达93.76%。这一发现提示,中药可能通过靶向抑制KP的ESBLs活性,阻断其β-LE水解功能,直接逆转KP对第三代头孢药物的耐药性,为减缓细菌耐药性的产生提供了一种新策略[25]。汪东海等[22]研究发现,黄芩苷在64 mg/L浓度下可使表达氨基糖苷6′-N-乙酰转移酶Ⅰb型的多重耐药AB对阿米卡星的最低抑菌浓度由256 mg/L降至8 mg/L,恢复倍数达32倍。这一实证表明,中药成分可直接抑制AMEs的催化活性,阻断氨基糖苷类抗菌药物的失活修饰,逆转细菌对该类药物的耐药性。
2.3 抑制细菌主动外排泵活性
外排泵是细菌耐药性的主要机制之一,其可将进入细菌细胞内的抗菌药物排出,降低药物浓度,并刺激细菌对抗菌药物产生耐药性。外排泵类型涵盖多药及毒性化合物排出家族(MATE)、主要易化子超家族(MFS)、RND(resistance-nodulation-division)家族、小多重耐药蛋白家族(SMR)、ATP结合盒超家族( ABC)等[26],并通过多种机制实现将抗菌药物向细胞膜外转运:如ABC型外排泵利用ATP水解产生的能量将药物从细胞膜内排出(图1),而其余几类外排泵则主要依赖质子动力供给能量,进而达到药物外排。
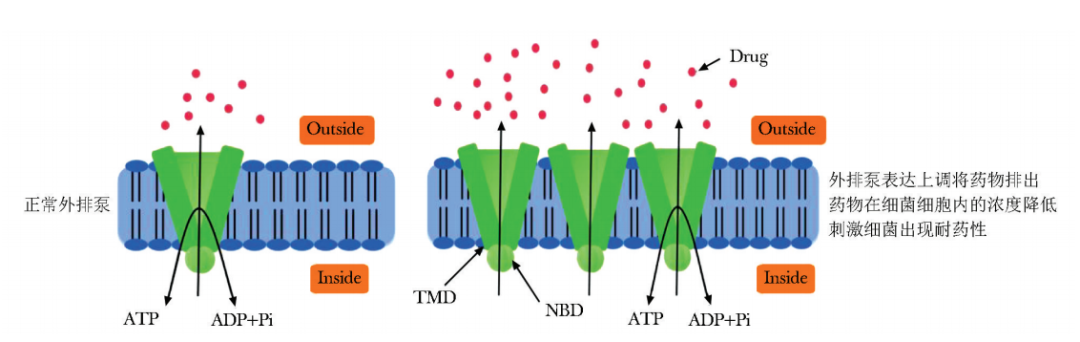
图1 ATP结合盒超家族外排泵作用机制示意图
ATP:同表1
抑制外排泵活性是减轻细菌对抗菌药物耐药的重要机制。鲍曼不动杆菌多重药物外排转运蛋白(AdeB)是属于RND家族的一种核心膜转运蛋白,负责将抗菌药物等底物从菌体内主动排出。研究揭示,清开灵注射液可抑制AB中的AdeB主动外排泵功能,显著降低其外排效率,有效降低该菌对环丙沙星的耐药水平[27]。蟾酥可抑制aac(6’)-6和aac(6’)-Ⅰ等氨基糖苷修饰酶基因表达,从而抑制外排泵活性,减少抗菌药物外排,通过提高细胞内药物浓度逆转细菌耐药[28]。同理,与环丙沙星联合应用从浙贝母中提取的贝母素后,已耐药的金黄色葡萄球菌的敏感性出现显著提升,推测贝母素可通过抑制耐药菌外排泵活性,减少抗菌药物排出,增加细菌细胞内的药物浓度,从而增强抗菌药物的抗菌效果,实现逆转细菌耐药[29]。
2.4 改变细菌细胞膜通透性
改变细菌细胞膜通透性是中药逆转抗菌药物耐药性的重要途径之一。研究揭示,双黄连可通过调节细胞膜的微环境并破坏细胞膜完整性,进而削弱细菌膜的保护作用,提高抗菌药物在细菌内的浓度,以实现对耐药性的抑制和有效逆转[30]。Zheng等[31]指出,多种中药提取物中的活性成分可降低细胞膜流动性,削弱其屏障功能,证实中药活性成分通过破坏脂质筏结构,从而逆转而非简单抑制耐药菌的抗菌药物耐药性。钱卫东等[32]研究发现,丁香酚可改变多重耐药大肠杆菌细胞膜通透性,进而逆转抗菌药物耐药效应,减少抗菌药物使用量。官妍等[33]研究显示,鱼腥草素钠无论是单独使用还是与抗菌药物联合应用,均可显著提升对表皮葡萄球菌生物被膜的渗透能力,使耐药菌株亚群对抗菌药物的物理屏障失效,进而提升抗菌效能,逆转耐药性。
3 中药协同抗菌药物逆转耐药性
3.1 中药单体协同抗菌药物逆转耐药性
3.1.1 黄酮类
黄酮类中药单体广泛存在于多种中草药,其包括黄酮、黄酮醇、二氢黄酮、二氢黄酮醇、异黄酮等多种类型。黄芩素是黄酮类单体的有效成分[34],而多西环素是广谱四环素类抗菌药物,用于治疗多种感染。Wang等[35]研究显示,黄芩素可通过附着于革兰氏阴性细菌细胞质膜的磷脂和外膜的脂多糖上而引起细菌膜破裂,从而促进多西环素进入细菌细胞内,辅助提高其抑菌疗效。同时,通过与多西环素相协同,可增强活性氧(ROS)的产生并抑制细菌外排泵和生物被膜形成,提高药物在菌体内的浓度,进一步逆转抗菌药物耐药性。该结果说明,黄芩素可增强多西环素对多重耐药革兰氏阴性病原体的杀伤力,而多西环素亦可增强黄芩素的抑菌能力,二者相组合可发挥更显著的抗菌效能,甚至逆转抗菌药物耐药性。
扁柏双黄酮(HF)是一种从侧柏叶中提取的黄酮类中药单体[36],被证明对MRSA具有杀伤作用。MRSA感染是目前临床治疗金黄色葡萄球菌相关疾病时重点关注的问题,而酪蛋白溶解蛋白酶 P(ClpP)是调节MRSA毒力蛋白的关键因素,当其功能被抑制时,可减弱细菌致病性并促进宿主进行免疫清除,故ClpP是对抗MRSA的理想靶点[37]。Kong等[38]通过实验证实,HF可通过抑制多种毒力因子表达来降低MRSA的毒力,其机制与HF可直接与ClpP相结合,从而抑制其活性,减轻MRSA致病性相关。同时,该研究进一步证实HF与万古霉素联合可更加有效保护小鼠免受 MRSA 诱导的致命性肺炎的侵害,认为HF作为 ClpP 的抑制剂,有望作为一种有前景的抗MRSA感染辅助治疗手段。
3.1.2 生物碱类
生物碱类中药单体是存在于生物体中一类含氮的碱性有机化合物,大多数具有复杂的环状结构且氮素多包含在环内。汉防己甲素(TET)是一种天然生物碱,可从中药防己中提取。多黏菌素( COL)曾被认为是治疗碳青霉烯类耐药细菌感染的首选药物[39],随着2015年COL耐药基因[多黏菌素耐药蛋白-1(MCR-1)]被检出,其临床应用受到严峻挑战。Shafiq等[40]研究发现,虽然COL本身不能抑制MCR-1 基因阳性大肠杆菌的生长,但与TET联合使用后,其活性显著增强,可在体内和体外达到抑制携带MCR-1基因大肠杆菌生长的目标。该研究对相关机制进行了分析:TET可与活性位点 MCR-1蛋白的三个关键氨基酸相互作用,抑制 MCR-1与其底物的结合,从而导致 MCR-1丧失促进细菌耐药性的能力,证实TET和COL具有协同克服携带MCR-1基因的大肠杆菌COL耐药问题的能力。
盐酸小檗碱(BBH)是中药黄连、黄柏的重要成分,Li等[41]通过体外实验发现,虽然单独使用BBH对多重耐药鲍曼不动杆菌(MDRAB)的抗菌活性较弱,但与抗菌药物联合使用时对MDRAB具有体外协同作用,其可显著增加MDRAB对部分抑菌浓度指数(FICI)<0.5抗菌药物的敏感性,逆转菌株对替加环素、环丙沙星等抗菌药物的耐药性。动物模型显示,在中性粒细胞减少性后肢感染小鼠模型中,舒巴坦联合BBH表现出较舒巴坦单药更强的抗菌效果[41]。上述研究表明,BBH具有逆转抗菌药物耐药性的作用,有望作为抗MDRAB感染的辅助药物。
3.1.3 酚类
酚类物质是一类含有羟基的有机化合物,广泛存在于植物中,中药材中的酚类物质主要包括单酚、双酚、多酚等。白藜芦醇、和厚朴酚是2种常见的酚类物质,可分别从中药虎杖和厚朴中有效提取。当前,对COL耐药的铜绿假单胞菌引起的感染是公共卫生领域面临的重要挑战[42]。Wang等[43]通过实验证实,COL协同白藜芦醇可有效增加耐药铜绿假单胞菌的细胞膜通透性,诱导菌株细胞裂解,逆转细菌耐药性。Guo等[44]通过动物模型研究显示,和厚朴酚可有效抑制 MCR-1基因活性且对小鼠肺泡相关细胞几乎无细胞毒性,可显著提高铜绿假单胞菌感染小鼠的成活率,降低细菌负荷,减轻病理变化。同时,和厚朴酚与COL体外联合使用时,对 MCR-1阳性肠杆菌科细菌感染具有明显的协同作用,且此种联合疗法不会继续诱导新的细菌耐药性,是抗菌药物耐药性研究的新方向。
6-姜酚是常见药食两用药材生姜的主要成分,也是一种群体感应抑制剂[45]。Ham等[46]研究发现,与单一药物相比,6-姜酚与妥布霉素(TM)联合使用治疗铜绿假单胞菌感染时,可发挥更强的抗细菌生物被膜形成和群体感应相关毒力因子抑制作用,显著提升抑菌疗效。同时,该研究发现二者联合使用时,在低浓度下即可发挥抑菌作用且未对人肺上皮细胞产生任何细胞毒性作用,提示6-姜酚和TM联合可能是治疗铜绿假单胞菌感染的有效策略。
3.1.4 醌类
醌类化合物在中药中广泛存在,根据结构不同,主要可分为苯醌、萘醌、菲醌和蒽醌四大类。金丝桃素(Hyp)是常见的醌类物质,具有极强的抗病毒作用[47]。Wang等[48]在研究中调查了Hyp对β-lactams敏感性的影响及其活性机制,证明Hyp可显著降低苯唑西林、头孢唑啉等抗菌药物的FICI值并抑制菌株的生物被膜形成,从而有效实现抗菌药物耐药性逆转。
Tet(X3)/Tet(X4)是近年来发现的新型替加环素高水平耐药基因,其可介导细菌对替加环素及其他四环素类药物产生高水平耐药[49]。白花丹醌(Plu)提取自中药白花丹,其与四环素类药物联合使用时对携带Tet(X3)/Tet(X4)基因的细菌具有协同杀菌作用。
体外实验表明[50],Plu可与 Tet(X3)/Tet(X4)相关靶点直接结合并诱导其二级结构发生交替,从而抑制该蛋白表达、发挥抗菌作用;而且与单纯使用替加环素处理相比,Plu与替加环素联合治疗会增强细胞内的氧化应激反应和对菌株的杀伤力。
此外,在 Tet(X4)基因阳性大肠杆菌所致全身感染小鼠模型中,Plu与乙酰甲环类药物联合应用可减少细菌载量、减轻病理损伤,表现出显著的抗菌疗效提升[50]。综上,Plu作为 Tet(X3)/Tet(X4)抑制剂,有望作为有潜力的先导药物,辅助四环素类药物进行抗菌治疗。
3.1.5 萜类
肠球菌可引起多种感染性疾病,包括尿路感染、伤口感染及危及生命的心内膜炎和脑膜炎,万古霉素是治疗肠球菌感染的重要抗菌药物,而耐万古霉素肠球菌(VRE)的出现和传播对其临床应用提出了挑战[51]。细胞分裂温度敏感突变体Z蛋白(FtsZ)是一种高度保守的蛋白质,在大多数原核细胞的细胞分裂中发挥关键作用。Lu 等[52]研究显示,从中药雷公藤中提取的天然产物雷公藤红素(CEL)与万古霉素协同治疗,在体外和体内均可恢复VRE对万古霉素的敏感性,且此种协同作用在23种肠球菌菌株中均可被观察到。该研究还发现,CEL与FtsZ蛋白具有极强的结合能力,可有效抑制肠球菌细胞分裂,从而发挥抑菌效果。提示,CEL有望成为一种新的抗菌剂及万古霉素辅助治疗剂,应用于抗VRE治疗。
外排泵是细菌耐药性产生的主要机制之一,其中 NorA外排泵是一种由NorA蛋白介导的多药耐药外排泵,广泛存在于多种细菌,尤其是MRSA中[53]。香芹酚可从中药百里香中提取,具有抗菌活性,可显著降低诺氟沙星对携带 NorA外排泵的MRSA菌株的最小抑菌浓度。研究显示,香芹酚可能是竞争性NorA抑制剂,可作为降低抗菌药物耐药性的佐剂,从而有效逆转MRSA的抗菌药物耐药性[54]。
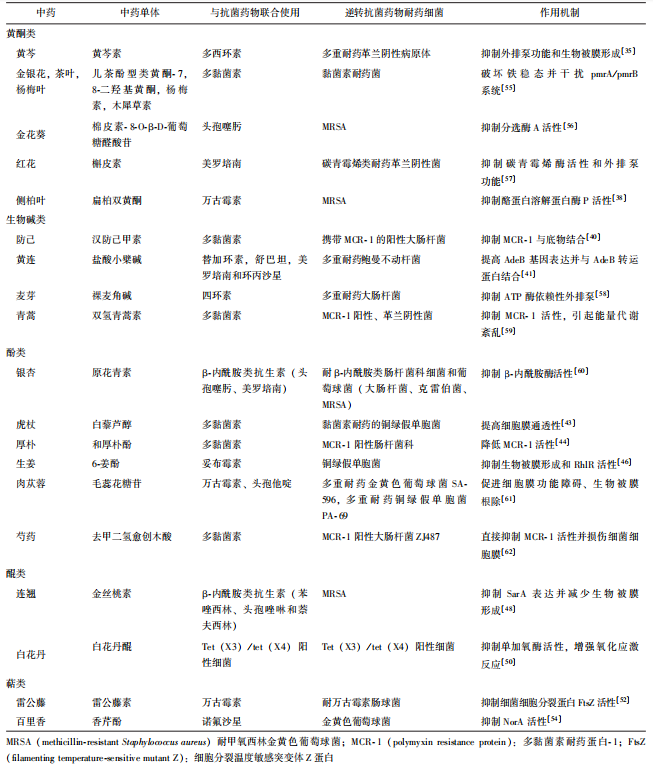
综上所述,多种中药有效单体成分与抗菌药物联合使用可有效发挥协同作用,从而逆转多种细菌的抗菌药物耐药性,为耐药菌的临床干预提供了新方向(表2)。
表2 中药有效提取物协同抗菌药物治疗作用的菌类及相关靶点
3.2 中药复方协同抗菌药物逆转耐药性
中药复方是中医临床用药的主要形式,是中医理论指导下按照一定组方原则,将两味或多味药物配伍使用的药剂。中药复方具有多种作用机制和特点,复方中的药物通过多成分、多靶点、多途径的协同作用,可发挥整体调节的优势。同时,复方中的药物相互作用,可增强或减弱药效,或产生新的药理作用,成为逆转抗菌药物耐药性的新思路。研究表明,大肠杆菌对β-lactams耐药机理主要是产生ESBLs[63],继而使抗菌药物失活。因此,ESBLs抑制剂是降低大肠杆菌抗菌药物耐药性的有效手段。
三黄汤、黄连解毒汤和五味消毒饮是中医临床中常用的三种清热剂汤剂,贾云鹏等[64]通过实验发现,此三种中药复方制剂的ESBLs抑制酶表达均显著高于阴性对照,具有抑制ESBLs表达的作用,且作用机理与克拉维酸不同,有望成为协同克拉维酸逆转大肠杆菌抗菌药物耐药性的有效策略。
痰热清注射液(TRQ)是由黄芩、熊胆粉等中药组成的复方制剂,姜童童[65]研究显示,在TRQ诱导的逆转作用下,MRSA的最小抑菌浓度值降低,不同程度地恢复了对相关抗菌药物的敏感性,证明TRQ可逆转 MRSA耐药性且具有遗传稳定性。
刘珏玲[66]开展的研究表明,当TRQ与利奈唑胺、万古霉素联合使用时具有明显的协同抑菌作用,不仅可显著降低各单一药物临床使用量,还可有效延长抑菌作用时间。此外,有多项研究显示,TRQ与抗菌药物联合应用可发挥协同抗菌作用,显著降低再次感染率,提高医疗质量[67-68]。
4 前景与挑战
中药应用于逆转抗菌药物耐药性具有广阔的前景。首先,中药中的活性成分通常具有多种靶点,可与细菌不断发生相互作用,此种多靶点效应可降低菌株对抗菌药物的耐药性。其次,中药可通过调节多个生物途径,恢复抗菌药物敏感性,从而逆转耐药性,尤其部分中药成分可干扰菌株内的抗菌药物转运系统,阻断耐药基因的传递和表达,减少抗药基因产生,这有助于减少耐药菌株扩散,提高抗菌药物治疗效果[69-70]。再次,中药种类繁多,资源丰富,为开发新型抗菌药物逆转剂提供了丰富的物质基础,通过深入研究中药的活性成分和药理作用,有望发现更多具有逆转抗菌药物耐药性的中药单体或复方制剂。
同时,中药应用于逆转抗菌药物耐药性尚面临诸多挑战:
1 中草药成分复杂,活性成分多样,导致中药的提取、分离和纯化存在一定困难。传统中药成分提取工艺如回流法、浸渍法、渗漉法、发酵法等在中药提取液中通常难以达到理想的澄清和提纯效果,且存在过滤困难、杂质多、环保负担重等问题,而现代提取技术如超高压提取技术、超临界流体萃取技术等,虽有效解决了纯度问题,但也面临前期投入大、技术理论有待完善等困境[71]。同时,部分中药的药理作用机制尚未完全明确,这限制了其在逆转抗菌药物耐药性方面的应用。为深入探究中药在逆转抗菌药物耐药性方面的潜力,未来需持续改进提取工艺,以进一步提高中药的提取效率和质量,并加大对中药药理作用机制的研究投入,明确其作用机制。
2 当前我国中药的质量控制体系尚未完全建立,不同产地、批次的中药质量存有差异,这给中药在逆转抗菌药物耐药性方面的深入研究和广泛应用带来了不确定性[72]。因此,建立统一、全面的中药材质量评价标准迫在眉睫。通过制定严格的质量控制标准,有助于确保中药材质量和疗效的稳定性,为中药在逆转抗菌药物耐药性方面的应用提供有力保障。
3 部分中药与抗菌药物联合使用会降低治疗效果,甚至产生一定的毒副作用。例如,碱性中药硼砂、槟榔、延胡索等与呋喃坦啶、氨苄青霉素等抗菌药物同时服用,会导致抗菌效力大幅降低;中药石榴皮、地榆、五倍子等与抗菌药物红霉素、四环素、利福平等一起服用,其中的成分会发生相互作用从而加重患者肝脏损害,甚至出现药源性肝病[73]。因此,中药与抗菌药物联合使用时,尤应关注配伍禁忌。
4 目前相关研究多为体外实验和动物模型,中药在逆转抗菌药物耐药性方面的效果尚需经过严格的临床研究验证。在将中药用于逆转抗菌药物耐药性前,需通过临床试验验证其疗效和安全性,还应充分考虑患者的个体差异对中药疗效和安全性产生的影响。
5 小结
抗菌药物耐药性是医药行业亟待解决的难题。中医药资源是我国的瑰宝,其具备多种特殊优势,是解决耐药菌的突破口,中西医结合治疗细菌感染性疾病是未来发展的必然趋势。中药与抗菌药物的联合应用可优势互补,提高整体疗效,同时中药的加入有助于降低抗菌药物引起的不良反应,如胃肠道不适、过敏反应等。此外,中药的调理作用有助于减少抗菌药物的副作用,使患者更好地耐受治疗,加速病情好转,从而缩短治疗周期,减轻患者的经济负担和身心痛苦。未来通过深入研究中药与抗菌药物之间的相互作用机制,利用中药有效成分进行结构优化和新药开发,可为合理开展联合用药提供科学依据,并为细菌感染性疾病的治疗提供更多选择。
参考文献
[1]GBD 2021 Antimicrobial Resistance Collaborators. Global burden of bacterial antimicrobial resistance 1990—2021: a systematic analysis with forecasts to 2050[J]. Lancet, 2024, 404(10459): 1199-1226.
[2]Antimicrobial Resistance Collaborators. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis[J]. Lancet, 2022, 399(10325): 629-655.
[3]周琦, 张宝善, 韦露莎, 等. 魔芋飞粉生物碱的抑菌活性及抑菌机理研究[J]. 西北农林科技大学学报(自然科学版), 2019, 47(3): 121-128.
[4]刘昊, 赵自冰, 王新. 黄芩苷对大肠埃希菌的抗菌活性及其作用机制[J]. 中国生物制品学杂志, 2019, 32(9): 983-986.
[5]郭俸钰, 陈文学, 陈海明, 等. 芳樟醇对大肠杆菌的抑菌作用机制[J]. 现代食品科技, 2020, 36(4): 113-118.
[6]潘旭迟, 许剑锋, 傅昱晟, 等. 3种植物挥发油抑制食源性细菌生长活性成分及机理[J]. 食品科学, 2017, 38(13): 143-149.
[7]娄在祥. 牛蒡功能性成分及其抗氧化、抗菌活性研究[D]. 无锡: 江南大学, 2010.
[8]李兆亭, 陈文学, 韩迎洁, 等. 胡椒单萜类化合物对单增李斯特菌抑菌机理的研究[J]. 食品工业科技, 2018, 39(23): 154-158.
[9]Yu X D, Zheng R B, Xie J H, et al. Biological evaluation and molecular docking of baicalin and scutellarin as Helicobacter pylori urease inhibitors[J]. J Ethnopharmacol, 2015, 162: 69-78.
[10]张赟彬, 刘笑宇, 姜萍萍, 等. 肉桂醛对大肠杆菌和金黄色葡萄球菌的抑菌作用及抑菌机理研究[J]. 现代食品科技, 2015, 31(5): 31-35.
[11]Song Z, Sun H W, Yang Y, et al. Enhanced efficacy and anti-biofilm activity of novel nanoemulsions against skin burn wound multi-drug resistant MRSA infections[J]. Nanomedicine, 2016, 12(6): 1543-1555.
[12]蒋庆佳, 杨放, 杨安迪, 等. 中药抑菌活性成分及其作用机制研究进展[J]. 中国抗生素杂志, 2023, 48(8): 855-861.
[13]杨轶涵, 毛娅芯, 徐新平. 中药协同抗真菌药物抗隐球菌的研究进展[J]. 微生物学报, 2025, 65(2): 537-550.
[14]Ding Y W, Zeng L J, Li R F, et al. The Chinese prescription Lianhuaqingwen capsule exerts anti-influenza activity through the inhibition of viral propagation and impacts immune function[J]. BMC Complement Altern Med, 2017, 17(1): 130.
[15]萨仁高娃, 胡文忠, 冯可, 等. 植物精油及其成分对病原微生物抗菌机理的研究进展[J]. 食品科学, 2020, 41(11): 285-294.
[16]Tapia-Rodriguez M R, Bernal-Mercado A T, Gutierrez-Pacheco M M, et al. Virulence of Pseudomonas aeruginosa exposed to carvacrol: alterations of the quorum sensing at enzymatic and gene levels[J]. J Cell Commun Signal, 2019, 13(4): 531-537.
[17]Sharifi A, Ahmadi A, Mohammadzadeh A. Streptococcus pneumoniae quorum sensing and biofilm formation are affected by Thymus daenensis, Satureja hortensis, and Origanum vulgare essential oils[J]. Acta Microbiol Immunol Hung, 2018, 65(3): 345-359.
[18]云宝仪, 周磊, 谢鲲鹏, 等. 黄芩素抑菌活性及其机制的初步研究[J]. 药学学报, 2012, 47(12): 1587-1592.
[19]李凡凡, 郑越超. 天然生物碱抗菌活性及机理研究[J]. 医学信息, 2021, 34(17): 49-52.
[20]彭元丽, 邹坤, 陈国华. 中药消除大肠杆菌耐药质粒研究[J]. 时珍国医国药, 2009, 20(1): 139-140.
[21]陈小英. 大黄素对金黄色葡萄球菌抗生素耐药质粒的消除作用[J]. 中国药科大学学报, 1985, 16(2): 48-52.
[22]汪东海, 陈敏, 姜志强, 等. 黄芩苷消除鲍曼不动杆菌耐药质粒的实验研究[J]. 中国现代应用药学, 2012, 29(5): 400-404.
[23]汪晶, 汪辉. 五倍子对产超广谱β-内酰胺酶的大肠埃希菌的体外抗菌和质粒消除作用[J]. 南京中医药大学学报, 2015, 31(6): 564-566.
[24]李仲兴, 王秀华, 赵建宏, 等. 乌梅对308株临床菌株的抑菌效果[J]. 中国中医药信息杂志, 2007, 14(11): 41-42.
[25]梁华, 彭小宝, 杨军平, 等. 清开灵、双黄连联合头孢哌酮-舒巴坦钠对产ESBLs肺炎克雷伯菌抗菌作用研究[J]. 实验与检验医学, 2016, 34(6): 723-727.
[26]Saier M H, Jr, Reddy V S, Tsu B V, et al. The transporter classification database (TCDB): recent advances[J]. Nucleic Acids Res, 2016, 44(D1): D372-D379.
[27]程成, 张薇, 朱波, 等. 中药抗常见耐药菌的作用及其机制研究进展[J]. 南京中医药大学学报, 2019, 35(2): 229-233.
[28]王晓磊. 蟾酥与氨基糖苷类抗菌药物联合抗多重耐药鲍曼不动杆菌的实验研究[D]. 杭州: 浙江中医药大学, 2016.
[29]杨婷, 董晨旭, 姚晓栋, 等. 中药抑制金黄色葡萄球菌的研究进展[J]. 临床医学进展, 2022, 12(4): 3153-3161.
[30]陈雯, 丁纯蕾, 孙旗, 等. 探讨中药及其成分对细菌生物被膜耐药抑制作用的研究进展[J]. 环球中医药, 2024, 17(1): 144-149.
[31]Zheng X K, Chen L J, Zeng W L, et al. Antibacterial and anti-biofilm efficacy of Chinese dragon's blood against Staphylococcus aureus isolated from infected wounds[J]. Front Microbiol, 2021, 12: 672943.
[32]钱卫东, 刘婵婵, 王婷, 等. 丁香酚对多重耐药大肠杆菌的抑菌活性及其作用机制研究[J]. 现代食品科技, 2019, 35(1): 31-36.
[33]官妍, 陈冉, 汪长中, 等. 苦参碱、鱼腥草素钠及其与红霉素联用对表皮葡萄球菌生物被膜渗透作用的研究[J]. 中国微生态学杂志, 2016, 28(5): 515-519.
[34]张曾宇, 陈嘉敏, 卢圣花, 等. 苷类中药单体减轻心肌缺血再灌注损伤机制的研究进展[J]. 实用心脑肺血管病杂志, 2023, 31(9): 115-121.
[35]Wang Y H, Su J F, Zhou Z Y, et al. Baicalein resensitizes multidrug-resistant gram-negative pathogens to doxycycline[J]. Microbiol Spectr, 2023, 11(3): e0470222.
[36]刘星蕾, 里艳茹, 许函铢, 等. 一测多评法同时测定侧柏叶中5种黄酮类成分的含量[J]. 亚太传统医药, 2022, 18(2): 92-96.
[37]Clauditz A, Resch A, Wieland K P, et al. Staphyloxanthin plays a role in the fitness of Staphylococcus aureus and its ability to cope with oxidative stress[J]. Infect Immun, 2006, 74(8): 4950-4953.
[38]Kong X R, Wang B M, Chen X Y, et al. Hinokiflavone attenuates the virulence of methicillin-resistant Staphylococcus aureus by targeting caseinolytic protease P[J]. Antimicrob Agents Chemother, 2022, 66(8): e0024022.
[39]VinodhKumar O R, Karikalan M, Ilayaraja S, et al. Multi-drug resistant (MDR), extended spectrum beta-lactamase (ESBL) producing and carbapenem resistant Escherichia coli in rescued Sloth bears (Melursus ursinus), India[J]. Vet Res Commun, 2021, 45(2/3): 163-170.
[40]Shafiq M, Yao F, Bilal H, et al. Synergistic activity of tetrandrine and colistin against mcr-1-harboring Escherichia coli[J]. Antibiotics (Basel), 2022, 11(10): 1346.
[41]Li X B, Song Y Q, Wang L N, et al. A potential combination therapy of berberine hydrochloride with antibiotics against multidrug-resistant Acinetobacter baumannii[J]. Front Cell Infect Microbiol, 2021, 11: 660431.
[42]Li L L, Zhu Y G, Jia X M, et al. Adipose-derived mesenchymal stem cells ameliorating Pseudomonas aeruginosa-induced acute lung infection via inhibition of NLRC4 inflammasome[J]. Front Cell Infect Microbiol, 2020, 10: 581535.
[43]Wang L B, Zhang Y, Lin Y S, et al. Resveratrol increases sensitivity of clinical colistin-resistant Pseudomonas aeruginosa to colistin in vitro and in vivo[J]. Microbiol Spectr, 2023, 11(1): e0199222.
[44]Guo Y, Lv X H, Wang Y L, et al. Honokiol restores polymyxin susceptibility to MCR-1-positive pathogens both in vitro and in vivo[J]. Appl Environ Microbiol, 2020, 86(5): e02346-19.
[45]Kim H S, Lee S H, Byun Y, et al. 6-Gingerol reduces Pseudomonas aeruginosa biofilm formation and virulence via quorum sensing inhibition[J]. Sci Rep, 2015, 5: 8656.
[46]Ham S Y, Kim H S, Jo M J, et al. Combined treatment of 6-gingerol analog and tobramycin for inhibiting Pseudomonas aeruginosa infections[J]. Microbiol Spectr, 2021, 9(2): e0019221.
[47]金月, 李富云, 谢静, 等. 贯叶连翘的历史沿革、化学成分及药理作用研究进展[J]. 中国野生植物资源, 2024, 43(3): 82-89.
[48]Wang G Z, Li L, Wang X K, et al. Hypericin enhances β-lactam antibiotics activity by inhibiting sarA expression in methicillin-resistant Staphylococcus aureus[J]. Acta Pharm Sin B, 2019, 9(6): 1174-1182.
[49]He T, Wang R, Liu D J, et al. Emergence of plasmid-mediated high-level tigecycline resistance genes in animals and humans[J]. Nat Microbiol, 2019, 4(9): 1450-1456.
[50]Xu L, Zhou Y L, Niu S, et al. A novel inhibitor of monooxygenase reversed the activity of tetracyclines against tet(X3)/tet(X4)-positive bacteria[J]. EBioMedicine, 2022, 78: 103943.
[51]Haque M, Sartelli M, McKimm J, et al. Health care-associated infections-an overview[J]. Infect Drug Resist, 2018, 11: 2321-2333.
[52]Lu X, Wang Y X, Guo W, et al. Antibacterial activity of an FtsZ inhibitor celastrol and its synergistic effect with vancomycin against enterococci in vitro and in vivo[J]. Microbiol Spectr, 2023, 11(1): e0369922.
[53]Bhaskar B V, Babu T M C, Reddy N V, et al. Homology modeling, molecular dynamics, and virtual screening of NorA efflux pump inhibitors of Staphylococcus aureus[J]. Drug Des Devel Ther, 2016, 10: 3237-3252.
[54]Dos Santos Barbosa C R, Scherf J R, De Freitas T S, et al. Effect of carvacrol and thymol on NorA efflux pump inhibition in multidrug-resistant (MDR) Staphylococcus aureus strains[J]. J Bioenerg Biomembr, 2021, 53(4): 489-498.
[55]Catteau L, Reichmann N T, Olson J, et al. Synergy between ursolic and oleanolic acids from Vitellaria paradoxa leaf extract and β-lactams against methicillin-resistant Staphylococcus aureus: in vitro and in vivo activity and underlying mechanisms[J]. Molecules, 2017, 22(12): 2245.
[56]Song W, Wang L, Zhao Y H, et al. Hibifolin, a natural sortase A inhibitor, attenuates the pathogenicity of Staphylococcus aureus and enhances the antibacterial activity of cefotaxime[J]. Microbiol Spectr, 2022, 10(4): e0095022.
[57]Pal A, Tripathi A. Quercetin inhibits carbapenemase and efflux pump activities among carbapenem-resistant Gram-negative bacteria[J]. APMIS, 2020, 128(3): 251-259.
[58]Dwivedi G R, Maurya A, Yadav D K, et al. Synergy of clavine alkaloid ‘chanoclavine’ with tetracycline against multi-drug-resistant E. coli[J]. J Biomol Struct Dyn, 2019, 37(5): 1307-1325.
[59]Zhou Y L, Liu B C, Chu X L, et al. Commercialized artemisinin derivatives combined with colistin protect against critical Gram-negative bacterial infection[J]. Commun Biol, 2022, 5(1): 931.
[60]Gallique M, Wei K, Maisuria V B, et al. Cranberry-derived proanthocyanidins potentiate β-lactam antibiotics against resistant bacteria[J]. Appl Environ Microbiol, 2021, 87(10): e00127-21.
[61]Shi C Y, Ma Y M, Tian L, et al. Verbascoside: an efficient and safe natural antibacterial adjuvant for preventing bacterial contamination of fresh meat[J]. Molecules, 2022, 27(15): 4943.
[62]Song G, Zhou Y L, Niu S, et al. Nordihydroguaiaretic acid reverses the antibacterial activity of colistin against MCR-1-positive bacteria in vivo/in vitro by inhibiting MCR-1 activity and injuring the bacterial cell membrane[J]. Phytomedicine, 2022, 98: 153946.
[63]Zhao X L, Miao Y Q, Adam F E A, et al. ESBLs-producing Escherichia coli from sheep-origin: genome-wide virulence genes identification and in vivo virulence assessment in mice and Galleria mellonella[J]. Transbound Emerg Dis, 2022, 69(6): 3606-3617.
[64]贾云鹏, 程宁. 中药对大肠埃希菌抗生素耐药性逆转作用的实验研究[J]. 陕西中医, 2009, 30(3): 366-368.
[65]姜童童. 痰热清注射液对临床分离耐药菌的逆转作用及机制探讨[D]. 长春: 吉林农业大学, 2019.
[66]刘珏玲. 痰热清注射液对耐甲氧西林金黄色葡萄球菌的作用及机制研究[D]. 北京: 中国中医科学院, 2017.
[67]李勇, 付曦, 李林, 等. 抗菌药物联合痰热清注射液治疗肺癌患者化疗后继发肺部感染的临床疗效研究[J]. 中华医院感染学杂志, 2017, 27(24): 5576-5579.
[68]黄星月, 段笑娇, 吴嘉瑞, 等. 基于Meta分析的痰热清注射液联合抗菌药治疗老年社区获得性肺炎临床评价研究[J]. 药物流行病学杂志, 2018, 27(12): 777-784.
[69]何霞飞, 陈开森, 邹立津. 瑞香素体外联合抗生素抗MRSA的研究[J]. 广东医学, 2024, 45(9): 1113-1117.
[70]王瑜豪, 于进洋, 王圣睿, 等. 中药协同抗生素抑制金黄色葡萄球菌生物膜形成研究进展[J]. 中医学报, 2024, 39(7): 1484-1491.
[71]周鹏, 宋晨, 池仕红, 等. 中药提取工艺研究进展[J]. 中兽医医药杂志, 2022, 41(5): 37-43.
[72]陶冶, 徐新房, 魏锋, 等. 中药材产地加工趁鲜切制高质量规范化发展的思考[J]. 中国现代中药, 2024, 26(9): 1443-1451.
[73]唐钰理, 蒋晨. 浅谈抗生素与中药的不合理联用[J]. 中国药业, 2004, 13(5): 60.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)