首页 > 医疗资讯/ 正文

摘要
背景:在心房颤动的脉冲电场消融(PFA)手术中,必须实施深度镇静或全身麻醉。与深度镇静不同,全身麻醉(常规,或全凭静脉麻醉TIVA)需要气道管理。为寻找最优的镇静方案,本研究比较了瑞马唑仑+氯胺酮深度镇静、异丙酚+阿片类TIVA以及异丙酚+阿片类深度镇静的效果,重点评估与镇静相关的不良事件。
方法:拟行房颤导管消融的患者被随机分为三组:(1)间歇性异丙酚+阿片类推注的深度镇静(P组);(2)连续静脉输注瑞马唑仑+氯胺酮的深度镇静(R组);(3)在气道管理下的异丙酚+阿片类TIVA(TIVA组)。所有消融均采用FARAPULSE系统进行,主要排除标准为阻塞性睡眠呼吸暂停综合征。主要终点为需干预或导致手术中断的低氧血症、低血压及高血压事件的复合终点。次要终点包括血流动力学不稳定事件、手术时间、严重不良事件及患者满意度。
结果:共纳入127例患者(平均年龄62.9±10.3岁,女性35.1%,阵发性房颤占47.2%)。主要终点发生率在P、R、TIVA三组分别为85.7%、27.9%、66.7%(P<0.001),其中P组的不良事件主要以低氧血症为主,TIVA组则以低血压为主。三组在手术时间、严重不良事件发生率及患者满意度方面无显著差异。
结论:在心房颤动PFA手术中,瑞马唑仑+氯胺酮深度镇静较异丙酚+阿片类方案(无论推注或持续输注)更优,低氧血症与低血压风险最低。超过80%的采用常规异丙酚+阿片类镇静方案(P组)的患者出现了低氧血症。
引言
导管消融是治疗药物难治性症状性心房颤动最有效的方法之一。一种新技术——脉冲电场消融(PFA)——已进入临床实践。与传统的热消融技术(如射频或冷冻消融)相比,PFA通过不可逆电穿孔的非热机制诱导组织选择性损伤,PFA速度更快,且显著降低了对邻近组织的损伤风险(例如心房–食管瘘或膈神经麻痹)。然而,PFA的脉冲应用,尤其在单极设置下,会对周围神经肌肉结构产生更强烈的刺激与疼痛。因此,如何在保证患者安全且便于操作者操作的前提下,使PFA过程可耐受,仍是一个关键问题。在临床实践中,这意味着既要提供足够的镇静与镇痛深度,又要避免麻醉药物使用过量和不必要的侵入性气道操作。镇静深度是一个连续过程,从轻度镇静(伴抗焦虑作用)、经有意识镇静和深度镇静,直到全身麻醉;深度镇静的主要风险是气道控制丧失及继发低氧血症。全凭静脉麻醉(TIVA)是全身麻醉的一种亚型,仅使用静脉麻醉药,从而避免吸入性挥发剂。更广义的“镇痛镇静”指在镇静过程中合并使用强效镇痛药。
最早的PFA手术因单极脉冲导致明显的肌束颤动而采用经气管插管并肌松的全身麻醉;随着双极脉冲配置的引入,全身麻醉不再是必需,许多中心恢复了与射频消融相似的做法,即采用推注式静脉镇静而不建立受控气道。
由于PFA通常需要更高的镇静剂总量,我们假设基于推注的镇静可能与低氧血症和气道丧失等风险相关。鉴于连续输注的优势及氯胺酮在PFA中的良好特性,我们提出了一种替代性的深度镇痛镇静方案:以连续输注瑞马唑仑为主,并在需要时联合氯胺酮推注。我们推测该方案可在未建立受控气道的条件下提供更佳的安全性。
本研究比较了传统推注式方案、瑞马唑仑+氯胺酮方案以及在气道受控下实施的异丙酚+阿片类TIVA,旨在评估优化的连续深度镇静是否能减少不良事件,并系统比较三种方案的镇静深度与满意度。
研究方法
试验设计、伦理与注册
本研究为前瞻性、随机、平行、单盲(受试者盲)单中心临床试验,经捷克Kralovske Vinohrady大学医院伦理委员会批准,并注册于ClinicalTrials.gov。所有受试者均签署书面知情同意书。
研究对象
纳入年龄≥18岁、符合房颤导管消融指征(阵发性或持续性)且签署知情同意的患者。主要排除标准包括纽约心功能分级(NYHA)Ⅲ–Ⅳ级心力衰竭、重度瓣膜性心脏病及阻塞性睡眠呼吸暂停综合征(呼吸暂停低通气指数[AHI]≥30)。
手术流程
患者术前禁食过夜,术前2小时可饮用清液。次日上午按1:1:1随机分配至三组:(1)P组:常规异丙酚+阿片类深度镇静;(2)R组:瑞马唑仑+氯胺酮的优化深度镇静;(3)TIVA组:气道受控下的异丙酚+阿片类全凭静脉麻醉。
导管消融均采用FARAPULSE脉冲电场消融系统(Boston Scientific, MA, USA),依据当时的操作指南实施,并在心内超声引导下完成。五极导管定位于肺静脉开口,应用脉冲电场能实现肺静脉隔离(PVI)。非阵发性房颤患者在PVI基础上加做左心房后壁及二尖瓣峡部消融;按需追加峡部或顶端消融。
麻醉与监测
围术期持续监测心电图、脉搏血氧、呼气末二氧化碳及有创动脉血压,麻醉医生及助手全程在场。镇静深度采用双频谱指数(BIS)监测,对BIS值设盲。所有深度镇静患者(P组与R组)均以面罩5 L/min给氧。镇静在术区消毒期间开始,于经房间隔穿刺后2–5分钟加深。最后一次消融后采集动脉血气。
P组(常规深度镇静):先以咪达唑仑静注预镇静,给予舒芬太尼5–10 µg及异丙酚0.8–1.0 mg/kg进行诱导,术中可根据需要追加0.5 mg/kg异丙酚。如镇静不足,可加用咪达唑仑或舒芬太尼推注。
R组(优化深度镇静):静注瑞马唑仑后按0.5 mg/kg·h(按理想体重计算)持续输注,消融开始前推注氯胺酮1 mg/kg;必要时追加氯胺酮0.5 mg/kg或瑞马唑仑2.5 mg。如镇痛不足,可补充舒芬太尼。
TIVA组:缓慢输注异丙酚及推注舒芬太尼诱导,房间隔穿刺后,使用基于Schnider药代动力学模型的靶控输注系统,设置目标血浆浓度设定为5–8 µg/mL完成诱导麻醉,以3–6 µg/mL维持麻醉深度。给予罗库溴铵0.2–0.4 mg/kg后插入喉罩建立气道。呼吸机吸氧分数设为0.3–0.4,调整分钟通气量以维持呼气末CO₂ 30–40 mmHg。消融结束后停止输注,患者苏醒后拔除喉罩。
结果指标
主要终点为需干预或导致手术中断的低氧血症、低血压或高血压事件的复合终点。次要终点包括:(1)血流动力学不稳定事件次数(每5分钟内持续或反复者计为新事件);(2)持续>60秒的不稳定事件数(低氧血症SpO₂ < 85%、低血压收缩压< 85 mmHg或高血压> 200 mmHg);(3)干预总次数(如气道操作、提高氧浓度、使用血管活性或抗高血压药);(4)手术总时长(皮肤切开至缝合);(5)最低BIS值;(6)术后12–24 小时的镇静质量评分;(7)操作难度评分(1–10分);(8)术者满意度评分(1–10分);(9)严重不良事件数;(10)术后PaCO₂。
统计学分析
基于既往文献,异丙酚相关低血压发生率约25%,低氧血症约29%。预计P组主要终点率为60%,TIVA组30%,R组30%。按双侧α = 0.05、检验效能80%计算,需样本量126例,可检测TIVA与P组、R组与P组间的差异(不含R组与TIVA组比较)。连续变量以均数±标准差或中位数(四分位间距)表示,分类变量以频数(%)表示。二分类变量采用χ²或Fisher确切检验,多重比较经Holm校正;正态分布数据用方差分析及Tukey检验,偏态分布数据用Kruskal–Wallis检验及配对Wilcoxon秩和检验(Holm校正)。2个独立样本的均值,使用t检验或Wilcoxon秩和检验比较。双尾P < 0.05为差异有统计学意义。数据分析使用R软件(v4.3.3,R Foundation for Statistical Computing, 2024)。
研究结果
患者和手术情况
自2023年10月至2024年9月,共筛查154例患者,其中127例符合入选标准并随机分配至P组(n=42)、R组(n=43)和TIVA组(n=42)(图1)。主要排除原因为阻塞性睡眠呼吸暂停综合征。平均年龄62.9±10.3岁,女性占35.1%,阵发性房颤占47.2%。三组基线临床特征相似(表1)。
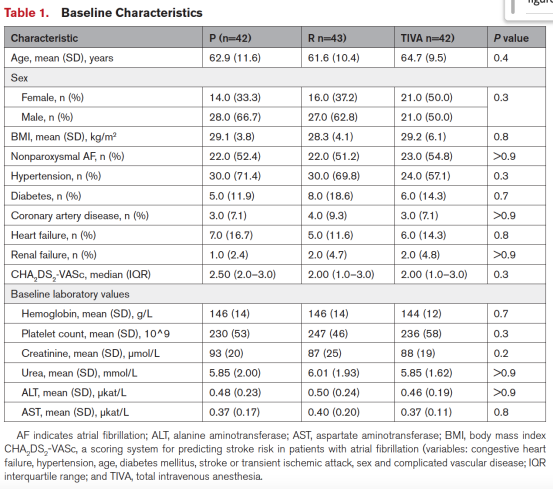
全体患者手术中位时长为58分钟(IQR 45–67),所有病例均成功完成肺静脉隔离(PVI)。在非肺静脉靶向消融中,65例(51.2%)行左房后壁消融,60例(47.2%)行二尖瓣峡部消融。仅行PVI的患者脉冲放电次数中位数为38次(IQR 32–40),联合后壁或峡部消融的患者中位70次(IQR 62–77)。P组1例因血管通路困难及高并发症风险未接受PFA,排除于方案分析。
主要终点
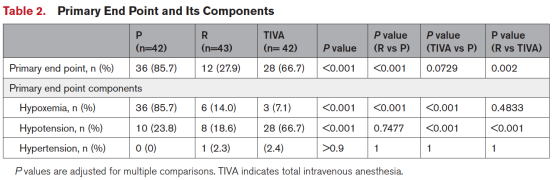
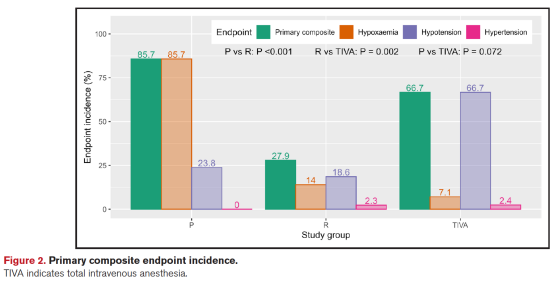
在意向治疗分析中,主要终点(需干预或导致手术中断的低氧血症、低血压或高血压事件)发生率在三组间存在显著差异(P<0.001):P组85.7%,R组27.9%,TIVA组66.7%。与P组相比,R组主要终点显著减少(27.9% vs 85.7%,P<0.001);与TIVA组相比亦明显降低(27.9% vs 66.7%,P=0.002);而TIVA组与P组间差异无统计学意义(表2,图2)。
次要终点
需干预的不稳定事件
在需干预的不稳定事件中(如调整吸氧浓度、气道操作或药物干预),TIVA组低血压事件最为常见(P vs TIVA:23.8% vs 66.7%,P<0.001;R vs TIVA:18.6% vs 66.7%,P<0.001)。低氧血症事件主要集中于P组,R组及TIVA组发生率显著降低(P vs R:85.7% vs 14.0%,P<0.001;P vs TIVA:85.7% vs 7.1%,P<0.001)。高血压事件罕见,三组间差异无统计学意义。
若按所有血流动力学不稳定事件(不论是否需干预)计算结果亦相似:低氧血症在P组最常见(P<0.001),低血压在TIVA组最常见(P<0.001),高血压事件无显著差异。低氧血症事件率最高的P组需进行更多气道干预(如下颌抬举、提高吸氧浓度,均P<0.001),而TIVA组中需使用血管活性药物的患者比例最高(P<0.001)。
手术总时间与BIS
三组手术总时长相近(P=0.18),但TIVA组有延长趋势。最低BIS值在TIVA组显著低于P组(27.8±9.2 vs 52.2±14.4,P<0.001),提示麻醉深度更深(图3)。
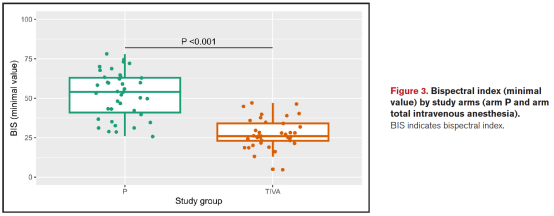
患者与术者满意度
根据术后镇静质量调查,三组患者自评满意度无显著差异。术者主观评估显示,TIVA组镇静质量与操作便利性最佳,而麻醉医生认为P组患者最难维持合适镇静水平(图4)。
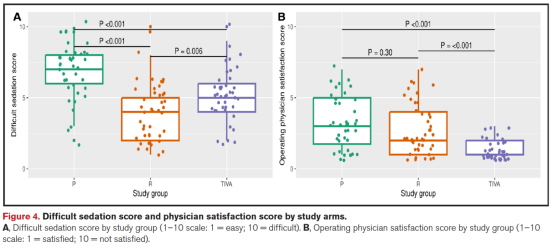
PaCO₂、严重不良事件及其他并发症
术后PaCO₂水平在P组最高、TIVA组最低,组间差异显著(P<0.001)。TIVA组发生两例严重不良事件(1例术中急诊插管,1例因循环不稳中止手术),但总体严重不良事件发生率组间无显著差异。此外,共报告5例其他与手术相关的非严重并发症:2例发生于P组、2例于R组、1例于TIVA组,具体包括动静脉瘘、假性动脉瘤、咽部血肿、冠状动脉痉挛及氯胺酮相关躁动。所有病例经保守治疗后均顺利恢复,出院后未见新的并发症。
讨论
本研究比较了PFA过程中三种镇静方案:欧洲常用的异丙酚+阿片类间歇推注深度镇静,连续输注瑞马唑仑+氯胺酮深度镇静,以及北美更为常用、在气道受控下实施的异丙酚TIVA。结果显示,瑞马唑仑+氯胺酮深度镇静可显著降低低氧血症和低血压事件的发生率。P组与TIVA组总体主要终点发生率相似,但事件性质不同:P组以低氧血症为主,TIVA组则主要表现为低血压。约85%的P组患者出现围术期低氧,伴随PaCO₂升高及低通气,提示镇静深度已接近全身麻醉水平(BIS约52)。尽管所有患者均由麻醉师全程监护并排除了睡眠呼吸暂停,但仍出现高比例低氧事件,说明在未建立受控气道的情况下,常规深度镇静难以确保足够安全性。
瑞马唑仑+氯胺酮方案凭借起效快、代谢迅速、血流动力学稳定及呼吸抑制风险低的优势,为PFA提供了更理想的镇静策略。氯胺酮可在维持气道反射的同时提供镇痛,并通过交感激活升高血压;苯二氮䓬类药物则可缓解其潜在的精神兴奋或幻觉反应。两药联用在PFA这一高刺激环境下表现出良好的平衡性——既能维持足够的镇静深度以耐受脉冲放电,又可避免低血压和气道丧失。尽管在该方案下低氧/低血压事件发生率仍约28%,但结果仍强调进行此类手术时应由受过气道管理培训的麻醉团队在场,以确保安全。
在部分欧洲中心,非麻醉人员执行深度镇静的现象仍然存在。2010–2019年全球调查显示,28.6%的房颤消融在无麻醉师在场的情况下实施,其中约11.8%的术者可独立完成深度镇静。EU-PORIA注册研究进一步显示,在欧洲7个高容量中心进行的1233例PFA中,约80%使用深度镇静,20%使用全身麻醉。随着PFA应用的普及与适应症的扩展,未来将涵盖更多高龄及伴有冠心病等共病患者,在此类人群中,低氧与低血压的叠加可能导致严重围术期并发症,甚至延迟性认知障碍。本研究中约半数不良事件与镇静相关,而非导管操作本身,提示有必要重新审视PFA的镇静策略与实施规范。
三种方案在手术时长和患者满意度方面无显著差异。TIVA并未延长手术时间,可能因流程更为顺畅所致;术者认为TIVA组镇静质量与操作稳定性最佳,而麻醉师普遍认为P组患者镇静管理最具挑战。对于单针导管系统,患者轻度移动对操作影响有限,但在电标测系统中,体动可能造成图像漂移并延长手术时间。瑞马唑仑+氯胺酮方案的优越特性值得在其他高刺激性心血管介入手术(如经导管主动脉瓣置换术,TAVR)中进一步验证。既往TAVR随机研究显示,深度镇静与全身麻醉在30天主要复合终点(死亡、心梗、中风、感染、急性肾损伤)方面无差异,但镇静方案不一致使结果解释受限。我们的结果强调,镇静深度与药物组合同样关键,未来需在严格设计的试验中进一步验证。
研究结论
在本项前瞻性随机对照研究中,我们比较了房颤PFA手术中不同镇静方案的安全性。结果表明,瑞马唑仑+氯胺酮深度镇静较异丙酚深度镇静或全凭静脉麻醉带来的镇静相关不良事件更少。无论采用何种方案,仍有相当比例的患者出现需立即干预的不良事件,提示在PFA过程中必须由专业麻醉团队在场,以确保患者安全。
醉仁心胸 评述
本研究为单中心临床研究,结果可能受机构经验影响,麻醉师与术者未实施盲法,可能对主观性指标(如镇静难度评分)造成影响。研究排除了高危患者,如阻塞性睡眠呼吸暂停、心力衰竭及重度瓣膜病患者,因此外推性有限。研究要求麻醉师严格遵循方案,但在临床实际中,经验丰富者可能会根据患者状态调整药物剂量或种类。主要终点为复合指标,包含低血压、高血压与低氧血症,其临床意义并不完全等同。
PFA的麻醉在北美均以全身麻醉为主,全身麻醉并没有明显缺陷。深度镇静是欧洲部分国家常用的麻醉方式,瑞马唑仑+氯胺酮方案具有起效快、代谢迅速、血流动力学稳定、呼吸抑制风险相对低的优势。但是,在该方案下低氧/低血压事件发生率仍约28%,因此依然强调进行此类手术时,应由受过气道管理培训的麻醉团队在场,以确保安全。鉴于上述局限性,该研究结果也仅供电生理医生与麻醉医生参考。
参考文献
Sochorová V, Kunštátová V, Osmančík P et al. Conventional vs. Optimized Periprocedural Analgosedation vs. Total Intravenous Anesthesia for Pulsed-Field Ablation: a Three-Arm Randomized Controlled Trial (COOPERATIVE-PFA). Circulation, 2025; 152(3):150-159.
- 上一篇:围术期麻醉相关生命质量调控之多模式镇痛技术
- 下一篇:糖尿病患者的麻醉
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)