首页 > 医疗资讯/ 正文
癌症的致命性不仅在于原发肿瘤的生长,更在于其向远端器官的转移。近年来的研究发现,早在癌细胞扩散前,原发肿瘤就能通过系统性"预处理"(pre-conditioning)为转移创造有利环境——即形成"转移前生态位"(pre-metastatic niche, PMN)。这篇于2024年10月发表在《Nature Reviews Cancer》(IF:66.8)的题为《Cancer-induced systemic pre-conditioning of distant organs: building a niche for metastatic cells》的综述系统梳理了PMN的形成机制、关键效应分子及临床意义。作者对迄今为止描述的原发性肿瘤远处转移的机制和介质进行更新,这些机制和介质可诱导远处器官的促转移条件生成,从而有利于早期转移前生态位的形成,以帮助我们更全面地了解促肿瘤转移进展的过程,为癌症治疗提供新思路。

在肿瘤生长过程的早期,肿瘤就通过血管、淋巴管和神经连接与宿主全身互动。癌细胞释放大量介质(如外泌体、细胞因子),改变远端组织的微环境,使其更易接纳转移细胞。这种系统性扰动不仅促进转移,还可能引发恶病质等全身综合征,最终导致死亡。癌症衍生的炎症介质建立的另一种早期联系发生在骨髓中,造血祖细胞的紊乱会导致髓系和淋巴系异常细胞的产生,并造成全身远端病变。此外,循环系统中还会发生其他早期变化,包括促凝因子的释放、血小板的激活、炎症细胞和血凝块的形成,这些都与癌症进展有关。Hiratsuka等人和Kaplan等人的开创性首次证明了癌症介导的远处调节的存在,这种调节可以增强转移性生长。了解并干预肿瘤的这种复杂的全身启动过程,有助于指导我们寻求降低癌症进展和死亡风险的新思路。
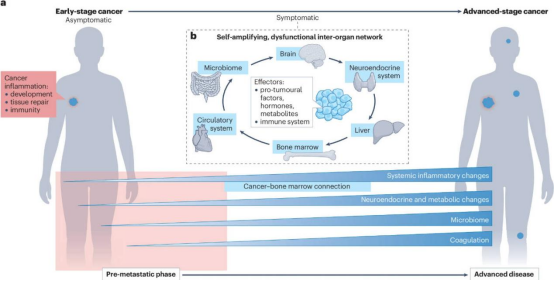
图 1 癌症与全身的关系
转移前生态位(PMN):转移的"先遣部队"
癌细胞的生长需要生成一个特制的局部组织环境,PMN是转移生态位的"预演",通过基质激活、免疫抑制和细胞外基质(ECM)重塑三大特征,为转移细胞提供生存土壤。当癌细胞通过循环离开原发性肿瘤时,它们有可能沿着连接肿瘤和生物体其他部分的循环网络在一系列器官中播种,但它们归巢和生长的机会很大程度上取决于它们找到的组织环境。某些不适宜生长的组织,例如骨骼肌、肠道、脾脏和肾脏,尽管血流量大,却很少发生转移性生长,一种推测是,这些器官可能不太容易形成PMN。而肺、肝、骨和脑作为易转移器官,近年来被广泛研究。
PMN的三大核心机制为ECM重塑、免疫抑制和血管通透性增加。其中ECM 构建了三维基础设施,为各个器官提供生化、物理和机械特性。此外,相关基质细胞蛋白(如肌腱蛋白C、血小板反应蛋白1、骨膜蛋白和骨桥蛋白)的存在会影响ECM的理化特性。原发性肿瘤衍生因子直接启动与远处器官驻留细胞的相互作用,导致ECM重构,并引发免疫细胞募集。同时,免疫浸润物可以影响ECM的组成。在胰腺肿瘤的肝转移中,分泌颗粒蛋白的炎症单核细胞的募集激活了驻留肝星状细胞,使其释放骨膜蛋白,并形成促纤维化的微环境。
除了ECM介导的免疫细胞募集变化之外,肿瘤衍生因子还可以直接或通过激活环境中的其他细胞来调节免疫环境。癌症衍生因子,例如血管内皮生长因子(VEGF),可以直接激活位于远处的细胞(例如内皮细胞),以驱动血管通透性过高,从而导致癌细胞募集。活化的内皮细胞还可以释放前列腺素E2(PGE2),促进炎性微环境的形成。此外,VEGF不仅作用于内皮细胞,还作用于募集的髓系细胞。同样,ECM调节剂,例如金属蛋白酶1组织抑制剂(TIMP1),会影响肝脏中的中性粒细胞募集并促进转移。来自骨髓的癌症动员先天细胞的一个关键特征是免疫抑制,包括单核细胞或巨噬细胞和中性粒细胞的动员,它们是负责抑制针对癌细胞的T细胞和NK细胞反应的主要细胞。值得注意的是,ECM变化与髓系细胞之间的相互作用是双向的,并且通常涉及成纤维细胞活化。
此外,基质细胞的活化是转移细胞周围组织微环境的早期特征,并且它可以调节转移细胞的生长潜力。据报道,在远处器官的转移前调节期间,癌症衍生的因子可直接激活驻留成纤维细胞并诱导促炎介质的释放。基质细胞是ECM分子的主要沉积者,它们的许多病理生理活动反过来又受机械传感控制。因此,PMN中的基质活化也对ECM成分有直接影响。例如,据报道,远处血管周围微环境周围的基质周细胞会产生富含纤连蛋白的环境。此外,黑色素瘤衍生的因子可诱导肺成纤维细胞中的p38α激酶活化,导致ECM重塑和趋化因子释放,从而驱动中性粒细胞浸润。
原发性肿瘤的直接效应分子
肿瘤衍生介质(TDM)在PMN的协调中至关重要,并可增加转移成功的机会。PMN诱导介质包括外泌体衍生的蛋白质和其他分子信号,也包括可溶性分子,如细胞因子、趋化因子、生长因子、游离RNA和代谢物。事实上,游离RNA也被证明会被NK细胞吸收,从而可能增强其抗转移活性。有趣的是,肿瘤微环境(TME)内的非肿瘤细胞也可能有助于PMN的形成。
在PMN中,成纤维细胞依赖的基质重塑较为常见,肺成纤维细胞中p38α的激活是一种保守机制。转移性黑色素瘤患者表现出高基质p38α磷酸化,这与疾病进展和较差的生存率相关。在临床前模型中,小鼠肺成纤维细胞在体内暴露于转移性黑色素瘤TDM时表现出p38α磷酸化,但在暴露于转移性较低的对应物的TDM时则不会表现出来。由于p38α磷酸化,I型干扰素受体1(IFNR1)失活,这也被观察到是胰腺和乳腺癌TDM作用的结果。研究表明,抑制IFNR1可导致纤连蛋白沉积增加、基质重塑因子表达增加,以及趋化因子依赖性中性粒细胞募集增加。
上皮细胞,像肝细胞和肺泡上皮细胞,在PMN形成中也有着重要作用。近期在胰腺导管腺癌(PDAC)和肺腺癌方面的研究揭示了肝细胞在肝脏PMN形成中的关键作用。肺腺癌衍生的EVs诱导肝细胞HGF表达,促进癌细胞的侵袭、迁移和增殖。PDAC小鼠体内基质细胞衍生的IL-6诱导STAT3依赖性的肝细胞反应,并释放血清淀粉样蛋白A1和A2(统称为SAA),这反过来导致小鼠转移性PDAC模型中循环SAA水平升高,这在PDAC和肝转移患者中也有类似的表现。SAA促进免疫抑制性髓系细胞的浸润,并激活HStCs,从而引发肝脏PMN炎症和纤维化。此外,肺泡上皮细胞主要通过Toll样受体(Toll-like receptor,TLR)信号传导对损伤和感染作出反应,以激发先天免疫反应,这种机制由肿瘤来源的EVs利用RNA负载,激活肺泡Ⅱ型(alveolar type Ⅱ,AT2)细胞中的TLR3信号传导,以驱动TLR3依赖的趋化因子产生和中性粒细胞募集。同样,装载miR-200b-3p的乳腺癌EVs通过直接靶向PTEN61诱导AT2细胞中趋化因子配体2(CCL2)的产生。
血管内皮细胞通过上调血管生成素2、MMP3和MMP10,同时抑制TRAIL表达,促进促转移微环境的形成。远端微血管中血管生成增多是中性粒细胞的常见特征。肿瘤诱导的中性粒细胞ECM改变也会影响内皮细胞。乳腺癌细胞诱导转移前肺组织中肌腱蛋白C的上调,激活血管周围巨噬细胞上的TLR4并改变肺内皮细胞,而肺内皮细胞则通过分泌各种支持干细胞、自我更新和细胞存活的因子来作出反应,从而促进转移性生长。同样,在骨中性粒细胞中,内皮细胞会产生支持干细胞的血管微环境。在此,肿瘤诱导的内皮细胞选择素表达促进了癌细胞到达微环境后发生间质-上皮转化和WNT信号传导。全身微血管系统可能是协调中性粒细胞的因子来源之一。
组织驻留巨噬细胞起源于胚胎,具有器官特异性功能,包括维持组织稳态和免疫监视,这些细胞在中性粒细胞的形成中发挥着重要作用。库普弗细胞是肝脏中的主要巨噬细胞群。多项研究表明,各种癌症类型通过转移不同的外泌体货物来驱动库普弗细胞的炎症表型。CRC衍生的外泌体通过其货物miR-21激活库普弗细胞中的TLR信号传导,导致IL-6上调和促炎微环境。此外,含有血管生成素相关蛋白1(ANGPTL1)的外泌体支持库普弗细胞的炎症激活,这反过来又通过MMP9释放导致内皮完整性不稳定,支持转移性定植。库普弗细胞通过调节PMN中的适应性免疫发挥促转移功能。肺泡巨噬细胞(AM)是驻留在肺泡和气道中的长寿细胞。在肝细胞癌肺转移模型中,AM以CCL2依赖的方式在转移性肺组织中富集。虽然CCL2驱动的肺部炎症是肺中性粒细胞的常见特征,但这些AM驱动的效应是否先于转移性定植仍不清楚。与其他组织驻留巨噬细胞群相比AM在PMN的启动中可能发挥的作用有限。它们位于肺泡腔腔面,这可能使它们不利于接触肿瘤衍生因子。
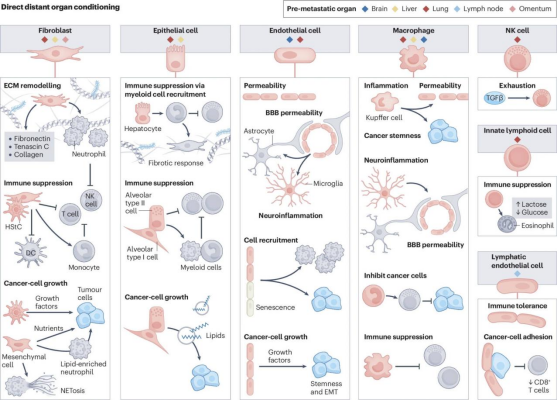
图 2 原发性肿瘤的直接远距离调节
系统性扰动的间接效应器:骨髓与全身免疫重塑
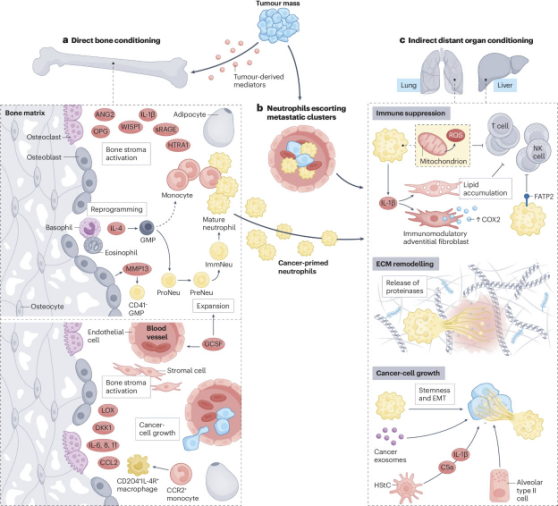
系统性扰动中的间接效应物也有助于PMN的形成。血小板因具有促转移功能而受到关注。当广泛性凝血导致器官功能障碍和发病时,经常会出现全身性血小板活化和血栓形成增多。血小板通过多种机制发挥其促转移功能,从屏蔽循环肿瘤细胞到促血管生成和免疫调节过程。它们是多种PMN形成的重要介质。凝血由TF启动,TF触发蛋白水解级联反应,导致血小板活化、聚集和血栓形成。肿瘤衍生的TF以及随之而来的血小板活化和微血栓形成促进髓样细胞向肺部募集,从而导致PMN形成。乳腺肿瘤衍生的EV诱导全身血小板活化和PMN内的局部活化,从而诱导NET和转移。此外,癌症激活的血小板促进肺内皮细胞活化和黑色素瘤细胞粘附于肺内皮细胞。除了肺癌之外,癌症引发的血小板还介导肿瘤-骨通讯和骨中性粒细胞的形成。原发性前列腺癌诱导血小板释放血小板凝血酶敏感蛋白1(TSP1)和转化生长因子β(TGFβ),从而抑制破骨细胞分化,促进髓系细胞募集和随后的骨转移。有趣的是,在黑色素瘤中,血小板通过阻隔肿瘤衍生的TGFβ和MMP1来促进骨中性粒细胞的形成,而TGFβ和MMP1则被运送到骨骼中,以支持骨微环境的重塑。
中性粒细胞作为主要的骨髓来源细胞,可被癌症激活,激活后的中性粒细胞能直接支持癌细胞扩散,并使远端器官为转移做好准备。中性粒细胞会根据局部组织环境改变其表型和功能,并在暴露于TME时发生显著改变。癌症背景下的骨髓环境受到严重干扰:粒细胞生成的激活会导致早期祖细胞扩增,而中性粒细胞的产生会导致进入循环的异质性引发中性粒细胞增多,包括成熟、未成熟和早期中性粒细胞祖细胞。有趣的是,据报道,在某些癌症情况下,中性粒细胞还会由位于骨髓外的祖细胞额外产生,这一过程称为髓外粒细胞生成,这可能有助于其发挥免疫抑制功能。诱导中性粒细胞紊乱的TDM已被广泛报道。驱动中性粒细胞生成增加的一个关键因素是粒细胞集落刺激因子(GCSF),它是紧急粒细胞生成的主要诱因,可诱导癌细胞和TME的大量产生。
骨组织也会经历肿瘤诱导的变化,从而促进肿瘤转移。正如乳腺癌的报道所示,这些变化可以通过CCR2单核细胞的募集和滞留来实现,这些单核细胞会分化为CD204 IL-4R巨噬细胞,从而积极支持骨转移瘤的生长。然而介导改变的骨髓生成的骨骼驻留细胞,例如破骨细胞和其他MSCs,也代表参与骨PMN形成的细胞成分。此外,破骨细胞前体的募集可以通过产生富含R-spondin-2、富含RANKL和富含亮氨酸重复的G蛋白偶联受体4(LGR4)依赖的WNT抑制剂DKK1来支持转移性乳腺癌细胞形成骨PMN。GCSF是骨髓中粒细胞生成的关键介质之一,负责癌症依赖性中性粒细胞动员,最近有报道称,它在直接重塑骨血管内皮方面发挥着不依赖造血细胞的作用,这表明单一因素有可能在诱导全身动员的癌症引发的中性粒细胞的同时,驱动局部骨PMN形成。重要的是,乳腺癌会释放各种因子(LOX、CCL2、IL-6、DKK1、IL-11和IL-8),激活破骨细胞生成和骨吸收,诱导促肿瘤发生的骨环境。
图 3 骨髓调节在局部和远端转移前微环境形成过程中的作用
器官间通讯与全身代谢紊乱
器官间通讯是癌症诱导的系统性预处理的重要方面。系统性扰动会引发一系列影响多个器官的事件,导致整体身体生理发生改变,癌症患者身体组成、代谢和免疫系统的变化就是很好的证明。肿瘤直接通过肿瘤衍生介质(TDM)(以及相关的生长因子、细胞因子、趋化因子和细胞外囊泡)影响多个器官和系统,或通过扰乱昼夜节律和肠道菌群失调间接影响多个器官和系统。这些相互作用导致远端器官预处理,单独来看,预处理最初会扰乱特定器官的功能。然而,这些生理系统主要通过系统性代谢和免疫系统的调节相互关联,这将对多个器官系统产生影响。这种广泛的生理紊乱最初可能在早期表现为促转移性预处理,并可能最终发展为退行性综合征。
细胞外囊泡(EVs)是维持代谢稳态的器官间通讯的关键部分。在癌症领域,递送miR-122的EVs会影响肌肉蛋白质稳态,导致肌肉失调,还会靶向胰腺代谢稳态,引起空腹高血糖症。肿瘤衍生的EVs中的脂肪酸会诱导肝脏库普弗细胞表达TNF,抑制肝细胞脂肪酸代谢,产生促炎性脂肪肝微环境,还会增强化疗副作用。乳腺癌衍生的EVs中的miR-204-5p可靶向白色脂肪组织,促进脂肪分解和褐变。肠道微生物群对机体稳态影响深远,菌群失调可导致多种疾病,癌症等病理状况也会引起菌群失调。微生物群与免疫系统联系紧密,其组成改变会影响宿主代谢、能量利用和肌肉功能。目前,已有通过微调患者微生物组成来提高癌症治疗效果的想法。生物钟紊乱与癌症相关,不同分子钟成分的紊乱会影响肿瘤形成。癌症与生物钟相互作用,例如肺腺癌会抑制肝脏节律性胰岛素信号传导,影响葡萄糖敏感性和脂质代谢。癌细胞的转移行为也受褪黑激素等昼夜节律激素的深刻影响。
癌症非依赖性预处理的影响
癌症非依赖性预处理体现了癌症与其宿主之间的双向相互作用。非癌症相关的系统性扰动,如应激、衰老、饮食和生活方式等,能够模拟癌症诱导的促转移预处理的特征。越来越多研究表明,癌症依赖性预处理会劫持并汇集多种疾病中的系统性改变机制。如中性粒细胞可在组织损伤、应激、肥胖和吸烟相关炎症性疾病中获得促肿瘤功能,参与肝脏中性粒细胞形成的介质SAA也会加剧多种肝脏疾病的炎症。
应激对癌症转移影响显著。慢性压力会导致骨髓紊乱,激活成骨细胞并诱导髓系细胞动员。慢性不可预测性轻度压力(CUMS)提高全身糖皮质激素水平,增加肺部对免疫抑制髓系细胞的募集,使播散性癌细胞更易在肺部定植。应激激素还会诱导释放促转移性中性粒细胞,增加转移性细胞从休眠状态重新激活的机会。应激诱导的糖皮质激素刺激表达糖皮质激素受体的中性粒细胞,改变其昼夜节律,增强释放NET的能力。
衰老也能诱导组织变化,促进转移性生长。衰老相关的全身性炎症影响中性粒细胞,老年小鼠的中性粒细胞跨内皮迁移模式逆转,在肺部血管内皮聚集,增加血管渗漏,可能提高循环肿瘤细胞的外渗几率。骨髓中,衰老会诱导稳态髓系偏向的造血。
饮食和生活方式同样影响转移进展。高脂饮食会诱导肺部类似癌症诱导的变化,增加血管通透性;富含辣椒素的饮食会破坏肠道屏障,影响肝脏胆汁酸代谢;饮食限制则可扰乱骨髓环境,优化免疫记忆。吸烟中的尼古丁和脂多糖可诱导肺中性粒细胞,增加癌细胞转移定植潜力;运动有益,轻度冷暴露可激活棕色脂肪组织,抑制原发性肿瘤生长。
此外,血统和性别也对癌症的转移产生影响。男性和女性在免疫反应、癌症发病率和结果等方面存在差异。治疗也会对癌症转移产生影响。全身性抗癌疗法不仅改变肿瘤微环境,还会诱导远处预处理,促进转移进展。化疗可通过多种方式增强转移,如增加癌症衍生EV的水平、驱动NETosis、激活CAFs中的补体信号传导等。肺部接受放射线照射会启动该器官,增加癌细胞转移潜力。
结论与展望
目前,针对癌症转移的治疗方法存在一定局限性,其效果往往取决于特定癌症对特定介质的依赖程度。若想实现更有效的治疗,需要聚焦不同肿瘤类型和转移部位中共同的关键激活过程。一些前沿的实验方法已初显成效,如低剂量表观遗传调节药物联合疗法、改造髓系细胞以及使用融合蛋白等。深入探究癌症依赖性和非依赖性条件作用,有望为癌症患者搭建起靶向治疗和行为干预的新平台。
述评
这篇深入探讨了癌症如何通过系统性预处理远端器官,为转移细胞创造有利的生态位,从而促进癌症转移。文章从肿瘤细胞与宿主组织的早期相互作用入手,详细阐述了原发肿瘤如何通过多种机制和介质影响全身器官,为转移细胞的生存和增殖创造条件。这一过程涉及复杂的细胞间信号传导、细胞外基质重塑以及免疫系统的调节,揭示了癌症转移的多维性和系统性。
文章强调了预转移生态位(PMN)的重要性,这是转移细胞在远端器官中建立的早期生态位,其特征包括免疫抑制、细胞外基质(ECM)重塑和基质细胞激活等。这些特征不仅为转移细胞提供了生存的微环境,还通过系统性预处理影响全身的生理状态。文章通过大量的实验数据和临床案例,展示了肿瘤细胞如何通过释放可溶性因子和外泌体(EVs)直接或间接影响远端器官,诱导PMN的形成。这些因子可以激活远端器官中的驻留细胞,导致ECM重塑,增加血管通透性,促进肿瘤细胞的招募,并抑制免疫反应,从而为转移细胞的定植创造条件。文章还讨论了非癌性因素如何通过类似机制诱导PMN的形成,例如慢性压力、肥胖、吸烟等。这些因素可以激活免疫系统和炎症反应,为肿瘤转移创造有利条件。这一发现不仅扩展了我们对癌症转移机制的理解,还为开发新的治疗策略提供了理论基础。通过干扰肿瘤细胞分泌的介质、靶向ECM重塑、调节免疫反应等,可能有助于减少癌症转移的风险。
此外,文章还强调了肿瘤与宿主之间的多器官相互作用,这种相互作用不仅影响转移的发生,还可能影响全身的生理状态,如代谢和免疫系统。这一观点为癌症治疗提供了新的视角,提示我们应从系统层面考虑癌症的治疗策略,而不仅仅是针对肿瘤细胞本身。总体而言,这篇文章为我们提供了一个全面而深入的视角来理解癌症转移的复杂机制,强调了系统性预处理在癌症转移中的关键作用,并为未来的癌症治疗研究提供了新的方向和思路。通过深入研究PMN的形成机制,我们有望开发出更有效的癌症治疗策略,从而改善癌症患者的预后。
参考文献
Rabas, N., Ferreira, R.M.M., Di Blasio, S. et al. Nature Reviews Cancer. 10 October 2024. DOI: 10.1038/s41568-024-00752-0
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)