首页 > 医疗资讯/ 正文
黑色素瘤作为最具侵袭性的皮肤癌,传统手术与化疗常面临疗效有限、毒副作用大等问题。而近日,一项发表于《Biomaterials》的研究,为黑色素瘤治疗带来了突破性进展——湖南大学翁群红团队和北京交通大学王熙团队等合作完成的具有皮肤渗透的铁单原子氮化硼(FeSA-BN)纳米酶,既能通过无创的透皮方式高效抑制肿瘤,又能激活免疫系统抑制远端病灶,为浅表性癌症治疗提供了全新思路和方案。

黑色素瘤作为最具侵袭性的皮肤癌,多起源于皮肤表层,但其治疗长期受制于传统手段的局限性:莫氏手术对转移性病灶疗效骤降,化疗药物缺乏肿瘤特异性易引发全身毒性。因此,发展新型的局部用药和治疗方法具有重要的临床意义。在临床上,已经有外用药剂(如咪喹莫特乳膏)在使用,但又常发生皮肤红肿、溃疡等严重局部副作用。
作为一类新兴的纳米药物,纳米酶能利用肿瘤微环境(TME)中的过氧化氢(H₂O₂)产生活性氧杀伤肿瘤,但多数纳米酶需高浓度H₂O₂(mM级)才能激活,而TME中内源性H₂O₂浓度仅为μM级,且纳米酶尺寸过大难以穿透皮肤角质层,其双重瓶颈严重限制其在纳米药物领域的应用。
对此,研究团队设计了富含硼空位的BN纳米载体来负载铁单原子,通过Fe-N₃配位构建了FeSA-BN纳米酶,同时解决了纳米酶“透皮难”与“H₂O₂利用率低”这两大核心问题。
通过固相反应将Fe原子负载到富含硼空位的BN载体上,FeSA-BN形成独特的Fe-N₃配位结构,具有7.5 nm的超小尺寸,如图1所示。X射线吸收精细结构与密度泛函理论计算证实了该结构使Fe原子带部分正电荷,能高效吸附并活化H₂O₂,即使在TME的低浓度H₂O₂环境中,也能快速断裂O-O键生成羟基自由基。其米氏常数Km=0.58mM,对H₂O₂的亲和力更强,催化效率提升显著。同时,FeSA-BN纳米酶在细胞中也能有效催化H2O2生成活性氧,使肿瘤细胞坏死。
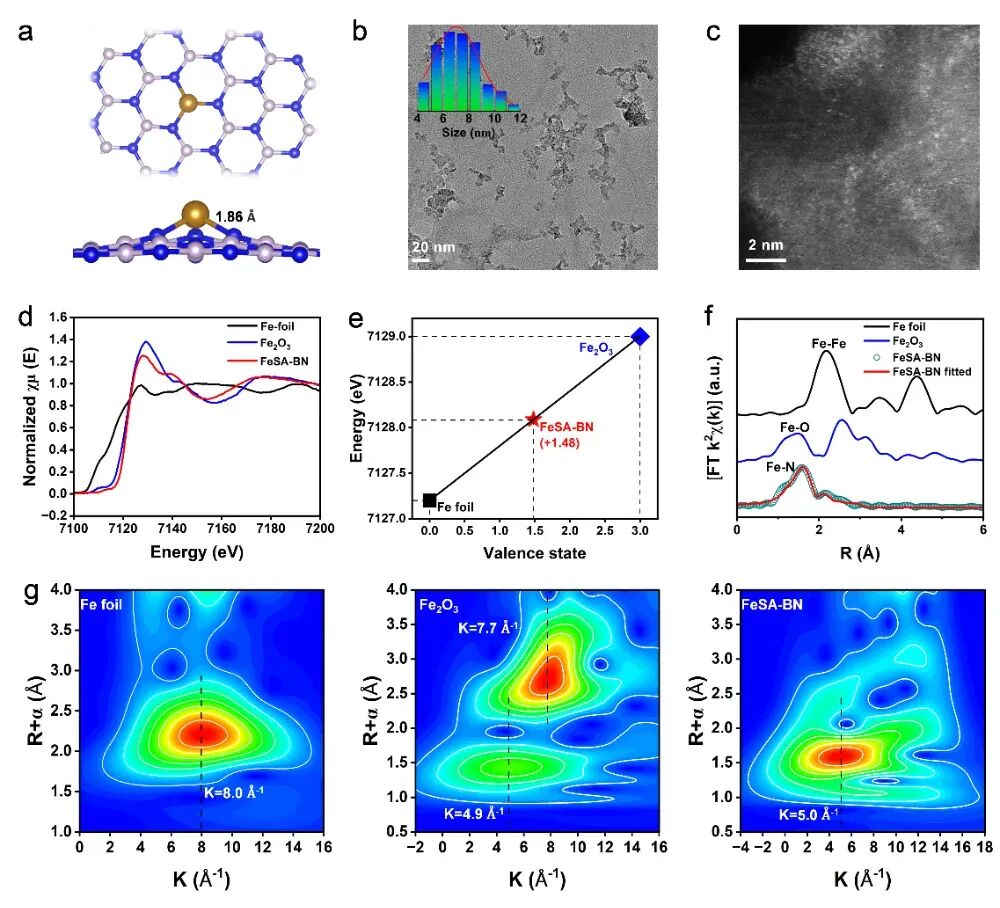
图1 FeSA-BN纳米酶的结构表征
FeSA-BN纳米酶经皮给药组在治疗14天后实现了93%的黑色素瘤生长抑制率。值得注意的是,经皮给药组和瘤内注射组的肿瘤体积没有显著性差异,表明FeSA-BN纳米酶通过经皮给药的方式具有很高的疗效。药代动力学表明,FeSA-BN能有效地渗透到皮下肿瘤组织和肌肉,在6 h达到药物浓度峰值(图2)。
将FeSA-BN与聚乙烯亚胺、聚谷氨酸与鱼精蛋白一起配制透皮递送制剂。透皮效率达38%,其中78%通过角质层细胞间隙与细胞膜,22%通过毛囊辅助渗透。BN纳米颗粒的透皮效率随着尺寸的增大而显著下降。FeSA-BN纳米酶用药后皮肤仅出现轻微毛囊减少,停药5天后完全恢复,无红肿、溃疡等副作用。
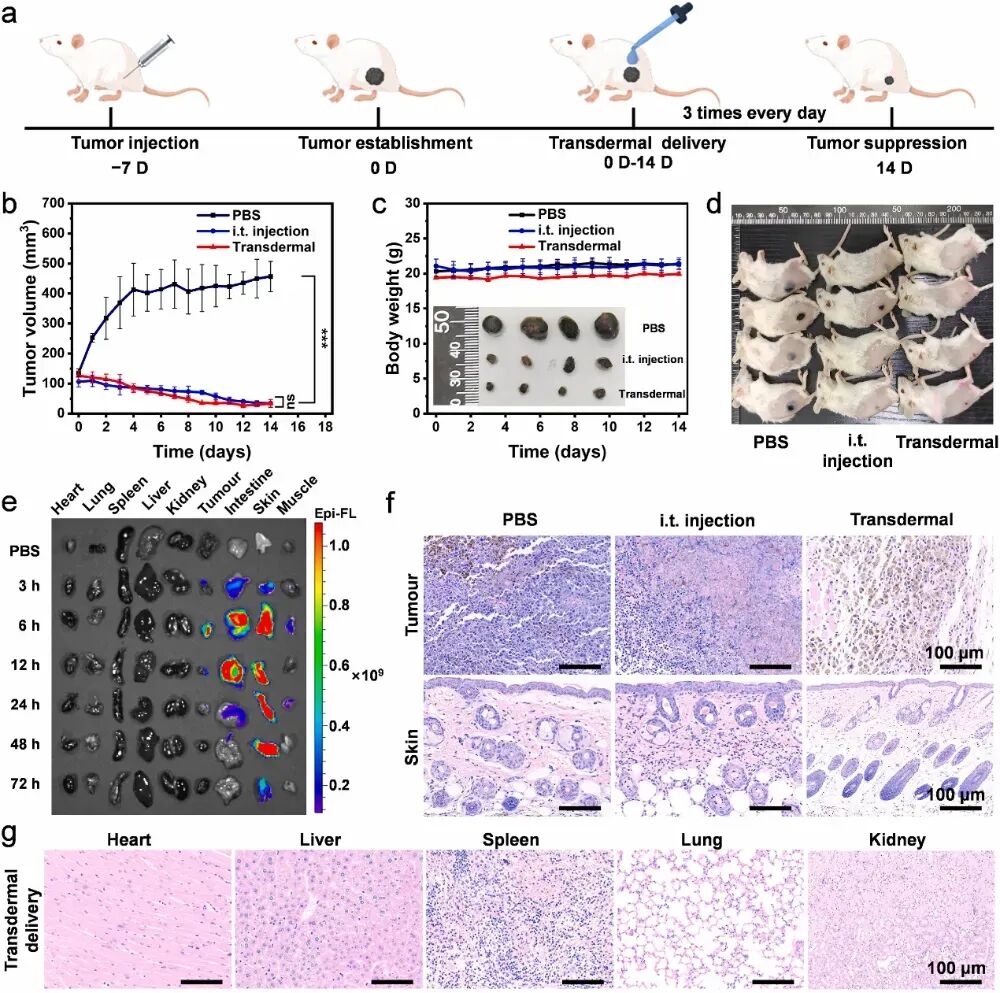
图2FeSA-BN纳米酶透皮治疗黑色素瘤的体内评价
FeSA-BN不仅能直接产生羟基自由基杀伤肿瘤细胞,还能触发免疫响应抑制远端病灶,如图3所示。这在双侧黑色素瘤小鼠模型中得到全面证实。肿瘤细胞坏死时释放钙网蛋白(CRT)、高迁移率族蛋白B1(HMGB1)等“危险信号”,招募树突状细胞(DCs)吞噬肿瘤抗原;DCs激活后促进淋巴结与脾脏中CD4⁺、CD8⁺T细胞增殖,这些活化的T细胞可迁移至未给药的远端肿瘤,实现全身的抗肿瘤免疫响应。
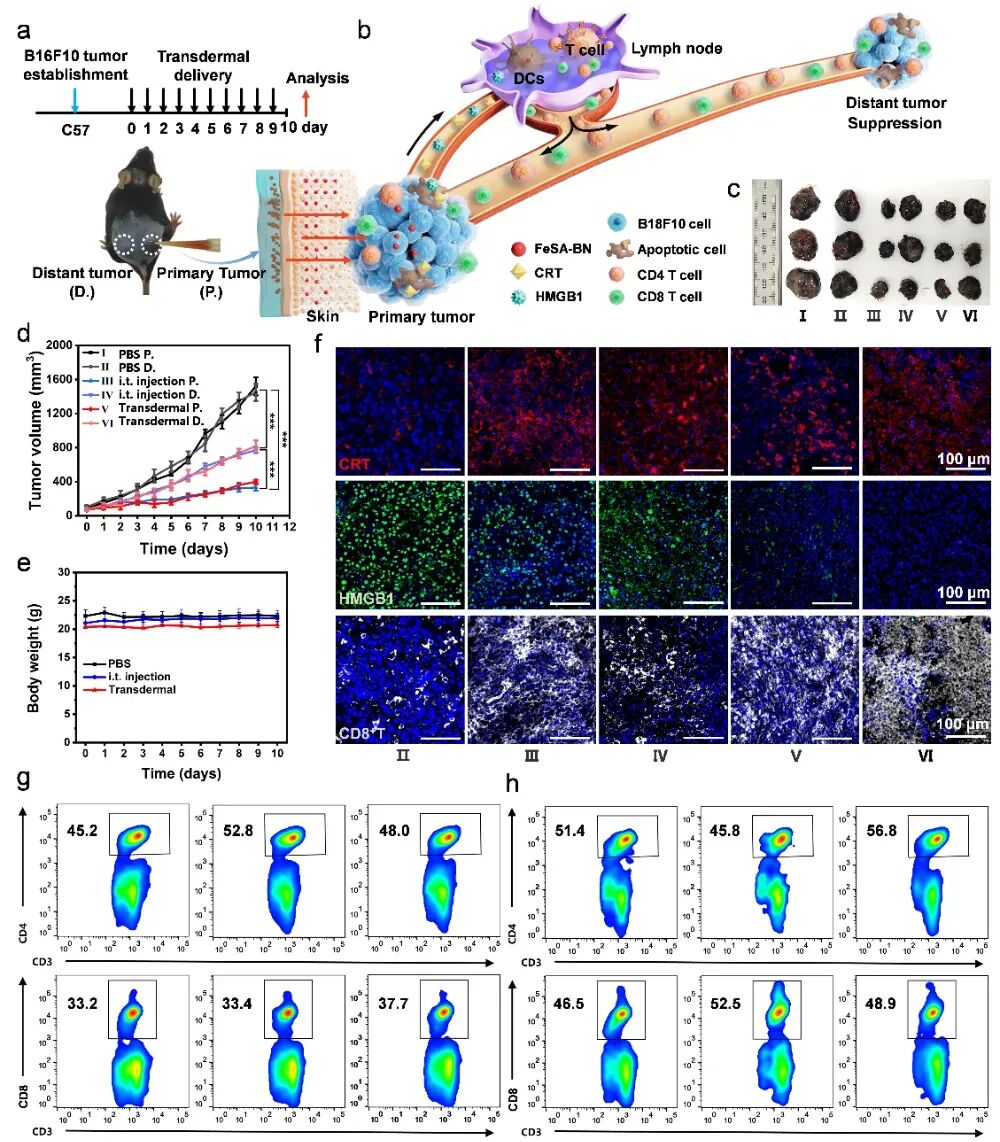
图3FeSA-BN纳米酶治疗远端黑色素瘤的效果及免疫学分析
【文章结论与展望】
综上所述,本研究通过“结构创新+剂型优化”,成功开发出了一种FeSA-BN纳米酶透皮制剂。FeSA-BN纳米酶的Fe-N₃配位结构解决了肿瘤内源性低浓度H₂O₂的高效催化难题;7.5nm的药物尺寸与表面包覆突破了皮肤屏障,实现了真正意义上的“无创透皮给药”;药物并兼具化疗动力学治疗(CDT)与免疫治疗双重功效,既控制原发肿瘤,又抑制远端转移。该成果不仅为黑色素瘤治疗提供了新策略,还为其他浅表性疾病(如皮肤鳞癌、基底细胞癌)的治疗开辟了“高效、低毒”的透皮治疗新方法。
湖南大学翁群红教授、北京交通大学王熙教授为该论文的共同通讯作者,湖南大学王聪伶博士研究生为第一作者。本研究得到国家自然科学基金(52272148)、湖南省自然科学基金(2025JJ90210)等项目资助。
原文链接:
https://www.sciencedirect.com/unsupported_browser
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)