首页 > 医疗资讯/ 正文
脊髓性肌萎缩(SMA)是一种由于SMN1基因缺陷导致存活运动神经元蛋白(SMN)缺失的罕见神经肌肉疾病。SMA分为多种类型,其中1型(SMA1)发病最早,通常在出生后6个月内出现,表现为严重的肌无力、球部功能障碍和呼吸衰竭,若无干预常于2岁前死亡。 自2016年起,三种主要疾病修饰治疗(DMTs)上市:Nusinersen(一种反义寡核苷酸药物)、Onasemnogene Abeparvovec(基因替代疗法)以及Risdiplam(小分子剪接调节剂)。
Nusinersen通过改变SMN2基因剪接提高功能性SMN蛋白表达,基因替代疗法则通过腺相关病毒(AAV9)载体一次性给药,递送SMN1基因补偿缺陷。两者均已在随机对照试验中证实可显著延长SMA1患儿生存并改善运动功能,但不同药物对呼吸、球部功能影响仍存争议。 随着新生儿SMA筛查普及,早期治疗成为趋势,但不同药物如何选择仍缺乏直接对比证据。

本研究基于法国国家SMA注册系统,纳入自2016年9月至2024年7月期间确诊为SMA1的患儿。纳入标准要求患者于诊断后6个月内开始首选治疗(Nusinersen或基因治疗),且随访≥24个月,并对年龄、初治时CHOP-INTEND运动评分、呼吸和营养状况进行1:1严格匹配,最终筛选出12对(共24例)高度匹配病例。 主要观察指标包括:①呼吸及营养支持需求(如是否需无创/有创通气、持续营养支持);②运动功能改善(CHOP-INTEND评分变化及运动里程碑达成,如独坐等);③不满意临床反应(UCR,定义为死亡、因疗效不佳换药/加药、持续营养支持、未能独坐等复合事件)。 统计分析使用线性混合模型、Kaplan-Meier生存分析及条件Logistic回归,强调效应量与置信区间而非单纯P值。
结果显示,在1366例患者中,309例确诊SMA1,最终12对(24例)符合严格入组和匹配标准。两组基线特征(性别、年龄、疾病亚型、初治时运动评分、呼吸/营养状况)高度一致。
随访期间,治疗首年内,基因治疗组1人(8%)与Nusinersen组2人(17%)因呼吸衰竭死亡,均为SMA1a亚型,基线运动功能低,无药物相关严重不良。2年后,基因治疗组仅1人(9%)需营养支持,Nusinersen组则有5人(50%)需营养支持;基因治疗组5人(45%)需夜间通气,Nusinersen组为8人(80%)。
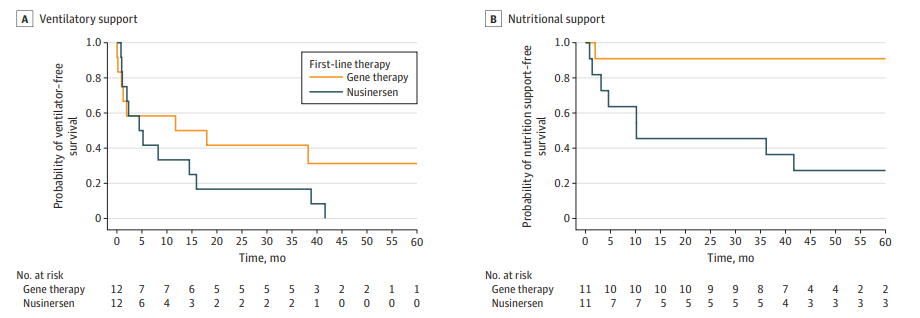
Kaplan-Meier 曲线:展示治疗开始后启动通气支持和营养支持的时间
运动功能方面,两组CHOP-INTEND评分提升相近,所有存活者均达成临床显著改善,且最终均能独坐(基因治疗组100%,Nusinersen组90%)。综合不满意临床反应(UCR)发生率,Nusinersen组8人(67%)显著高于基因治疗组3人(25%)。 值得注意的是,Nusinersen组有50%患者最终需换用Risdiplam或因注射困难改用其他方案,提示部分患儿疗效维持存在挑战。
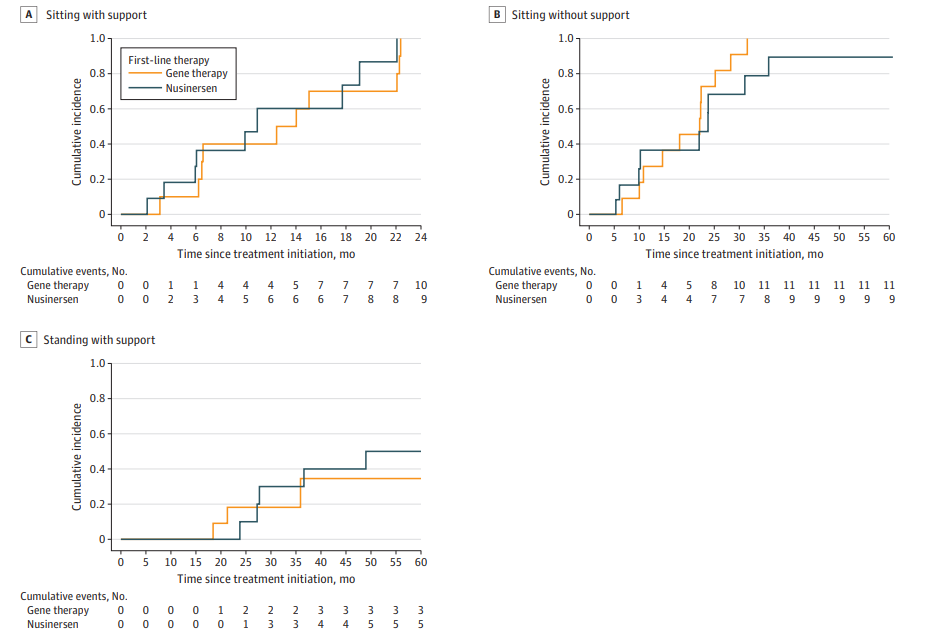
Kaplan-Meier 曲线:展示实现辅助坐立、辅助站立及独立坐立的时间
综上,基因治疗在SMA1患儿中的呼吸和营养支持需求显著低于Nusinersen,且综合不满意临床反应发生率更低,运动功能改善相近。结果提示基因治疗可作为SMA1首选方案,尤其适合高风险球部及呼吸障碍患者。 两组死亡病例均为极早期重症,反映早期干预尤为关键。值得注意,本研究样本量有限,部分结论需更大队列证实。
原始出处
Ropars J, Cances C, Garcia-Uzquiano R, et al. Comparative Clinical Outcomes of Nusinersen and Gene Therapy in Spinal Muscular Atrophy Type 1. JAMA Network Open. 2025; Published online Oct 8, 2025. doi:10.1001/jamanetworkopen.2025.36348
本文相关学术信息由梅斯医学提供,基于自主研发的人工智能学术机器人完成翻译后邀请临床医师进行再次校对。如有内容上的不准确请留言给我们。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)