首页 > 医疗资讯/ 正文
脓毒症是一种与感染相关的疾病,主要表现为多器官功能障碍,属于危及生命的状况,常伴随严重并发症,而肝损伤是其最常见的严重并发症之一[1]。研究表明,合并肝功能障碍或肝衰竭的败血症患者死亡率高达54%-68%,这一比例显著高于呼吸系统功能障碍或衰竭患者的死亡率[2]。基于此,最大限度减少肝损伤并促进肝功能恢复,对于降低败血症患者的死亡率至关重要。
近期,福建医科大学孟超肝胆医院高海兵教授以“脓毒症相关性肝损伤(SILI)诊治进展”为题,系统梳理了SILI的分型与临床诊断标准、发病机制、危险因素及治疗策略等方面的最新进展。肝胆相照平台特将精彩内容整理成文,供临床医生参考。
一 SILI的类型及临床诊断标准
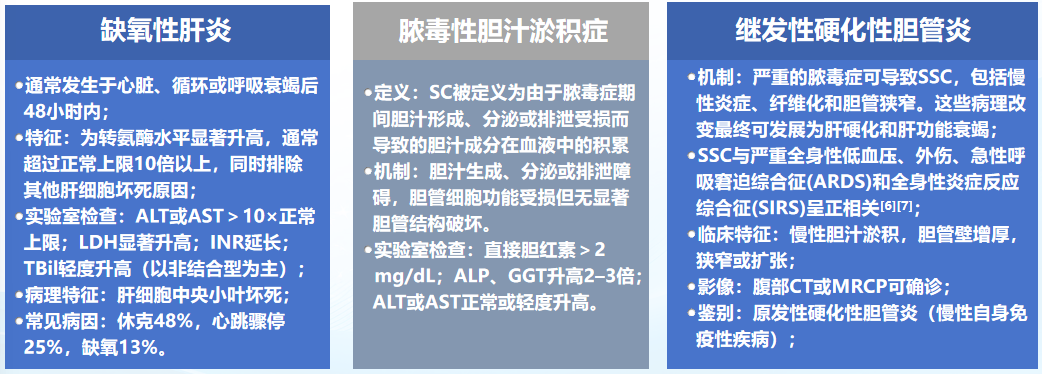
在临床实践中,脓毒症可能引发多种肝损伤类型,包括缺氧性肝炎、脓毒性胆汁淤积症和继发性硬化性胆管炎[3-4]。这些与SILI相关的不同临床特征使诊断过程复杂化,要实现脓毒症患者肝损伤的早期精准诊断,需深入理解各类肝损伤的具体临床特征。
二 SILI的发病机制
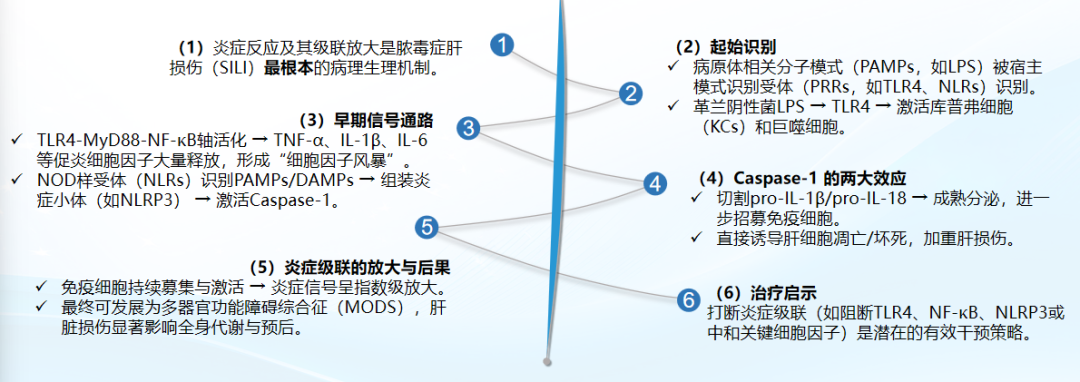
SILI的发病机制较为复杂,涉及炎症及其级联放大、氧化应激、线粒体功能障碍、焦亡、自噬机制、表观遗传调控等。
1)炎症及其级联放大
炎症反应及其级联放大是SILI最根本的病理生理机制,打断炎症级联(如阻断TLR4、NF-κB、NLRP3或中和关键细胞因子)是潜在的有效干预策略。
2)氧化应激
脓毒症会导致活性氧(ROS)的过度生成,而ROS会通过多种途径加剧炎症级联反应,引发内皮功能受损、微血栓形成、肝窦阻塞,进而导致肝灌注下降、肝损伤加重[5-6]。
3)线粒体功能障碍
线粒体功能障碍是脓毒症期间肝脏能量代谢紊乱和器官损伤的核心驱动因素。脓毒症时融合蛋白OPA1/MFN2下调,分裂蛋白DRP1上调,可导致线粒体过度分裂、碎片化,使其功能进一步受损、ROS增加,恢复线粒体融合(增强OPA1/MFN2)或抑制过度分裂(抑制DRP1)被学界视为缓解SILI的潜在策略[7-8]。
4)焦亡
焦亡是一种程序性细胞死亡形式,在SILI的发病机制中起到关键作用。免疫细胞的激活会启动焦亡通路,从而促进炎症介质的释放。这些炎症介质反过来会加剧炎症反应,进一步导致肝细胞损伤[9]。
5)自噬机制
在正常情况下,线粒体自噬会选择性清除受损线粒体,防止ROS积蓄,保障能量产生;在SILI中,自噬体虽然增多,但自噬溶酶体出现减少,自噬流不完整会导致损伤加剧,从而引发受损线粒体积聚、ROS过量、细胞死亡增加。另外,过度自噬亦可导致必需细胞成分被降解,加重能量危机和损伤[10]。
6)表观遗传调控等
脓毒症过程中miR-133a、miR-126-5p、miR-155等miRNA的上调会放大氧化应激、细胞凋亡、肝损伤;NEAT1、MALAT1、CRNDE、CASC7、SNHG11等lncRNA通过竞争miRNA或结合蛋白,可促进炎症、焦亡、铁死亡[11]。miRNA/lncRNA/表观修饰分子既可作为早期诊断和预后标志物,也是潜在的治疗靶点。
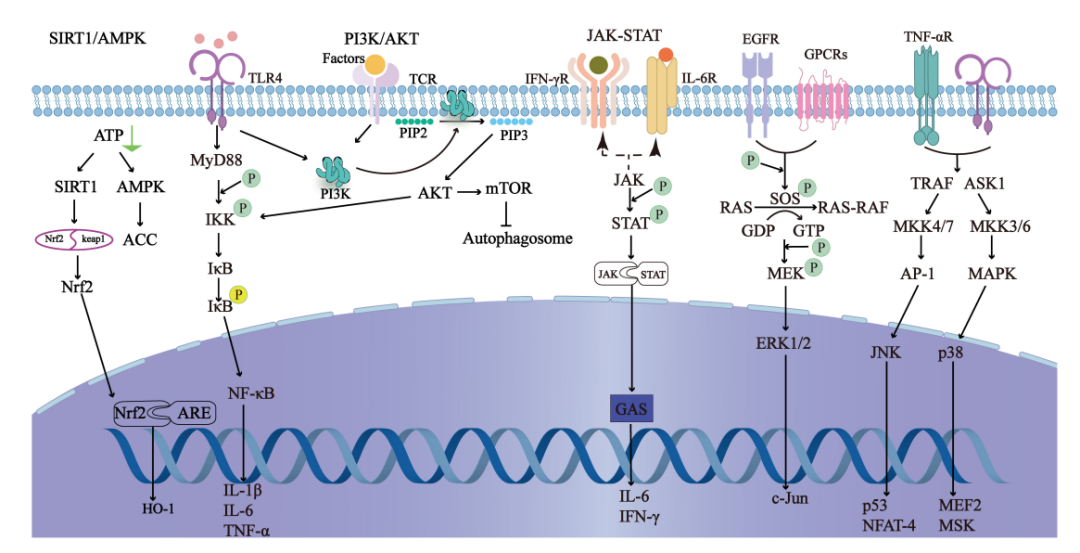
下图显示了SILI的主要相关信号通路,通过调控这些信号通路,可降低炎症反应,启动自噬,预防氧化应激,从而改善SILI。
三 SILI的危险因素
目前已有多个研究探讨了SILI的危险因素。比如,有研究[12]发现,与脓毒症无肝损伤组相比,SILI组患者高血压患病率更少,慢性肾功能不全相对更多,因肾脏疾病入住急诊科的比例更多,入院时SOFA评分、APACHE Ⅱ评分更高,住院天数更多(P均<0.05)。SILI组呼吸系统和消化系统较脓毒症无肝损伤组更易发生感染(P均<0.05)。SILI患者感染金黄色葡萄球菌的概率更大(P<0.05)。
另有研究[13]显示,血小板计数(PLT)下降、凝血酶原时间(PT)延长是脓毒症患者并发急性肝损伤的独立高危因素(P均<0.05),连续性肾脏替代治疗(CRRT)时间长、休克持续时间久和病死率高是SILI的独立临床特点(P均<0.05)。
四 SILI的治疗
SILI治疗的核心为抗感染,早期启动抗生素治疗对快速清除病原体、阻断感染扩散至关重要,可有效控制SILI的病情发展。其原则为:尽早足量给予经验性抗生素治疗,随后根据培养结果降阶梯治疗。
其他治疗措施包括:
• 感染源控制:脓肿穿刺/引流、坏死组织清创、拔除感染导管等。
• 血流动力学支持:早期目标导向液体复苏(EGDT)、血管活性药物维持平均动脉压≥65 mmHg。
• 器官功能支持:以血浆置换、MARS、SPAD、分子吸附再循环系统(人工肝)改善肝功能,通过CRRT、高通量/高截留滤器去除炎症介质及毒素等。
• 代谢-营养支持:优先选择肠内营养,补充谷氨酰胺、微量元素,维持血糖在6-10 mmol/L水平。
但上述治疗方式也存在一定的局限性,比如抗生素耐药、肝肾毒性叠加,多药联用可能产生相互作用、药代动力学改变,单一器官支持难以应对多器官功能障碍综合征(MODS),缺乏针对SILI核心病理环节的特异性药物等。纳米药物递送系统、免疫调节疗法、抗氧化应激疗法、抑制焦亡、中药治疗、调控自噬、表观遗传学治疗、细胞疗法等新型疗法在SILI的治疗中展现出一定的潜力,未来有望改变SILI的治疗格局,为患者带来更好的预后。
五 讨论与展望
当前SILI研究仍存在显著缺口,一方面,其发病机制中涉及的具体分子网络尚未完全阐明,导致临床缺乏能同时干预多条病理通路的“多靶点”治疗方案,难以应对疾病复杂的病理生理过程;另一方面,精准诊断与动态监测手段明显不足,现有肝功能指标对肝损伤的反映存在滞后性,无法及时捕捉病情变化,亟需筛选出敏感、特异的生物标志物组合以填补这一空白。
未来研究需重点聚焦生物标志物的挖掘,通过发现可实时反映肝损伤程度、预测疾病进展及治疗反应的分子标志物,为临床个体化用药提供可靠依据;同时,治疗策略应向多模式联合方向突破,探索抗氧化、焦亡抑制、自噬调节、表观干预与细胞/外泌体疗法的序贯或联合应用,并结合纳米靶向递送、可注射水凝胶等新技术,实现“药物-细胞-基因”一体化干预,从而更高效地阻断SILI的病理进程,改善患者预后。
【参考文献】
[1]陈文胜,刘文明.脓毒症诱发肝损伤的发病机制研究进展[J].江苏大学学报(医学版), 2023,33(2): 112-117.
[2]Chen JW, Liu CY, Li S, Wu SW, Cai C, Lu MQ. Sepsis-associated liver injury:mechanisms and potential therapeutic targets. World J Gastroenterol. (2024) 30:4518–22.
[3] Leonhardt S, Veltzke-Schlieker W, Adler A, Schott E, Hetzer R, Schaffartzik W,et al. Trigger mechanisms of secondary sclerosing cholangitis in critically ill patients. Crit Care. (2015) 19:131.
[4] Möller K, Braden B, Culver EL, Jenssen C, Zadeh ES, Alhyari A, et al. Secondary sclerosing cholangitis and igg4-sclerosing cholangitis - a review of cholangiographic and ultrasound imaging. Endosc Ultrasound. (2023)12:181–99.
[5] Nagar H, Piao S, Kim CS. Role of mitochondrial oxidative stress in sepsis. Acute Crit Care. (2018) 33:65–72.
[6]Zuo L, Prather ER, Stetskiv M, Garrison DE, Meade JR, Peace TI, et al.Inflammaging and oxidative stress in human diseases: from molecular mechanisms to novel treatments. Int J Mol Sci. (2019) 20(18):4472.
[7] Prauchner CA. Oxidative stress in sepsis: pathophysiological implications justifying antioxidant co-therapy. Burns. (2017) 43:471–85.
[8]Galley HF. Oxidative stress and mitochondrial dysfunction in sepsis. Br J Anaesth. (2011) 107:57–64.
[9] Shi J, Zhao Y, Wang K, Shi X, Wang Y, Huang H, et al. Cleavage of gsdmd by inflammatory caspases determines pyroptotic cell death. Nature. (2015) 526:660–5.
[10] Wang H, Zhu J, Wei L, Wu S, Shang L, Ye X, et al. Tslp protects against sepsis_x0002_induced liver injury by inducing autophagy via activation of the pi3k/akt/stat3 pathway. Pathol Res Pract. (2022) 236:153979.
[11] Samanta S, Zhou Z, Rajasingh S, Panda A, Sampath V, Rajasingh J. Dnmt and hdac inhibitors together abrogate endotoxemia mediated macrophage death by stat3-jmjd3 signaling. Int J Biochem Cell Biol. (2018) 102:117–27.
[12]张锦鑫,沈括,李俊杰,等. 脓毒症相关性急性肝损伤的流行病学特点及致病因素分析[J]. 中华急诊医学杂志,2022,31(2):203-209.
[13]林慧,梁琦强,蔡旗旗,等. 脓毒症相关性肝损伤的高危因素及临床特点分析[J]. 中华危重病急救医学,2021,33(2):186-191.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)