首页 > 医疗资讯/ 正文
一、病例介绍
患者基本情况
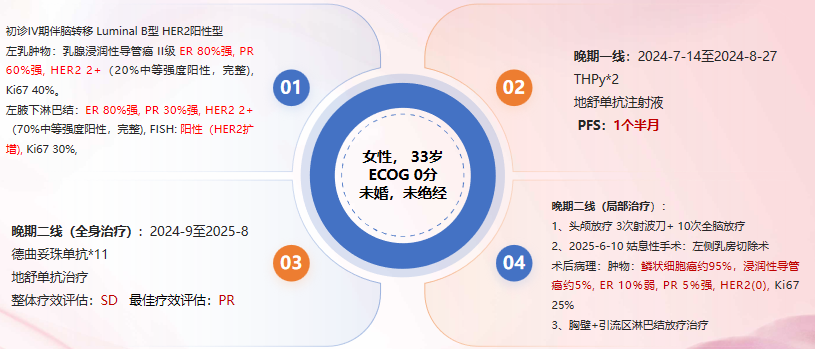
患者:女性,33岁,ECOG 0分
既往史:否认高血压、糖尿病等基础疾病,无肝炎结核,2009年行 “ 阑尾切除术”,2017年行 “骨囊肿切除术”,系统回顾无特殊
婚育史:未婚,末次月经2024-8-4
家族史: 家族中无相关遗传疾病记载
个人史:无特殊
首次就诊情况
2023-10确诊左乳癌
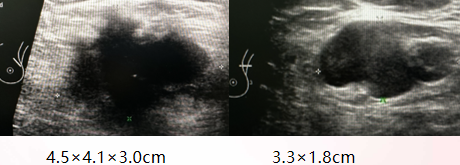
乳腺彩超(2023-10):左乳外上腺体层实性(4.5×4.1×3.0cm),左乳皮下组织水肿,左腋下多发淋巴结肿大(3.3×1.8cm)。
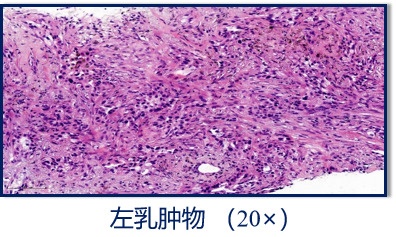
空芯针穿刺活检:
左乳肿物:乳腺浸润性癌II级,左腋下淋巴结:可见癌转移。
左锁下、左内乳区淋巴结针吸:找到癌细胞。
免疫组化:
左乳肿物:ER 80%强,PR 60%强,HER2 2+(20%中等强度阳性,完整),Ki67 40%,未做FISH。
左腋下淋巴结:ER 80%强,PR 30%强,HER2 2+(70%中等强度阳性,完整), Ki67 30%,未做FISH。
患者未行进一步检查及规范治疗,自行中医中药治疗。
再次就诊情况
2024-07-05因肿物进一步增大再次就诊于我院
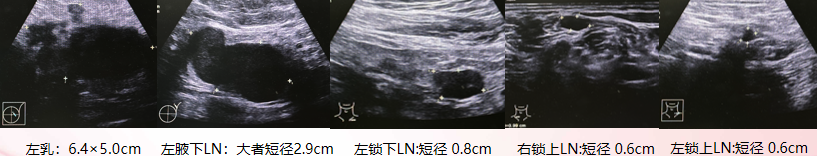
乳腺彩超:左乳外上腺体层实性占位(BIRADS-6类),左腋下多个淋巴结,左锁下,胸大小肌间数个淋巴结,内乳区,双锁上数个淋巴结,淋巴门结构不清,考虑转移。
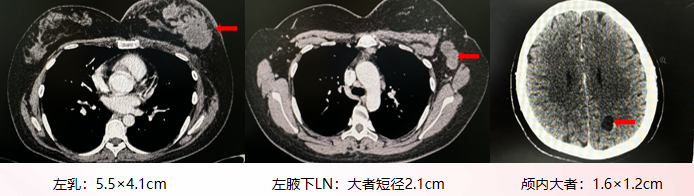
头+颈+胸+全腹增强CT(2024-7-5):
乳腺癌,左侧乳腺多发软组织肿物影,左侧腋窝多发增大淋巴结,考虑转移。
颅内多发低密度影,考虑转移可能性大;右侧肩胛骨及部分腰椎低密度影。
骨扫描(2025-7-10):右侧肩胛骨、胸4、5椎体、腰3椎体、胫骨下端部分见异常骨显像剂浓聚,考虑多发骨转移Ca可能性大。
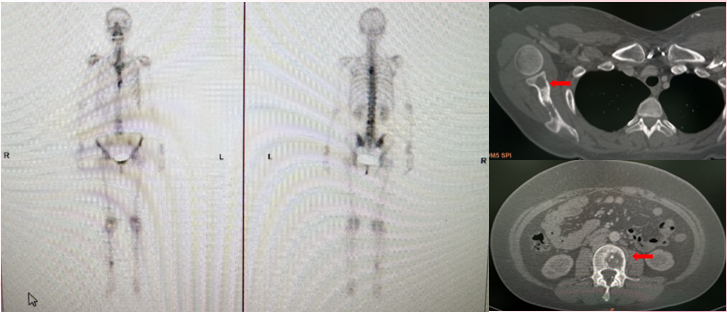
完善FISH检测(腋下淋巴结):阳性(HER2扩增)
血液学检查:
血常规:血红蛋白: 92g/L
患者骨痛 NRS评分3分
余检查未见明显异常
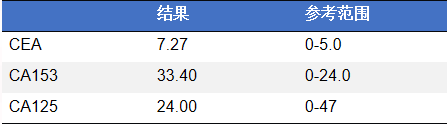
乳癌三项:
初步诊断:
1、左乳癌(T4N3M1)IV期,脑、骨、淋巴结转移(Luminal B HER2阳性型)
2、贫血
晚期一线
2024-7-14 至 2024-8-27:THPy*2
白蛋白结合型紫杉醇450mg(237mg/㎡),静脉注射,D1,Q21D
曲妥珠单抗 8mg/kg首次,6mg/kg维持,静脉注射,D1,Q21D
吡咯替尼 400mg,口服,1/日,Q21D
地舒单抗注射液 120mg,皮下注射,Q28D
晚期一线——疗效评估
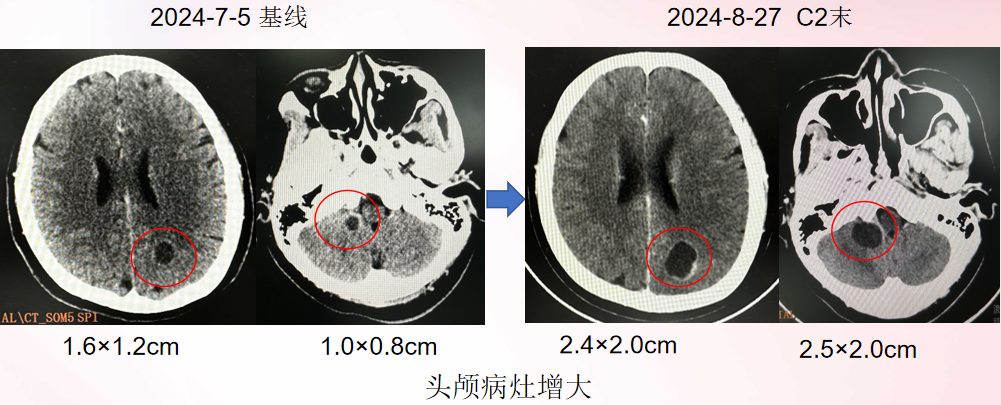
头颅病灶:
8月初:间断头晕不适、偶有恶心呕吐
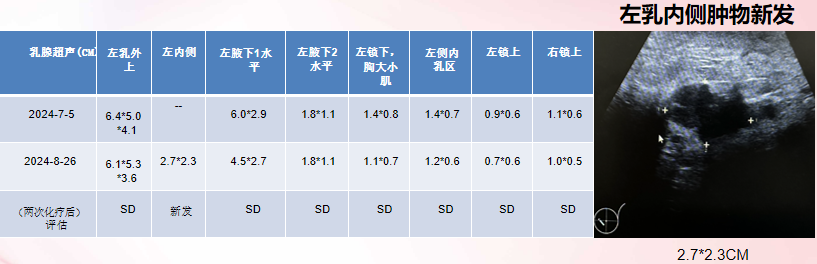
乳房病灶:
骨病灶稳定
整体疗效评估:PD PFS: 1个半月
晚期二线
2024-9至2025-8:德曲妥珠单抗*11
德曲妥珠单抗 400mg 静脉注射 Q21D
地舒单抗 120mg 皮下注射 Q28D
局部治疗:
2024-9-14至2024-9-19:颅内多发转移瘤射波刀放疗 33Gy/3次
2024-9-27至2024-11-25全脑放疗 25Gy/10次
晚期二线——疗效评估
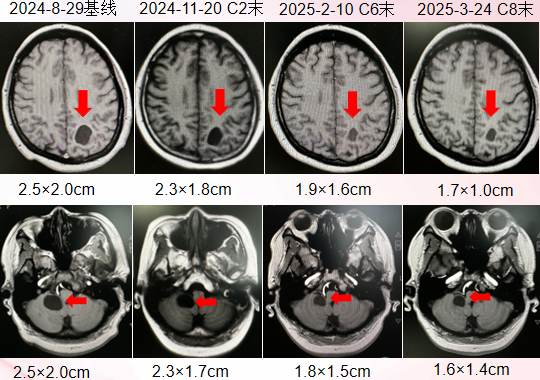
头颅病灶MRI:头颅病灶缩小
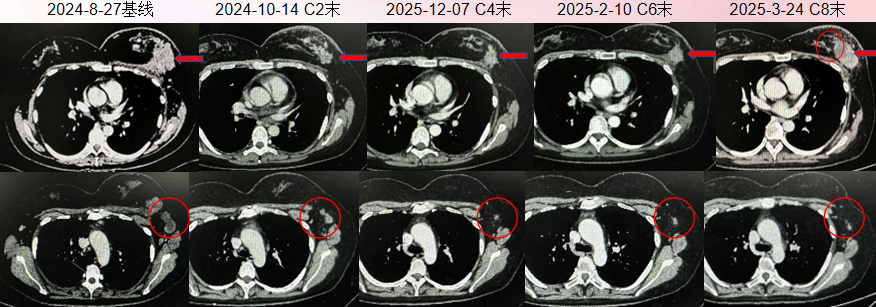
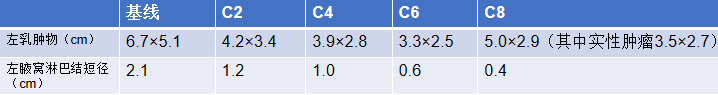
肿物及淋巴结缩小
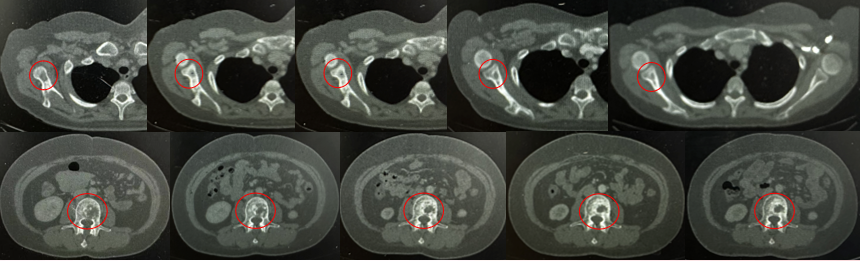
骨病灶稳定,部分成骨性改变
2025-4-21 患者出现乳头溢液,血性
溢液涂片:可见散在中性粒细胞
8周期德曲妥珠单抗治疗后评估:
1. 头颅病灶缩小
2. 骨病灶稳定、伴成骨性改变
3. 乳房肿物(液性坏死)
整体疗效评估:PR
2025-5:继续德曲妥珠单抗400mg 第9周期 治疗
晚期二线——姑息手术治疗
2025-6 患者乳房肿物迅速增大 ,伴乳房胀痛,严重影响患者生活质量
2025-6-10 姑息性手术:左侧乳房切除术
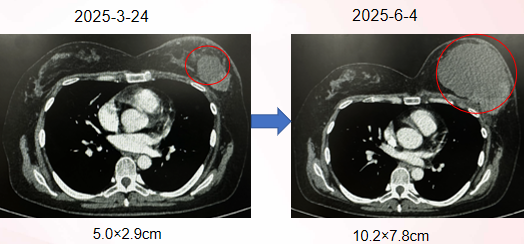
术后病理:
左乳肿物:8cmx7cmx6.5cm,瘤床处乳腺浸润性癌(鳞状细胞癌约95%,浸润性导管癌约5%)
Til 3%,底缘(-), 皮肤(-), 乳头(-)。
腋窝组织可见淋巴结8/10(其中1为鳞状细胞癌转移,7枚为浸润性导管癌转移)。
免疫组化:ER(10%弱阳性), PR(5%强阳性), HER2(0), Ki67(阳性细胞数25%), AR(5%强阳性), E-cadherin(+),
CK5/6(80%阳性), P63(+), P40(+), P120(胞膜+)。
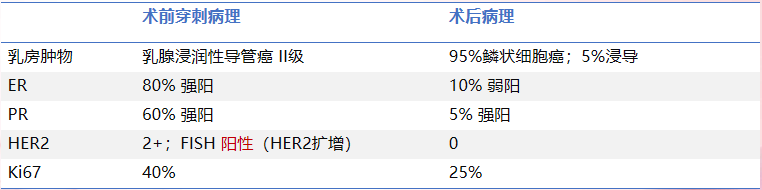
2025-7-15头颅MRI:颅内病灶SD(增大)
患者无明显不适主诉
疗效评估:头颅病灶SD,骨病灶稳定伴成骨改变,乳房切除术后
整体疗效评估:SD
后续治疗:
2025-7-17至2025-8-8:第10,11周期德曲妥珠单抗
2025-8-13至2025-9-24:放疗
放疗计划:左侧胸壁、左侧腋窝、左侧锁骨上下淋巴引流区、左侧内乳淋巴引流区48Gy/25次(6MV-X线)
晚期二线——检验及安全性评估
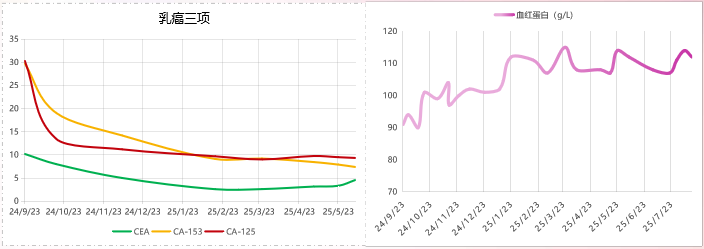
安全性(主要AE):
贫血1-2级,3度白细胞降低及粒细胞缺乏(2024-12-07)后维持1-2级
转氨酶升高1-2级,恶心呕吐:1-2级,乏力:1级
治疗过程小结
二、病例讨论
问题1:该患者一线治疗时已出现多发脑转移但无颅内高压症状,采用抗HER2双靶治疗。对于无症状多发脑转移患者是否应在一线治疗时联合颅脑放疗?二线术后区域淋巴结放疗对局部控制和疾病进展的价值如何?以及脑转移灶中囊性与实性病灶的放疗策略差异。
中山大学孙逸仙纪念医院-放疗科-罗铭:
关于脑部放疗是否应前置的问题,我们可以参考肺癌的治疗共识。肺癌共识明确指出,对于无症状的脑转移患者(如本例中的多发但无症状患者),在能够使用有效入脑的小分子药物(如本例使用的吡咯替尼)的情况下,我们通常不会将放疗作为一线治疗。患者可以先接受全身系统治疗,在治疗过程中密切观察。若患者进展并出现明显神经系统症状(如头痛、脑水肿导致中线偏移等),则需积极干预。但在病情相对稳定时,可以优先完成全身系统治疗,后续再评估是否需要补充局部放疗,因为小分子药物本身对颅内病灶是有效的。过早进行全脑放疗通常不建议与全身治疗同期进行,且考虑到此患者全身情况较重而颅内无症状,因此更合理的策略是先完成系统治疗,再考虑放疗的必要性。
关于囊性转移灶和实性转移灶的治疗差异,虽然理论上囊性病灶中心可能存在缺氧区域影响放疗敏感性,但根据我们的临床观察,囊性病灶对放疗的反应通常也相当不错。因此,其放疗方式或整体治疗策略并不需要因此改变。
最后,关于全身转移患者是否仍需局部放疗的问题,我们之前有相关综述讨论过。数据显示,晚期全身转移患者手术后联合局部放疗,可显著降低局部复发率(从约40%-48%降至3%以内),即姑息性放疗能有效控制局部问题。但必须向患者坦诚说明的是,这种治疗并不能改善总生存期(OS)。即使完成了包括足量放疗在内的所有治疗,患者的预期生存时间(如三年)通常不会延长。
尽管如此,我个人仍倾向于实施放疗。解决已知的局部问题,就如同优先扑灭一处明确的火源,可以避免在后续治疗中陷入既要处理新发转移灶、又要应对局部复发这种“四处灭火”的困境。及时控制局部病灶能有效减轻后续治疗压力,使我们能够更专注于处理其他问题。
问题2:请问从病理学角度如何解释该患者从浸润性非特殊类型癌经过局部病灶清除术后,分子分型和病理类型发生较大改变的?这种变化对治疗策略有何影响?是否可能由其他因素(如转移性鳞癌)导致?是否建议通过NGS检测比较首诊病灶和术后病灶来判断两者的分子来源是否一致?
请问从病理学角度如何解释该患者从浸润性非特殊类型癌治疗后转变为三阴性乳腺癌的分子分型和病理类型变化?这种变化对治疗策略有何影响?是否可能由其他因素(如转移性鳞癌)导致?是否建议通过NGS检测比较首诊"三阳"和术后"三阴"病灶来判断两者的分子来源是否一致?
中山大学孙逸仙纪念医院-病理科-雍娟娟:
首先需要明确的是,患者在接受二线治疗后进行的手术切除标本中同时存在低分化鳞状细胞癌和浸润性导管癌两种成分。从病理诊断角度来看,乳腺原发的鳞状细胞癌非常罕见,通常归类为化生性癌。在已经接受多线治疗的患者中发现鳞癌成分必须格外谨慎,因为部分癌在治疗后可能出现鳞状分化现象,表现为鳞癌标志物阳性。因此我们建议在这种情况下必须同时检测乳腺癌标志物如GATA3和ER,以鉴别是否为治疗后发生的鳞状化生。从本病例的组织学构成来看,95%的鳞癌成分与5%的浸润性导管癌成分并存,这提示可能原本就是乳腺混合性化生癌。这凸显了多点穿刺活检的重要性,因为肿瘤异质性可能导致初次穿刺仅获取少量成分,从而影响分子分型的准确性。
在免疫组化判读方面,特别需要注意的是HER2的评估方法。当肿瘤存在异质性时,按照现行标准对整个肿瘤细胞群进行百分比评估可能会掩盖部分成分的特征。例如少量鳞癌成分可能因其HER2阴性特性而被忽略,而浸润性导管癌成分的HER2阳性特征可能主导最终结果。因此,对于这种混合性肿瘤,必须分别评估不同成分的ER、PR、HER2和Ki-67表达情况,这将对后续治疗方案的制定产生重要影响。淋巴结转移情况也值得关注,本病例中不同淋巴结分别呈现鳞癌和浸润性导管癌转移,这种差异提示我们需要仔细评估鳞癌的分化程度,因为不同分化级别的鳞癌在预后和侵袭性方面存在显著差异。
关于基因检测的样本选择问题,必须特别注意同时包含两种成分或分别检测,以避免因取样偏差导致错误结论。此外,虽然乳腺转移性鳞癌极为罕见,但仍需通过详细询问病史和影像学检查排除其他部位原发的可能。这类复杂病例的诊断和治疗决策需要多学科团队的充分讨论和协作。
最后,关于这是否为其他部位鳞癌转移至乳腺的可能,我们首先要详细询问病史。虽然存在原发癌与转移癌碰撞的罕见情况,但这需要结合影像学和多方病史核实,并通过多学科讨论才能最终确诊。
问题3:我们知道靶向HER2的ADC药物DS-8201(TDXD)在多项荟萃分析和研究中,都显示出对稳定性和活动性脑转移具有最优的治疗效果。那么对于这位初诊即发现脑转移的患者,我们是否应该考虑在一线治疗时就直接使用TDXD,而不是先采用大小分子联合的方案?临床实践中是否会进行这样的考量?
请问从病理学角度如何解释该患者从浸润性非特殊类型癌治疗后转变为三阴性乳腺癌的分子分型和病理类型变化?这种变化对治疗策略有何影响?是否可能由其他因素(如转移性鳞癌)导致?是否建议通过NGS检测比较首诊"三阳"和术后"三阴"病灶来判断两者的分子来源是否一致?
中山大学孙逸仙纪念医院-肿瘤内科-曾银朵:
在一线治疗中,如果横向对比各种药物,DS-8201(TDXD)在脑转移中的治疗效果确实是最好的,因此将其用于一线是一个可以考虑的选项。但是,目前这种用法属于超说明书用药,需要签字使用。所以,在我们的常规临床实践中,总体上还是将它放在二线进行治疗。
猜你喜欢
- 异物入眼 眯眼不当会失明!
- Journal of Hepatology:上海中医药大学何锋团队等揭示ATF4通过阻断铁死亡来抑制肝癌发生
- IJNS:基于移动应用程序康复方案对关节置换术后患者的有效性
- 【Cancer】FLT3‐ITD AML吉瑞替尼维持治疗的2期研究
- 咳嗽时喝陈皮水能够缓解咳嗽的症状吗
- 新鲜美味又营养 源自豆腐鹅蛋黄的做法-咸鲜味烧菜谱
- 科颜氏淡斑精华液的正确使用方法 你的肤质适合使用吗
- Hepatology:Aldafermin和Pegozafermin在降低代谢功能障碍相关脂肪性肝炎患者肝脏脂肪含量方面表现最佳
- 整治网络培训乱象,也需看到中老年人的精神需求
- 春天眼病 知己知彼 百战不殆
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)