首页 > 医疗资讯/ 正文
伤口愈合是一个复杂且高度调控的生物过程,涵盖止血、炎症、增殖及重塑四个阶段。糖尿病及细菌感染等特殊病理状态往往导致伤口愈合迟缓,严重时甚至引发感染、坏疽,威胁患者生命。黄连碱(BBR)作为一种传统中药成分,近年来被证实具备多重生物活性,有效抑制炎症反应、抑菌并减轻氧化应激,促进伤口微环境的改善。本文系统综述了黄连碱基于智能响应载体的设计、制备及应用,并探讨其促进伤口修复的分子机制及临床转化前景。

为克服黄连碱的药代动力学缺陷,研究者开发了多种新型载体体系,包括天然多糖基水凝胶(如海藻酸盐、透明质酸、壳聚糖)、合成聚合物基水凝胶(如聚乙烯醇、卡波姆)、电纺纳米纤维膜和多种纳米粒子系统(例如脂质体、固体脂纳米粒子、自组装纳米颗粒)。这些智能载体具备pH、温度、氧化还原反应及近红外响应能力,实现对黄连碱的控释和精准递送。
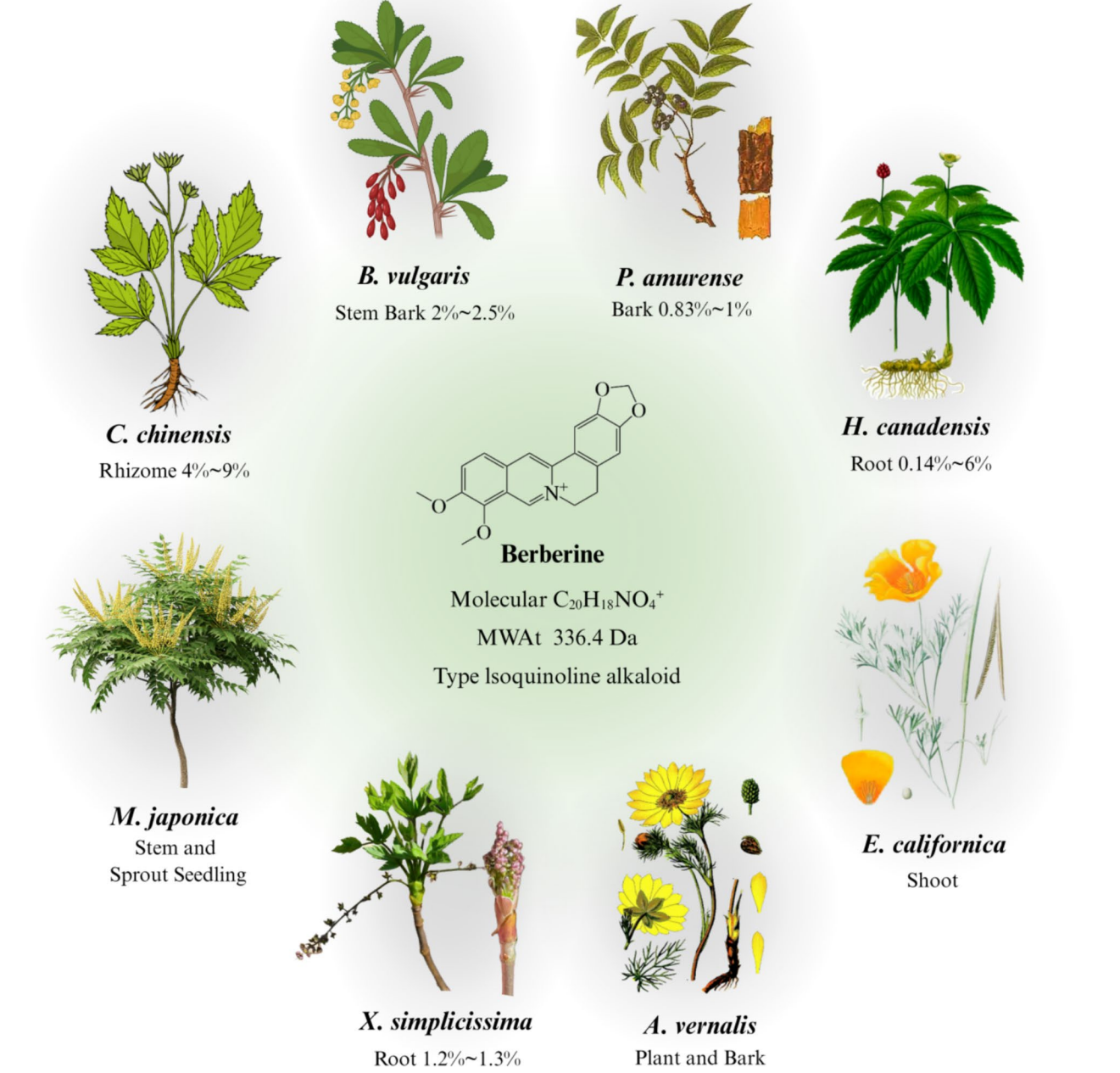
图:BBR的化学结构、植物来源、药用部位及含量分布
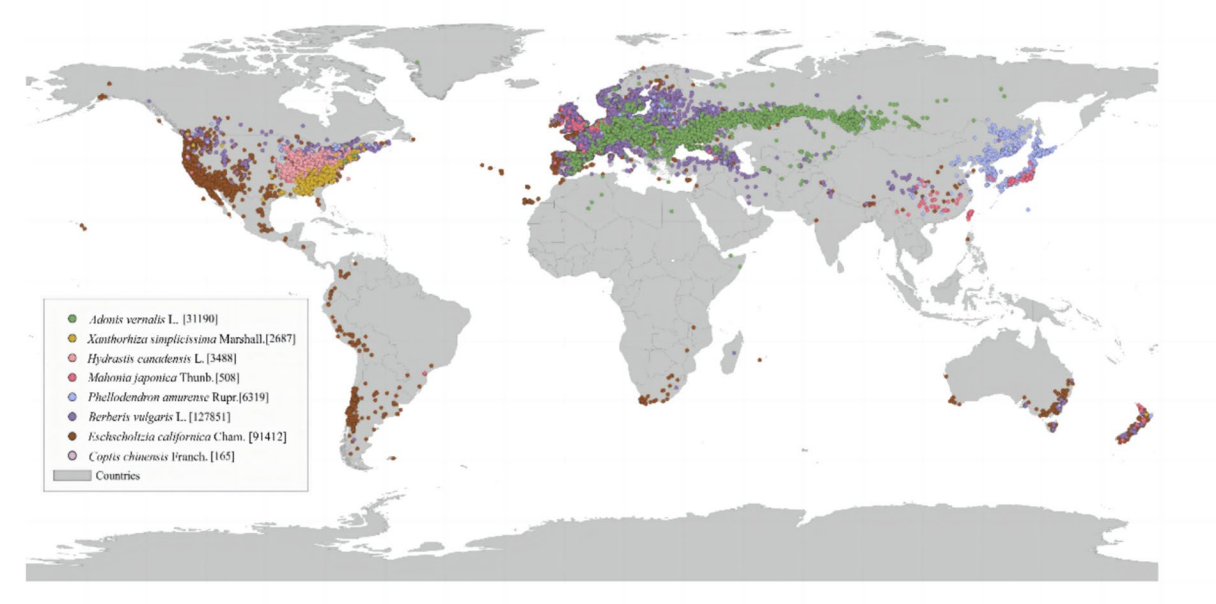
图:BBR来源的全球分布图
1、急性伤口修复
采用黄连碱负载的水凝胶和纳米纤维膜,可显著促进成纤维细胞增殖与迁移,提升胶原蛋白合成及血管生成。水凝胶类载体如BBR-PolyET-NC和HA/聚赖氨酸纳米凝胶实现了持续释放,改善伤口微环境,促进再上皮化。纳米纤维膜如BBR-PCL电纺膜表现出良好的止血性能和抗菌作用,促进伤口修复。
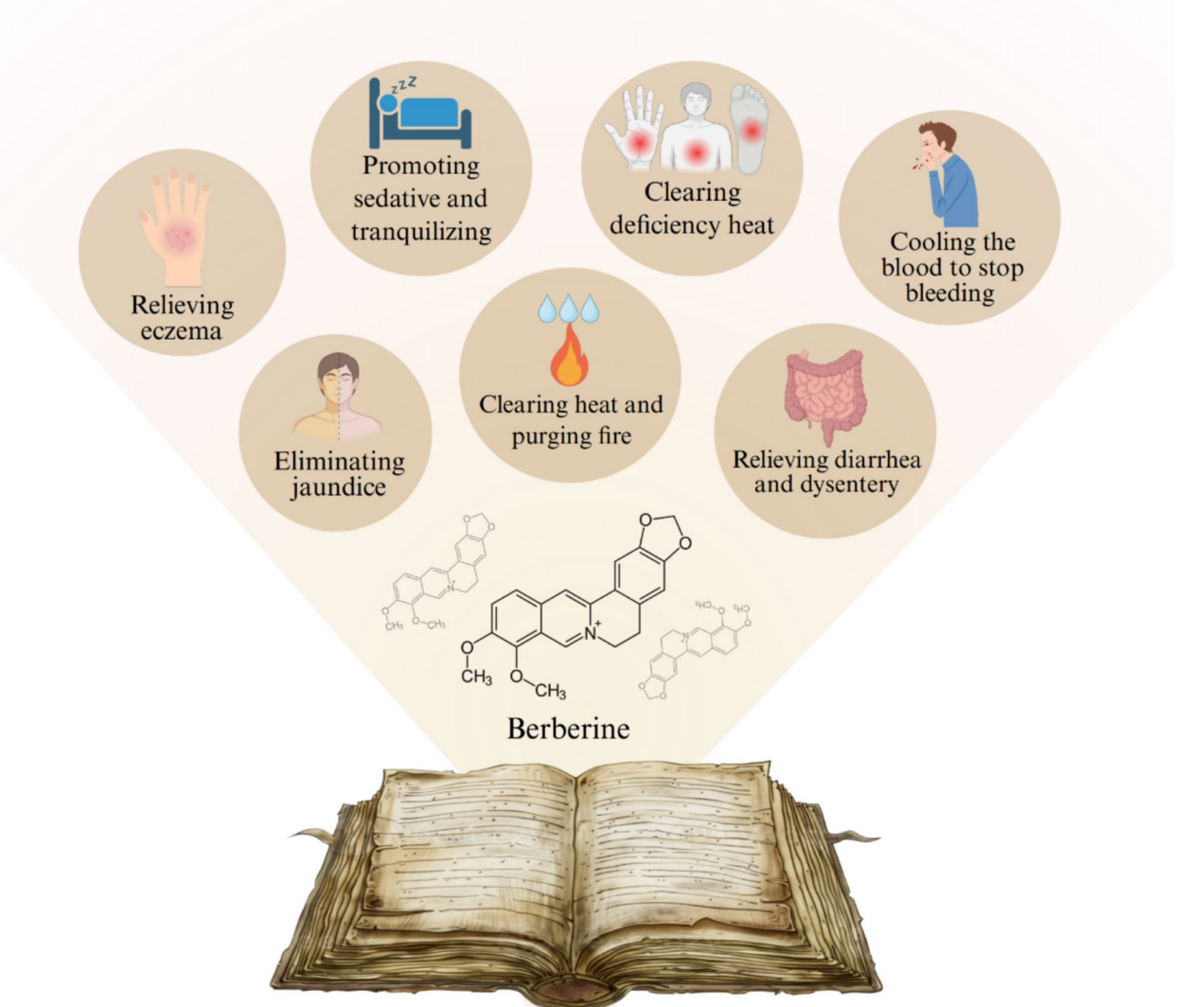
图:BBR的传统应用
2、感染性伤口治疗
黄连碱通过多机制抗菌,包括抑制细菌DNA复制和细胞膜破坏,联合新型纳米颗粒(如BBR-TA、BBR-EGCG纳米颗粒)增强抗耐药菌(如MRSA)的能力。智能响应型水凝胶(如近红外光响应的A-T-BBR水凝胶)在光热协同杀菌中表现优异,显著加速感染创面愈合。
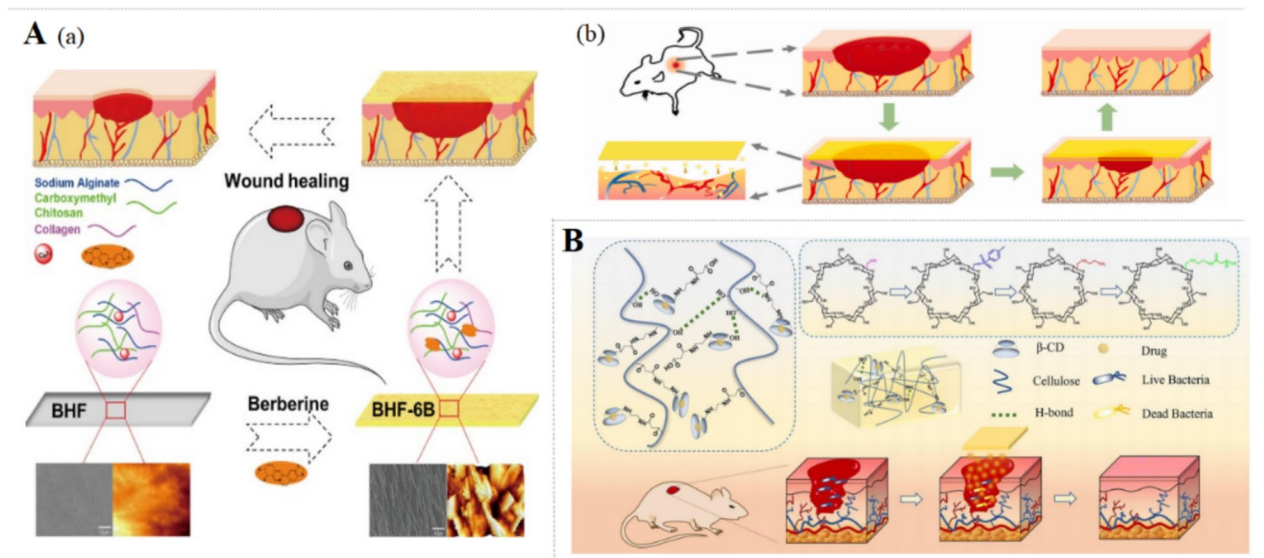
图:BBR薄膜与水凝胶在急性创面修复中的作用机制
3、糖尿病慢性伤口的管理
糖尿病伤口因慢性炎症及氧化应激阻碍修复,黄连碱载体系统能够通过调控NF-κB、SIRT1/JNK等信号通路,抑制炎症因子释放,促进血管生成及胶原沉积。如CuO@BBR/BH光热水凝胶、PHBV-BBR径向纳米纤维膜及黄连碱修饰的ZnO纳米胶均显著促进糖尿病伤口愈合。
4、其他创面类型
创新递送系统如基于中草药花粉微型驱动器(MG-SECS-BBR)用于胃溃疡治疗,及胆固醇酰基黄连碱膜剂在压疮修复中展示潜力,拓宽了黄连碱治疗范围。
黄连碱载体系统通过响应伤口微环境变化,如pH、ROS以及温度,智能调节药物释放,抑制促炎因子(TNF-α、IL-6、IL-1β)、减少氧化应激,促进巨噬细胞向修复型M2表型转化,增强成纤维细胞和内皮细胞的增殖与迁移,促进胶原合成及新生血管形成。此外,部分载体通过协同光热效应增强抗菌活性,实现多效合一的伤口治疗策略。
综上,黄连碱基于先进载体的递送系统为伤口治疗,尤其是糖尿病和感染性慢性创面,提供了新的治疗策略。尽管目前临床转化仍面临载体稳定性、药物释放控制及个体化响应的挑战,随着智能响应材料和多组分协同治疗的进展,黄连碱的临床应用前景广阔。未来研究需着力优化载体设计、结合临床试验验证其安全有效性,并探索与干细胞、增长因子等的联合应用,进一步提升治疗效果。
原始出处
Yin, J., Qin, S., Chen, J. et al. Berberine-based strategies: novel delivery systems bring out new potential for wound healing. Chin Med 20, 150 (2025). https://doi.org/10.1186/s13020-025-01192-0
本文相关学术信息由梅斯医学提供,基于自主研发的人工智能学术机器人完成翻译后邀请临床医师进行再次校对。如有内容上的不准确请留言给我们。
猜你喜欢
- 中药材价格不断的上涨,常见中药材品种价格上涨原因是什么
- Front Endocrinol:亚洲人腹部、肝脏和心外膜脂肪与人体测量、糖尿病和心脏重构差异的关系
- J Hematol Oncol:用于治疗复发或难治性 B 细胞恶性肿瘤的现成 CAR-T 细胞疗法
- 只要运动了就能减肥?没掌握这3点,力气都白费了!
- 墨鱼香干芹菜小炒的做法-咸鲜味炒菜谱
- 一线治疗EGFR突变晚期NSCLC患者变天:EGFR/cMET双抗联用拉泽替尼总生存期击败奥希替尼
- 锦州医科大学附属第三医院泌尿外科设备结果公告
- 武田将在美国血液学会(ASH)第64届年会上呈报数据,彰显对血液系统癌症和其他血液病患者的承诺
- 【协和医学杂志】1990—2021年中国与全球早发女性乳腺癌的疾病负担和归因风险因素分析
- 麻醉觉醒——无影灯下的“恐怖体验”
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)