首页 > 医疗资讯/ 正文
摘要:目的探讨在局部麻醉下经桡动脉入路应用导管“裸撑”技术血管内治疗重度椎-基底动脉狭窄患者的安全性和有效性。方法回顾性连续纳入2021年6月至2023年3月在武汉大学中南医院神经内科住院并于局部麻醉下经桡动脉入路应用导管“裸撑”技术(不使用导引导管及长鞘作为支撑,直接将远端通路导管超选入目标血管的技术)行重度椎-基底动脉狭窄血管内治疗的患者。收集患者的基线及临床资料,包括性别、年龄、高血压病、糖尿病、高脂血症、冠心病、心房颤动、卒中史、吸烟史、术前美国国立卫生研究院卒中量表(NIHSS)评分及术前改良Rankin量表评分。收集手术相关数据,包括狭窄部位(椎动脉V4段、基底动脉、椎动脉V4段+基底动脉)、狭窄率(70%~90%、>90%~99%)、靶病变血管直径、病变血管长度、椎-锁夹角、椎-锁距离、是否使用远端通路导管、麻醉方式(局部麻醉、局部麻醉转全身麻醉)、是否存在孤立椎动脉(对侧椎动脉闭塞)、远端通路导管是否经过塑形、远端通路导管到达椎动脉的位置(椎动脉V2、V3、V4段)、血管内治疗方式(单纯球囊扩张、球囊扩张+自膨支架、球囊扩张支架)、术中出现脑缺血症状、术中出现严重脑缺血症状及是否转换手术入路。统计所有患者临床结局及随访情况,包括手术成功[经桡动脉入路完成手术且血管内治疗后靶病变血管残余狭窄率<30%,且术后即刻改良脑梗死溶栓(mTICI)分级为3级]率、术后72h内神经功能缺损症状、围手术期并发症(致残性卒中、非致残性卒中、穿刺点并发症)、术后6个月内支架内再狭窄[血管内置入支架或血管成形后,在成形的血管段或其邻近区域(支架两端5mm范围内)再次出现管腔狭窄率≥50%]和卒中复发(首次缺血性卒中发病后再次发生新的脑血管事件)。根据远端通路导管的头端是否进行预塑形将所有患者分为塑形组和未塑形组。比较塑形组和未塑形组的基线及临床资料、椎-锁夹角和椎-锁距离。结果共纳入33例经桡动脉入路应用导管“裸撑”技术行血管内治疗的重度椎-基底动脉狭窄患者,男29例,女4例,年龄42~76岁,平均(62±9)岁。其中塑形组13例,未塑形组20例。(1)两组基线及临床资料的差异均无统计学意义(均P>0.05)。与未塑形组相比,塑形组患者椎-锁夹角更小[(62.80±21.57)°比(109.57±28.63)°,P<0.01]、椎-锁距离更长[(13.58±7.35)mm比(6.13 ± 4.31)mm,P=0.002]。(2)采用局部麻醉完成手术者30例(90.9%),3例(9.1%)局部麻醉转全身麻醉者为术中出现严重的缺血不耐受的孤立椎动脉患者。经桡动脉入路行重度椎-基底动脉狭窄血管内治疗的手术成功率为93.9%(31/33),塑形组2例经桡动脉入路通路建立困难改为经股动脉入路后成功完成手术。术后72h内出现神经功能缺损症状者5例(15.2%)。围手术期并发症发生率为9.1%(3/33),其中致残性卒中1例(3.0%),非致残性卒中2例(6.1%),未发生穿刺点并发症。术后6个月内发生支架内再狭窄2例(6.1%),无卒中复发。结论局部麻醉下经桡动脉入路应用导管“裸撑”技术治疗重度椎-基底动脉狭窄具有一定的安全性和可行性。本研究结果尚待大样本、前瞻性、随机对照研究进一步验证。
随着神经介入材料和技术的发展,经桡动脉入路已成为脑血管造影的标准选择之一,在前循环和后循环机械取栓中均展现出显著优势[1-2],且适用于颈动脉支架置入术[3]。经桡动脉入路行后循环颅内动脉狭窄血管内治疗所需导管尺寸较大,对血管的刺激较为明显,且在血管内治疗过程中导管超选进入椎动脉及进行球囊扩张时会短暂阻断血流,可能导致患者术中出现脑缺血,影响手术进程,因此该类手术通常需在全身麻醉下完成[4]。为了减少导管对血管的刺激及对椎-基底动脉血流的影响,多项研究探讨了经桡动脉入路采用远端通路导管“裸撑”技术(无需导引导管及长鞘作为支撑,直接将远端通路导管选入目标血管)行重度椎-基底动脉狭窄的血管内治疗的疗效[2,5-7]。然而,既往研究多在全身麻醉下进行,关于局部麻醉下经桡动脉入路行椎-基底动脉狭窄血管内治疗的相关研究较少。本研究旨在初步探讨局部麻醉下经桡动脉入路采用“裸撑”技术行重度椎-基底动脉狭窄血管内治疗的有效性和安全性。
1 对象与方法
1.1 对象
回顾性连续纳入2021年6月至2023年3月于武汉大学中南医院神经内科住院并在局部麻醉下经桡动脉入路应用导管“裸撑”技术行重度椎-基底动脉狭窄血管内治疗的患者。本研究方案经武汉大学中南医院医学伦理委员会审核批准(伦理审批号:2022071)。所有患者或家属签署了诊疗知情同意书。
纳入标准:(1)年龄40~80岁;(2)发病至手术时间7~21d;(3)基线改良Rankin量表(mRS)评分≤3分;(4)症状性椎-基底动脉狭窄,且经历过2次短暂性脑缺血发作和(或)缺血性卒中;(5)经头部CT血管成像(CTA)和DSA检查确诊椎-基底动脉狭窄率为70%~99%(采用北美症状性颈动脉内膜切除术试验标准[8]评估椎-基底动脉狭窄程度),且狭窄血管直径≥2mm;(6)灌注加权成像(PWI)显示责任动脉供血区域存在血流动力学障碍。
排除标准:(1)合并颅外段血管的重度狭窄性串联病变;(2)经超声检查或Allen试验证实桡动脉或锁骨下动脉入路存在闭塞或严重狭窄病变;(3)由单纯穿支闭塞引起的卒中。
1.2 资料收集
收集患者的基线及临床资料,包括性别、年龄、高血压病[9]、糖尿病[10]、高脂血症[11]、冠心病[12]、心房颤动[13]、卒中史[14]、吸烟史[15]、术前美国国立卫生研究院卒中量表(NIHSS)[16]评分及术前mRS[17]评分。收集手术相关数据,包括狭窄部位(椎动脉V4段、基底动脉、椎动脉V4段+基底动脉)、狭窄率、靶病变血管直径、病变血管长度、椎-锁夹角、椎-锁距离、是否使用远端通路导管、麻醉方式(局部麻醉、全身麻醉)、是否为孤立椎动脉(对侧椎动脉闭塞)、远端通路导管是否经过塑形、远端通路导管到达椎动脉的位置(椎动脉V2、V3、V4段)、血管内治疗方式(单纯球囊扩张、球囊扩张+自膨支架、球囊扩张支架)、术中是否出现脑缺血症状(孤立椎动脉、双侧椎动脉)及严重脑缺血症状、是否转换手术入路等。术中脑缺血症状包括眩晕、恶心、呕吐、言语不利、肢体活动障碍等,术中严重脑缺血症状包括意识障碍、肢体抽搐、凝视伴偏侧瘫痪等。
椎-锁夹角:取椎动脉与锁骨下动脉所在的切线位平面,从椎动脉起始点向椎动脉走行方向绘制切线,再从椎动脉起始点向锁骨下动脉走行方向绘制切线,两条切线形成的夹角为椎-锁夹角(图1a)。椎-锁距离:取椎动脉与锁骨下动脉所在的切线位平面,以锁骨下动脉与腋动脉交汇的最高点为基准作水平切线,从椎动脉起始点向该水平切线所作垂线段的长度为椎-锁距离(图1b)。

1.3 药物治疗
术前口服双联抗血小板聚集药物(阿司匹林100mg/次,1次/d+氯吡格雷75mg,1次/d)至少5d,并积极控制各种危险因素(如控制血压在140/90mmHg以下、糖化血红蛋白<7%等);术后180d内口服双联抗血小板聚集药物(阿司匹林100mg/次,1次/d+氯吡格雷75mg/次,1次/d);术后180d后口服阿司匹林100mg/次,1次/d,或氯吡格雷75mg/次,1次/d,长期服用。
1.4 手术过程
在局部麻醉下,采用Seldinger技术行桡动脉穿刺,穿刺成功后置入6F桡动脉鞘。按照椎-锁夹角大小和术者经验将远端通路导管的头端进行塑形或不塑形预处理(塑形指根据目标血管的解剖形态,在蒸气加热状态下,预弯处理远端通路导管的头端,使其形成特定形状的过程)。在路图引导下,将115cm 5F Catalyst 5远端通路导管(Stryker,Freemont,美国)与260cm泥鳅导丝同轴送入靶病变侧椎动脉V2段以远;使用StrykerSL-10微导管(Stryker,Freemont,美国)协同配合300cm Synchro0.014英寸微导丝(1英寸=2.54cm;Stryker,Freemont,美国),成功将5F Catalyst5远端通路导管头端送达靶病变侧椎动脉V3段;借助路图引导,同轴操作微导丝和微导管头端,精准穿过狭窄病变部位,并在微导管的支撑下,将微导丝送至大脑后动脉P2段以远,确认微导丝位于血管真腔后,交换出微导管。精准测量靶病变血管直径,选取直径为靶病变血管直径90%的球囊进行“亚满意”扩张[18]。采用缓慢扩张方式扩张球囊,同时要求患者按照指令回答问题并完成指令动作。球囊扩张结束后,根据患者在球囊扩张过程中的遵嘱情况及症状评估其是否存在脑缺血事件(无法根据指令清晰说出自己的名字,不能活动手指或脚趾,提示可能存在脑缺血事件;可流利说出自己的名字,自如活动手指或脚趾,则提示无脑缺血事件)。在球囊扩张过程中,若患者出现明显脑缺血事件,则不行支架置入术;若患者未出现明显脑缺血事件,且球囊扩张后血管无明显弹性回缩或夹层,可不行支架置入术;若患者未出现明显脑缺血事件,且球囊扩张后血管存在明显弹性回缩或因内膜破损导致动脉夹层,则行支架置入术。若病变部位较短,穿支动脉少,优先选择球囊扩张支架[APOLLO;微创神通医疗科技(上海)有限公司],其他情况选择自膨支架[Enterprise 2;强生(上海)医疗器材有限公司]。经桡动脉入路血管通路建立失败,则改为经股动脉入路建立血管通路,后续手术过程与经桡动脉入路相同。
1.5 分组
根据远端通路导管的头端是否进行预塑形处理分为塑形组和未塑形组。
1.6 临床结局及随访统计
手术成功率、术后72h内神经功能缺损症状及围手术期(手术前12h至手术后3~5d)并发症发生率。手术成功定义为经桡动脉入路完成手术且血管内治疗后靶病变血管残余狭窄率<30%,且术后即刻改良脑梗死溶栓(modified thrombolysis in cerebral infarction, mTICI)分级为3级[19]。术后72h内神经功能缺损症状包括穿支闭塞、血管穿孔、血栓形成、夹层等引起的症状。围手术期并发症包括致残性卒中[20]、非致残性卒中[20]、穿刺点并发症。术后6个月随访评估是否出现支架内再狭窄及卒中复发,支架内再狭窄定义为血管内置入支架或血管成形后,在成形的血管段或其邻近区域(支架两端5mm范围内)出现管腔再次狭窄且狭窄率≥50%[21];卒中复发定义为患者在首次缺血性卒中发病后,再次发生新的脑血管事件[22]。
1.7 统计学分析
采用R4.4.2软件对数据进行统计学分析。采用Kolmogorov-Smirnov对计量资料进行正态性检验,符合正态分布的计量资料以x-±s表示,组间比较采用两独立样本t检验;不符合正态分布的计量资料以中位数和四分位数[M(P25,P75)]表示,组间比较采用Wilcoxon秩和检验;计数资料以例或例(%)表示,组间比较采用四格表χ2检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结果
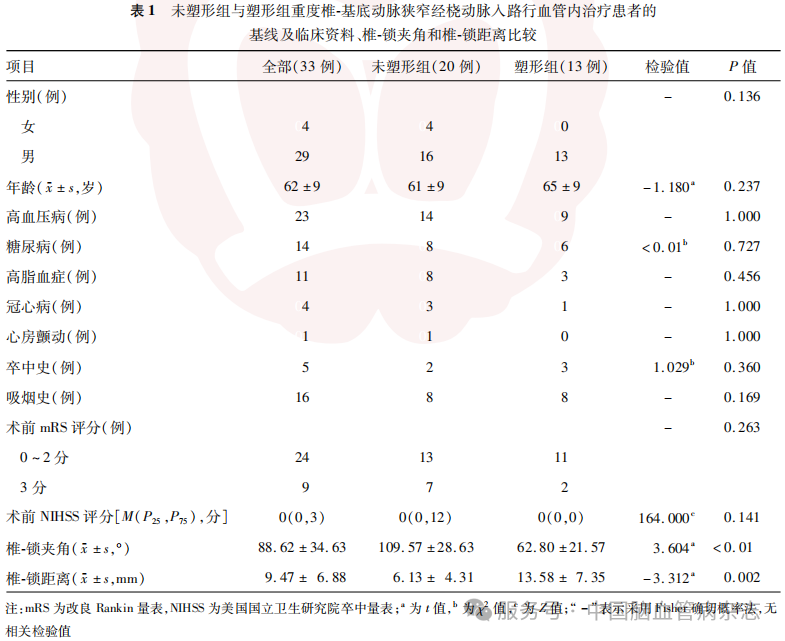
共纳入33例经桡动脉入路应用导管“裸撑”技术行重度椎-基底动脉狭窄血管内治疗的患者,男29例,女4例,年龄42~76岁,平均(62±9)岁。其中塑形组13例,未塑形组20例。
2.1 两组患者基线及临床资料、椎-锁夹角、椎-锁距离的比较
两组患者性别、年龄、高血压病、糖尿病、高脂血症、冠心病、心房颤动、卒中史、吸烟史、术前NIHSS评分及术前mRS评分的差异均无统计学意义(均P>0.05)。与未塑形组相比,塑形组患者椎-锁夹角更小、椎-锁距离更长(均P<0.05)。见表1。
2.2 手术相关信息及术后6个月随访结果
33例患者中,基底动脉狭窄27例(81.8%);靶病变血管狭窄率>90%~99%患者22例(66.7%);平均病变血管长度为(9.25±2.18)mm,其中<15mm者20例(60.6%)。采用局部麻醉完成手术者30例(90.9%),3例术中出现严重脑缺血不耐受改为全身麻醉者为存在孤立椎动脉患者。血管内治疗方式采用球囊扩张+自膨支架患者22例(66.7%),单纯球囊扩张患者8例(24.2%),球囊扩张支架患者3例(9.1%)。经桡动脉入路完成手术患者31例(93.9%),塑形组2例患者(1例椎-锁夹角36.73°,椎-锁距离25.03mm;1例椎-锁夹角43.91°,椎-锁距离23.50mm)经桡动脉入路血管通路建立困难改为经股动脉入路后成功完成手术。围手术期并发症发生率为9.1%(3/33),其中致残性卒中1例(3.0%),非致残性卒中2例(6.1%),未发生穿刺点并发症。术后6个月内发生支架内再狭窄2例(6.1%),无卒中复发。见表2。

3 讨论
规范的药物治疗、严格的危险因素管控制是重度椎-基底动脉狭窄患者的首选治疗方案,即使经过上述治疗,首次卒中后患者的卒中复发率仍高达22%~33%[23-24]。既往研究结果显示,对于强化药物治疗无效但有症状的椎-基底动脉狭窄患者,行血管内治疗是安全、可行的,且一般采用经股动脉入路[25-27]。本研究采用经桡动脉入路对重度椎-基底动脉狭窄患者进行血管内治疗,该入路无须考虑下肢血管的解剖弯曲及主动脉弓的异常解剖变异,可降低术中操作和术后护理难度,在一定程度上提升患者术后舒适度。
与既往采用全身麻醉对重度颅内动脉狭窄进行血管内治疗的研究不同,本研究中90.9%(30/33)的手术在局部麻醉下完成。在局部麻醉条件下医师可实时监测患者的神经功能(如语言能力、肌力等),并根据患者神经功能的变化及时调整治疗策略,对狭窄部位进行球囊扩张时,术者可间歇性地与患者对话或要求患者数数,并要求患者按指令活动双下肢;若患者出现言语障碍或无法按指令完成下肢活动,术者可立即停止进一步的球囊扩张。局部麻醉需患者具备良好的脑缺血耐受力,若术中发生明显脑缺血,患者可能会出现眩晕、恶心、呕吐及躁动不安等症状,影响手术安全,因此,对患者术中脑缺血耐受力的评估尤为重要。本研究对患者椎-基底动脉的解剖形态和管径进行了初步分析,包括是否存在孤立椎动脉、靶病变血管直径、狭窄程度等,结果显示,术中出现脑缺血症状者多见于孤立椎动脉供血者[45.5%(15/33)]。其中3例术中出现严重脑缺血症状的患者均为孤立椎动脉,改为全身麻醉后顺利完成手术,提示存在孤立椎动脉的患者在行局部麻醉时可能存在术中脑缺血不耐受的风险。
在泥鳅导丝、微导管和微导丝的辅助下,本研究中90.9%(30/33)的患者远端通路导管顺利到达椎动脉V3段及以上位置,与既往研究结果一致[5]。远端通路导管的高到位率为后续血管内治疗提供了支撑,有效提高了手术的成功率,但远端通路导管的高位放置可能会加剧脑缺血症状,本研究有3例(9.1%)患者在术前评估时被发现对脑缺血极为敏感,因此,术者仅将远端通路导管放置于椎动脉V2段的远端,以避免因远端通路导管高位放置所引发的严重脑缺血症状。本研究采用经桡动脉入路对重度椎-基底动脉狭窄患者进行血管内治疗,手术成功率达93.9%(31/33),2例患者经桡动脉入路通路建立困难,改为经股动脉入路后成功完成手术。影响经桡动脉入路建立血管通路的因素较多,椎-锁夹角与椎-锁距离均为其中之一。本研究结果显示,经桡动脉入路完成血管内治疗患者的椎-锁夹角为(88.62±34.63)°,椎-锁距离为(9.47±6.88)mm,且塑形组患者的椎-锁夹角更小[(62.80±21.57)°比(109.57±28.63)°,P<0.01]、椎-锁距离更长[(13.58±7.35)mm比(6.13±4.31)mm, P=0.002]。本研究部分患者可能存在椎-锁夹角过小或椎-锁距离过长的情况,通过对远端通路导管进行预塑形处理,成功建立手术通路,提示远端通路导管预塑形处理在经桡动脉入路成功建立手术通路中具有重要作用。
本研究结果显示,局部麻醉下经桡动脉入路应用导管“裸撑”技术治疗重度椎-基底动脉狭窄的围手术期致残性卒中发生率为3.0%(1/33),低于北美支架置入术治疗对比强化药物治疗预防颅内动脉狭窄卒中复发(stenting vs. Aggressive medical management for preventing recurrent stroke in intracranial stenosis, SAMMPRIS)研究中围手术期(从手术开始至术后72h内或出院)并发症(脑出血、脑梗死、穿刺部位血肿、与操作或麻醉相关的全身性并发症)的发生率[14.7%(33/224)][28]及颅内球囊扩张支架用于缺血性卒中治疗(vitesse intracranial stent study for ischemic therapy, VISSIT)试验中围手术期(手术开始至术后30d内)并发症(卒中、死亡、血管损伤、支架内急性血栓形成、支架置入失败等)的发生率[24.1%(14/58)][29];与中国血管成形及支架置入术治疗症状性重度颅内动脉狭窄(China angioplasty and stenting for symptomatic intracranial severe stenosis,CASSISS)研究[25]和Miao等[30]的有关症状性颅内动脉狭窄血管内治疗的研究结果相当,其术后30d内卒中复发和病死率分别为5.5%(21/380)和4.3%(13/300)。本研究围手术期并发症发生率较低可能与以下因素有关:(1)对SAMMPRIS研究的事后分析表明,颅内动脉狭窄行血管内治疗患者围手术期卒中复发的最常见原因是穿支事件[28],而本研究排除了由单纯穿支闭塞引起的卒中;(2)麻醉方式和手术入路的选择可能也起到了一定作用,患者出现的神经功能缺损症状可能与使用的通路导管有关,经股动脉入路患者通常使用6F长鞘或8F导引导管超选进入椎动脉,这可能导致椎-基底动脉出现血流动力学障碍,从而诱发脑缺血事件,特别是对于孤立椎动脉患者,更容易发生此类情况;(3)SAMMPRIS研究[28]和Wingspan支架系统上市后监测研究(Wingspan stent system post market surveillance, WEAVE)[31]等表明,术者的经验在颅内支架置入手术过程中也发挥至关重要的作用。
本研究显示,经桡动脉入路行重度椎-基底动脉狭窄血管内治疗患者术后6个月内支架内再狭窄发生率为6.1%(2/33),无卒中复发。一项关于症状性颅内动脉狭窄采用药物涂层支架或非药物涂层支架行血管内治疗的前瞻性多中心随机登记研究显示,与非药物涂层支架组(颅内APOLLO支架;131例)相比,药物涂层支架(颅内西罗莫司洗脱支架;132例)组术后1年内支架内再狭窄[置入支架内或紧邻支架(支架两端5mm内)的管腔直径狭窄率≥50%]率[9.5%(10/105)比30.2%(32/106), P<0.01]、症状性支架内再狭窄(与靶病变血管缺血性事件相关的支架内再狭窄)率[0比6.6%(7/106),P=0.01]、靶病变血管卒中复发率[0.8%(1/132)比6.9%(9/131),P=0.03]均更低,术后30d内任何卒中或病死率差异无统计学意义[7.6%(10/132)比5.3%(7/131),P=0.46][32]。有研究纳入159例症状性颅内动脉狭窄行血管内治疗患者,结果显示,采用自膨式支架或球囊扩张支架(裸支架)治疗患者术后1年支架内再狭窄[对于采用DSA评估的患者,置入支架内或紧邻支架(支架两端5mm内)的管腔直径狭窄率>70%;对于采用CTA评估的患者,支架段或责任血管近端和远端在CTA上无法很好地显示或存在明显的充盈缺损]率为23.4%(15/64)[33]。一项Meta分析纳入13项药物涂层支架在症状性颅内动脉狭窄血管内治疗中的应用研究,结果显示,336例患者的364个症状性颅内动脉狭窄病变采用药物涂层支架行血管内治疗后随访期间支架内再狭窄率为4.1%(95%CI: 1.6%~7.7%)[34]。本研究采用裸金属支架行椎-基底动脉狭窄血管内治疗,其支架内再狭窄率低于其他研究,可能的原因包括:(1)前循环(特别是床突上段的血管)病变更易钙化、血管更迂曲,手术操作难度增加,导致支架难以很好地贴合靶病变血管壁,更易发生支架内再狭窄[35],而本研究重度椎-基底动脉狭窄的责任血管位于后循环;(2)既往研究结果显示,症状性颅内动脉狭窄行支架置入患者的病变血管长度与术后12个月的支架内再狭窄相关,无支架内再狭窄组(52例)的病变血管长度短于支架内再狭窄组[16例;(11.1±4.8)mm比(13.5±3)mm,P<0.05][36-37],而本研究重度椎-基底动脉狭窄患者的平均病变血管长度为(9.25±2.18)mm,其中60.6%(20/33)的患者病变血管长度<15mm;(3)快速球囊扩张行血管内治疗更易引起斑块破裂和内膜损伤,诱发更强的增殖性新生内膜增生,比缓慢球囊扩张更易发生支架内再狭窄,是颅内动脉狭窄行血管内治疗患者发生支架内再狭窄的独立危险因素(OR=57.700,95% CI:5.490~530.817, P<0.01)[36,38-40],而本研究重度椎-基底动脉狭窄行血管内治疗的颅内球囊扩张方式均为缓慢球囊扩张。
4 结论
在局部麻醉下经桡动脉入路行椎-基底动脉狭窄的血管内治疗可能是安全和有效的。本研究为单中心回顾性研究,样本量小可能存在选择偏倚的不足,下一步可开展多中心前瞻性队列研究,以进一步验证本研究结果。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)