首页 > 医疗资讯/ 正文
CAR-T疗法再升级,CAR-T细胞凝聚识别低抗原表达癌细胞
CAR-T细胞疗法通过改造患者的T细胞,使其表达能够特异性识别并攻击癌细胞的嵌合抗原受体(CAR),已在血液系统恶性肿瘤治疗中取得显著成效。然而,该疗法在实体瘤治疗中效果有限,尤其是面对低抗原表达的癌细胞时,由于CAR-T细胞需要与癌细胞表面抗原结合才能激活,低抗原表达的癌细胞难以被有效识别和攻击,导致CAR-T细胞的信号传导效率低下,细胞毒性因子释放减少,杀伤活性降低。内在无序区域(IDR)是一类在蛋白质中广泛存在的区域,不具有固定的三维结构,但能通过弱的分子间和分子内相互作用形成生物分子凝聚体,富集和组织效应分子以促进细胞信号传导。
耶鲁大学苏晓磊团队构建了IDR-CAR融合蛋白,旨在增强CAR-T细胞对低抗原表达癌细胞的识别和杀伤能力,并通过体外和体内实验评估其功能,同时揭示其作用机制。相关内容以“IDR-induced CAR condensation improves the cytotoxicity of CAR-Ts against low-antigen cancers”为题发表在《Nature Chemical Biology》上。

【主要内容】
IDR-CAR融合蛋白的构建与表征
研究者们选择了FUS、EWS和TAF15等IDR,将其融合到CAR的C末端,构建了IDR-CAR融合蛋白。通过流式细胞术检测CAR的表达,发现融合IDR并未影响CAR的细胞表面表达。利用TIRF显微镜观察CAR在细胞表面的凝聚情况,结果显示FUS、EWS和TAF15 IDR显著增强了CAR的凝聚,且这种凝聚在静息和激活状态下均更为明显。此外,通过荧光恢复后光漂白(FRAP)实验发现,EWS IDR形成的凝聚体更为稳定,这表明不同IDR在CAR凝聚的稳定性和动态性上存在差异。
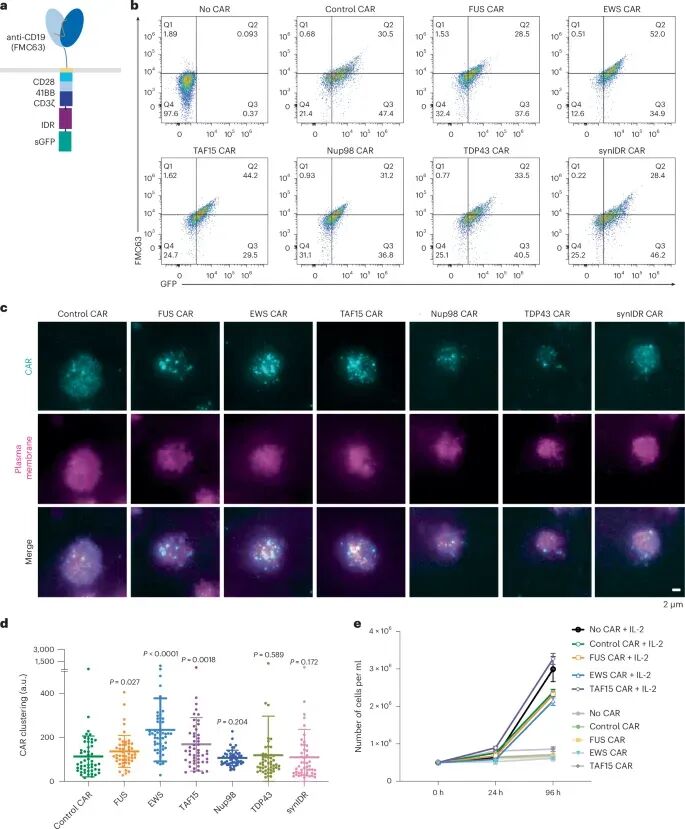
图1 IDR促进T细胞表面的CAR缩合
IDR-CAR融合蛋白对CAR-T细胞功能的影响
体外实验表明,FUS和EWS IDR-CAR-T细胞对低抗原表达的Nalm6细胞和Raji B细胞展现出更高的细胞毒性,这与它们分泌更多细胞毒性因子(如颗粒酶A、颗粒酶B、穿孔素、FasL和IFNγ)相关。在体内实验中,FUS IDR-CAR-T细胞在CD19低表达的Raji B细胞衍生的异种移植模型中表现出更好的抗肿瘤效果,且未观察到自发激活现象。此外,FUS IDR-CAR-T细胞在治疗过程中还伴随着T细胞耗竭标志物(如LAG3、PD1)表达的降低,这可能有助于维持CAR-T细胞的持久活性。
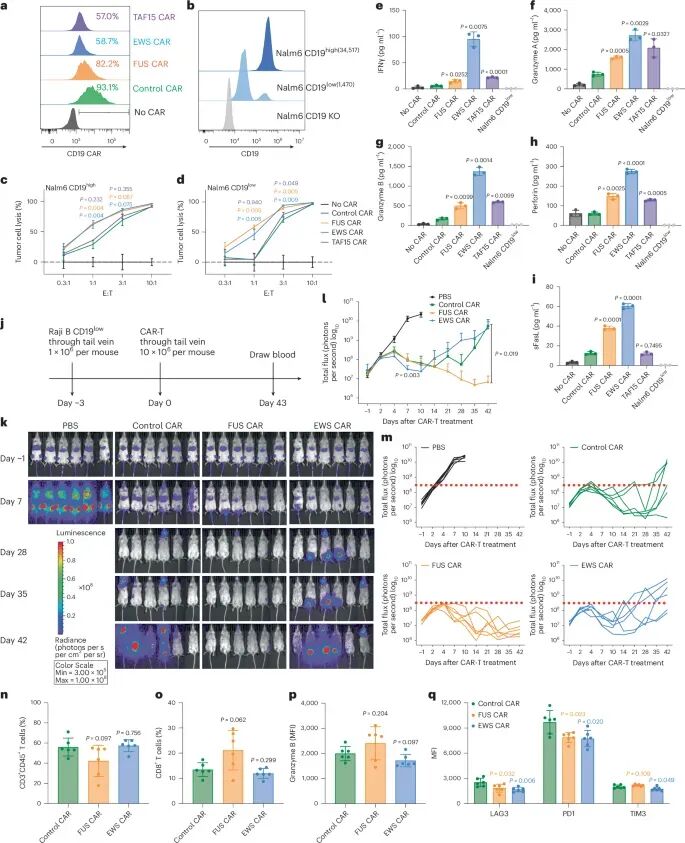
图2 IDR在体外和体内增强CD19 CAR-T的细胞毒性
IDR-CAR融合蛋白的作用机制
研究进一步探讨了IDR-CAR融合蛋白增强CAR-T细胞功能的分子机制。通过细胞共轭实验发现,IDR-CAR-T细胞与癌细胞的结合能力更强。利用z-Movi细胞粘附仪测量细胞间结合的机械强度,结果显示IDR-CAR-T细胞与癌细胞之间的结合力更强。此外,通过共聚焦显微镜观察到IDR-CAR-T细胞与癌细胞结合时,CD45(一种抑制CAR信号传导的磷酸酶)从免疫突触中排除得更彻底,这有助于增强CAR-T细胞的信号传导。在CAR-T细胞与癌细胞结合后,IDR-CAR-T细胞展现出更强的膜近端信号传导,包括CD3ζ和LAT的磷酸化,这表明IDR通过促进CAR-T细胞与癌细胞的结合、增强免疫突触的形成和信号传导,从而提高了CAR-T细胞对低抗原表达癌细胞的识别和杀伤能力。
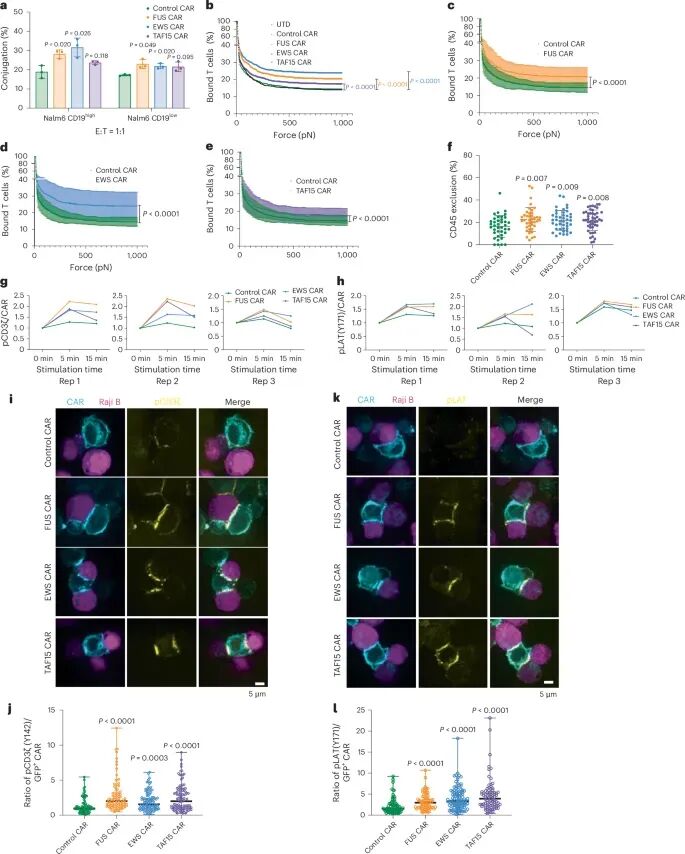
图3 IDR促进CAR-T突触的形成、机械强度和信号传导
【全文总结】
本研究表明IDR-CAR融合蛋白能够显著增强CAR-T细胞对低抗原表达癌细胞的识别和杀伤能力,其作用机制涉及促进CAR的凝聚、增强CAR-T细胞与癌细胞的结合、提高免疫突触的形成和信号传导效率。
原文链接:
https://doi.org/10.1038/s41589-025-02031-x
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)