首页 > 医疗资讯/ 正文
急性心肌梗死(MI)以心肌丧失和胶原蛋白疤痕修复为特征,仍然是全世界死亡的主要原因,并构成了巨大的社会经济负担。越来越多的临床前和临床研究表明,心脏能量代谢功能障碍是心肌细胞损伤的起始环节,也是导致心功能障碍的重要因素。PYGM(肌糖原磷酸化酶)是糖原磷酸化酶家族的成员,广泛表达在肌肉以外的各种组织中,例如大脑、淋巴组织、粒细胞、唾液腺和男性生殖系统,在为生物过程提供足够的能量方面发挥着至关重要的作用,然而,PYGM是否通过促进糖原分解以响应缺血引起的能量失衡和心肌损伤而参与MI的病理过程仍不清楚。
2025年9月24日,广东医科大学心血管代谢病创新中心/附属东莞松山湖中心医院/温州医科大学林灼锋、吴帆团队、广东医科大学附属医院雷桅团队合作在Circulation杂志在线发表了题为“PYGM Protects Against Myocardial Infarction by Enhancing Glycogenolysis and Facilitating Autophagic Flux”的研究论文。该研究揭示了PYGM通过激活糖原分解并促进自噬流,维持心肌能量稳态,从而对心肌梗死所致的心肌损伤发挥保护作用。

为了探讨PYGM在心肌梗死(MI)患者中的临床意义,研究团队首先招募101名受试者,包括68名MI患者和33名健康对照。采用免疫印迹法测定受试者血清PYGM水平,研究表明MI患者血清PYGM水平较健康受试者降低。相关分析显示,血清PYGM与急性MI的生物标志物血清CK(肌酸激酶)、CK-MB(肌酸激酶MB同工酶)、cTnI(心肌肌钙蛋白I)、LDH(乳酸脱氢酶)显著相关。为了进一步研究PYGM在MI中的作用,团队检测MI患者的心脏PYGM表达与健康受试者相比显著降低,与PYGM循环水平的变化一致,这些数据表明PYGM可能与MI发病机制有关。随后研究团队评估了PYGM在MI小鼠中的表达,对8至10周龄C57BL/6J小鼠进行左前降支结扎术。与假手术相比,心脏PYGM水平和GPa(糖原磷酸化酶a, 糖原磷酸化酶的一种形式)的活性分别在小鼠MI后第三天或第一天显示出下降趋势,并且在MI后第14天保持显著降低。此外,研究团队发现PYGM在正常心脏组织中高表达,但在梗死区显著降低,在梗死心脏组织的边界区域轻度降低,这些发现表明PYGM水平降低与MI引发心肌损伤密切关联。
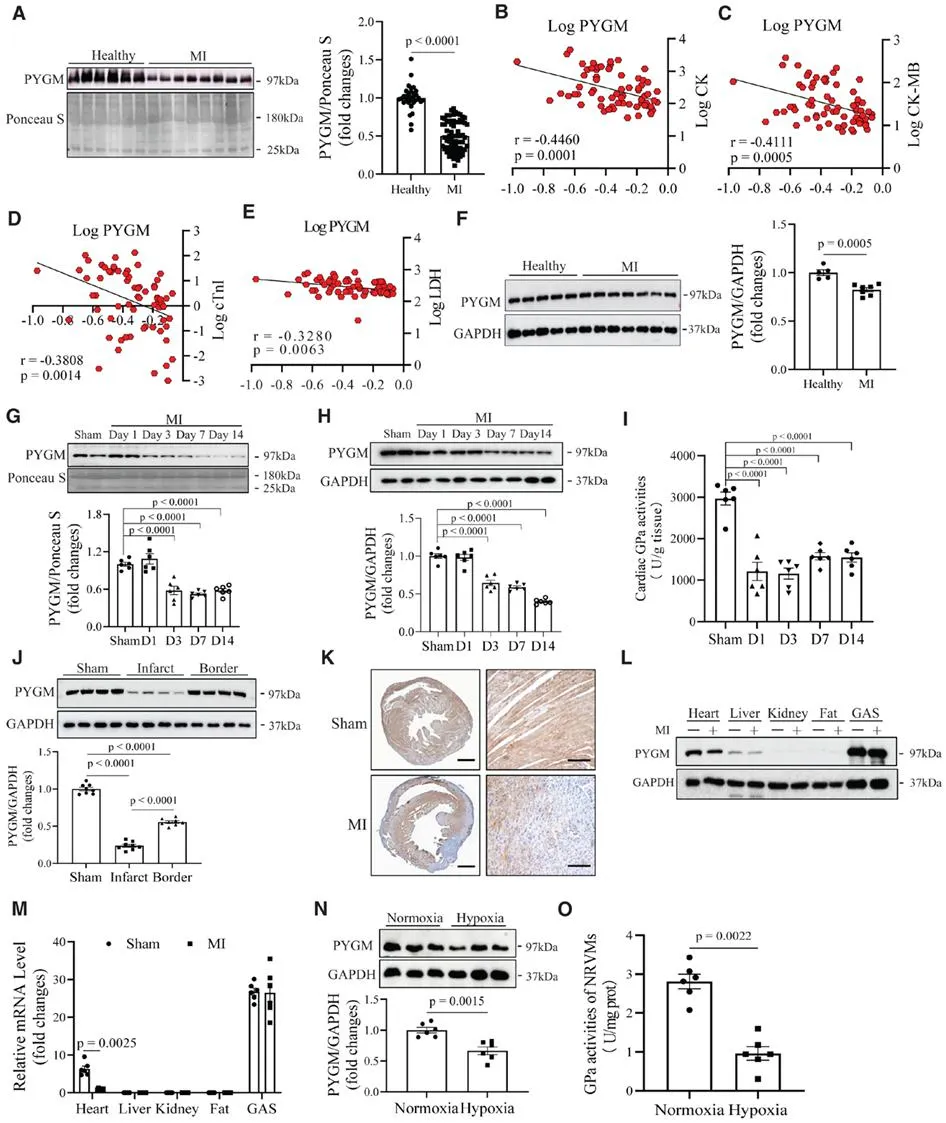
为了探究PYGM在MI中的作用,研究团队使用CRISPR/Cas9技术制备了PYGM基因敲除(KO)小鼠,发现PYGM缺失会加重MI诱导的小鼠心功能障碍和心肌损伤。为进一步探讨心源性PYGM是否具有保护作用,在MI或假手术前,将6周龄的C57/BL6J雄性小鼠通过尾静脉注射AAV9-cTNT-shNC或AAV9-cTNT-shPYGM进行预处理4周,AAV9-cTNT-shPYGM的给药特异性阻断了PYGM在心脏中的表达,结果表明,心肌细胞特异性沉默PYGM会显著加重MI引起的心肌损伤。为评估补充PYGM是否可以减轻MI引起的心肌损伤,在MI术后2周,AAV介导的PYGM (AAV-PYGM)处理的小鼠比AAV9-GFP处理的小鼠具有更高的循环PYGM水平和存活率,结果表明,补充PYGM可以改善MI引起的小鼠心脏功能障碍和损伤。由于糖原是葡萄糖的主要储存形式,因此通过口服高糖饲喂法给予糖原,以评估MI小鼠糖原的代谢命运。糖原治疗显著升高心脏中的丙酮酸水平和烟酰胺腺嘌呤核苷磷酸化酶(NADPH)/烟酰胺腺嘌呤二核苷磷酸(NADP+)的氧化形式,降低谷胱甘肽(GSH)/氧化谷胱甘肽比率,上调心脏ATP的产生,进一步改善心肌梗死引起的心功能障碍和损伤。数据表明,糖原对MI具有有益作用,可能与缺血应激下的糖原分解有关。
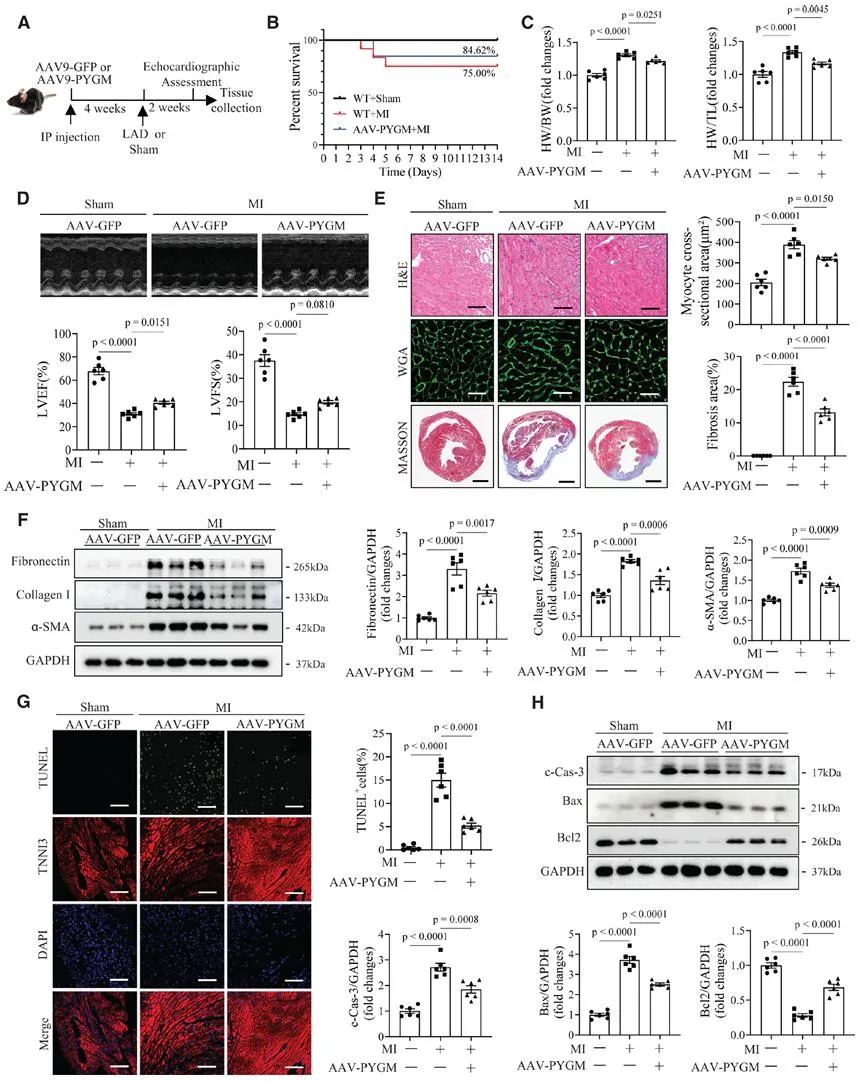
鉴于PYGM是糖原分解的第一种限速酶,它在维持心肌细胞响应缺血的能量稳态中起着关键作用。糖原含量测定的心源糖原含量在MI后6小时显著增加,并在MI后7天保持在较高水平,但在MI后14天显著下降,提示PYGM对MI诱导的心肌损伤的保护效应可能是通过触发糖酵解途径介导。考虑到糖原分解还通过激活戊糖磷酸途径(PPP)介导的NADPH产生在维持氧化还原稳态中起着至关重要的作用,团队发现PYGM对MI的保护作用可能与激活PPP有关,而PYGM对MI引发的心肌保护作用是通过激活糖酵解和PPP介导的。
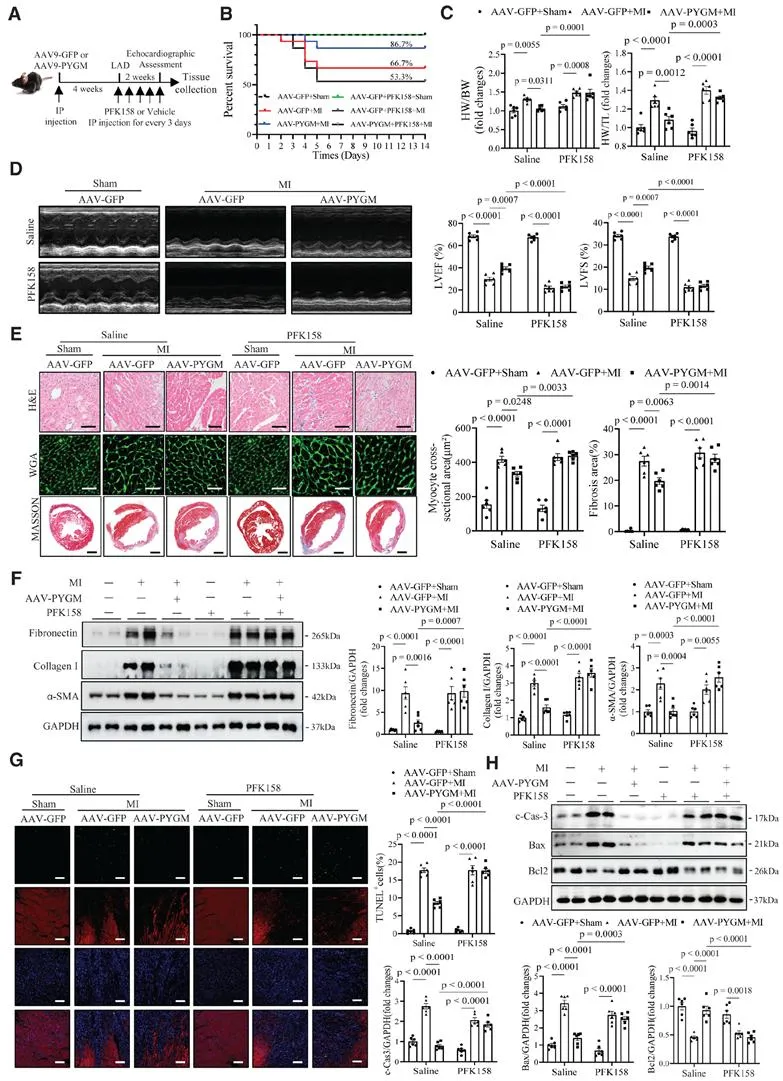
为深入探究PYGM预防MI相关心肌损伤的机制,研究团队采用主成分分析法对心脏蛋白质表达谱分析显示,PYGM KO和WT心梗小鼠心脏组织差异表达蛋白主要富集在吞噬体通路和核糖体通路。值得注意的是,与WT对照组相比,PYGM KO小鼠心脏中MI诱导的自噬流障碍明显加剧。另一方面,当用AAV-PYGM干预后,MI诱导的自噬相关变化得以逆转,这表明PYGM预防MI心肌损伤的有益作用可能与改善心脏自噬流有关。为进一步验证PYGM是否通过激活自噬流发挥对MI心肌损伤的保护作用,研究团队对6周龄ATG5flox/flox小鼠及ATG5flox/flox-Myh6-Cre小鼠经尾静脉注射AAV-cTNT-PYGM或AAV-cTNT-GFP,干预4周后构建MI模型,发现自噬是PYGM发挥抗MI心肌损伤有益效应所不可或缺的机制。
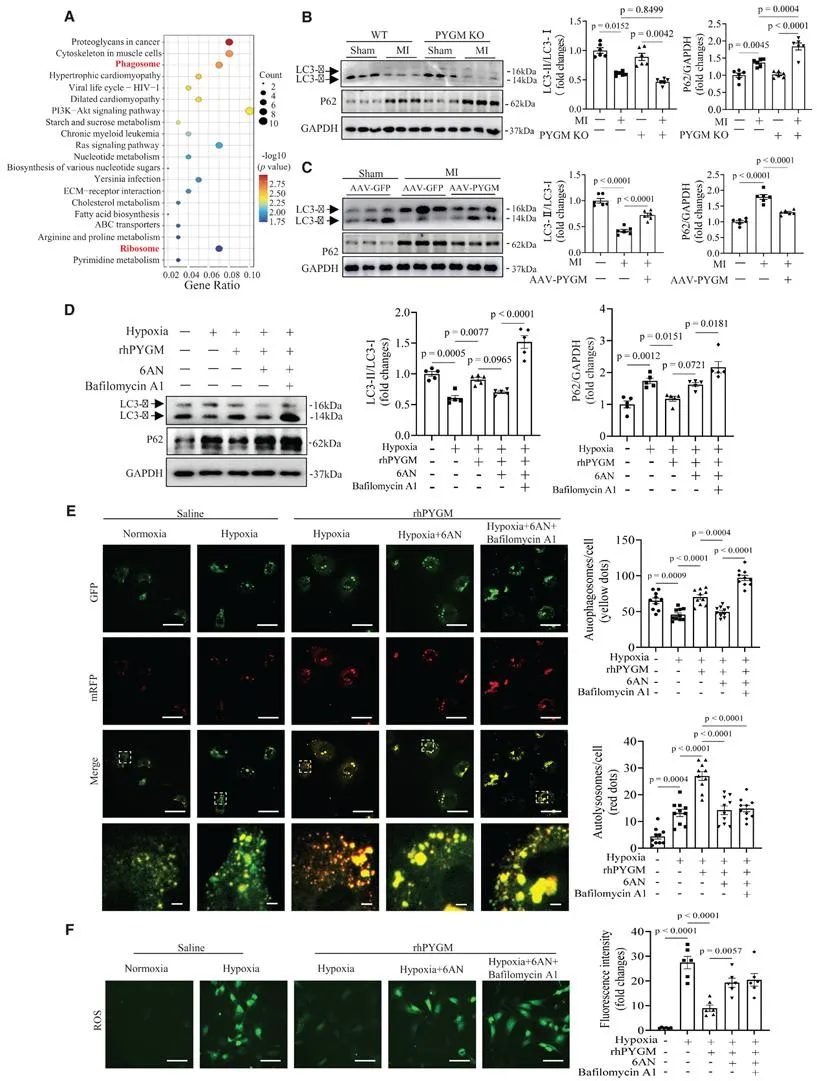
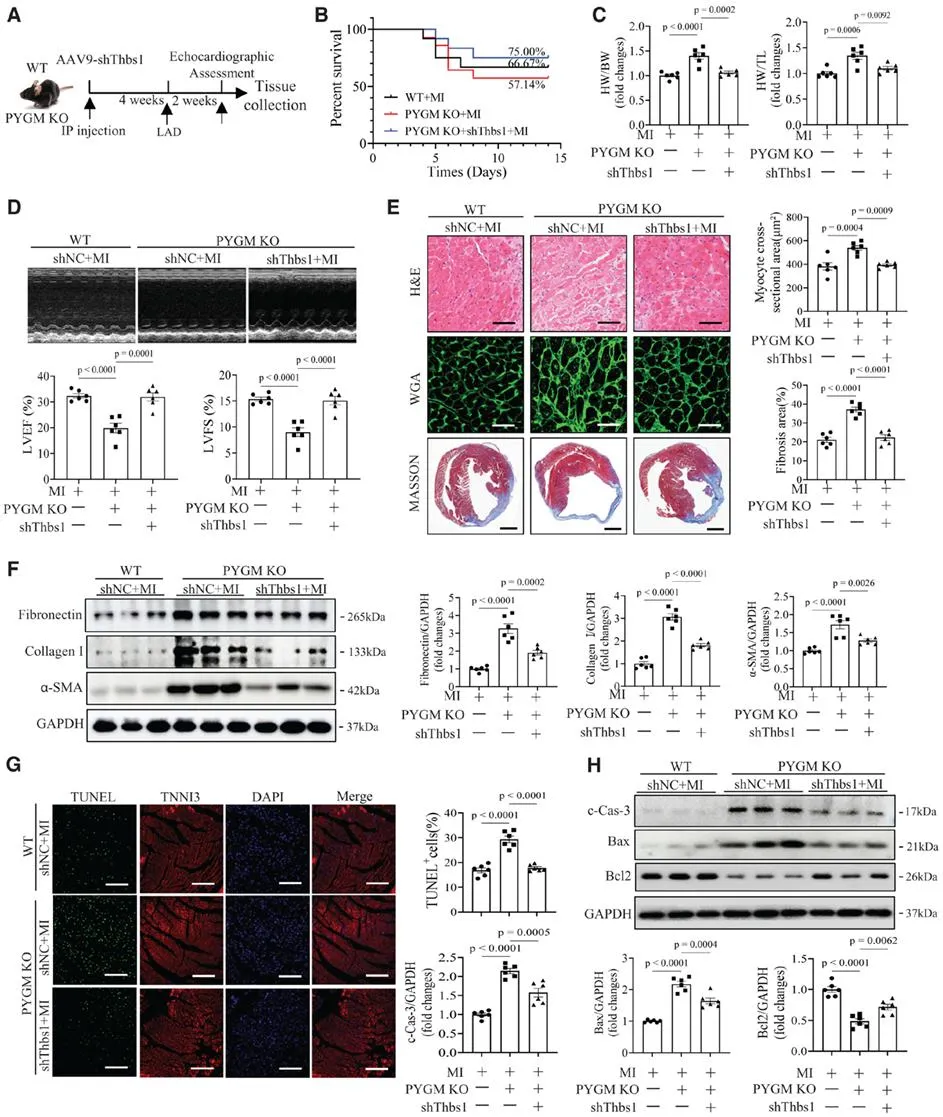
为深入探究PYGM激活自噬的机制,研究团队进一步研究发现Thbs1/TSP1(血小板反应蛋白-1)可能是介导PYGM在MI中发挥作用的下游靶点之一。为深入探讨Thbs1在PYGM预防心肌梗死心肌损伤中的作用,研究团队在PYGM基因敲除(PYGM-null)小鼠发生MI前,通过给予AAV-shThbs1以敲低其心脏Thbs1表达。发现AAV-shThbs1干预降低心脏纤维连接蛋白、胶原蛋白I及α-SMA蛋白表达水平,抑制心肌细胞凋亡及凋亡相关蛋白c-Cas-3与Bax表达,同时上调Bcl-2表达,提示Thbs1是PYGM发挥抗MI心肌损伤保护作用的一个下游负性调控因子。
鉴于PI3K(磷脂酰肌醇3-激酶)/AKT(蛋白激酶B)/GSK3β(糖原合成酶激酶-3β)信号通路参与糖原自噬,研究团队进一步探究PYGM-Thbs1轴是否与PI3K-Akt信号激活相关。在原代新生大鼠心室肌细胞中联合使用rhPYGM与AKT抑制剂MK2206,rhPYGM处理可剂量依赖性地显著上调p-AKT与p-GSK3β水平,并明显降低Thbs1表达,而MK2206则强烈逆转上述效应,发现PYGM的MI保护作用可能与激活PI3K-AKT信号及抑制Thbs1表达有关。
综上,该研究首次系统揭示了PYGM在MI中的保护作用及其通过“糖原分解—能量代谢—自噬流”多维通路调控心肌损伤的新机制,不仅深化了对心脏代谢适应机制的理解,也为临床干预MI提供了新的理论依据和潜在治疗靶点。
该研究的第一作者为广东医科大学甘静博士、温州医科大学药学院赵如意博士生和甄东博士。该项目得到了国家重点研发计划(2020YFA0803801, 2023ZD0503102)和国家自然基金青年A类项目(81925004)的资助。
论文链接:
https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.124.072312
猜你喜欢
- 肝硬化喜欢这三类人,这两个部位会呈现肝硬化的早期症状
- 嘴上一颗“黑痣”,肚里埋着“炸弹”?因为肠内息肉,她差点被拖进手术室!
- 多喝花茶作健康靓丽的完美女性
- 《柳叶刀》| 陆舜、莫树锦、姚文秀教授团队:Adagrasib显著改善KRAS G12C突变晚期NSCLC患者无进展生存期
- 夫妻生活中该注意什么?夫妻生活八忌要记牢
- Nature子刊:T-DM1后使用T-Dxd仍保持活性(DESTINY-Breast02试验)
- 检测指标不适合免疫治疗的多处转移癌症患者,用PD-1后全部病灶消失,生存8年多了
- 消化性溃疡在临床上的特点以及治疗方法
- 夫妻睡房有这东西赶紧扔掉
- 全球首家获CFDA许可,揭秘华大基因
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)