首页 > 医疗资讯/ 正文
林奇综合征(LS)是最常见的遗传性疾病,可使个体易患结直肠癌(CRC)。它由DNA错配修复(MMR)基因的胚系缺陷引起,这些基因对维持基因组完整性至关重要。本文证明在CRC先证者的结肠肿瘤组织中,MMR基因MLH1和PMS2的表达显著降低,这可能是由于LS病例中MLH1基因的遗传性突变所致。研究人员在MLH1基因中发现了一个此前未报道的框内缺失突变,由于其在肿瘤发生中的作用不明确,该突变被归类为意义未明的变异(VUS)。大多数功能失活突变体位于苯丙氨酸614至赖氨酸617残基处,这些残基形成关键的氢键。综上所述,本文数据揭示了该突变与LS相关肿瘤易感性增加之间的相关性。这项研究为评估MLH1突变携带者的癌症易感性提供了宝贵的见解,并可能阐明MLH1在肿瘤发生中的功能作用。
背 景
遗传性癌症综合征通常以终生对多种癌症的易感性显著增加为特征,常于年轻时发病。识别和检测具有特定遗传性癌症倾向的个体对患者及其家属具有深远意义。此类识别可为癌症风险提供专业咨询,详细说明各种监测方式、最佳监测时机以及预防性手术选择的考虑。林奇综合征(LS),也称为遗传性非息肉病性结直肠癌(HNPCC),是一种常染色体显性遗传疾病,终生患结直肠癌和子宫内膜癌的风险较高,约每 300 人中就有 1 人受其影响。林奇综合征是遗传性结直肠癌(CRC)最常见的病因。鉴于结直肠癌的可预防性,建议确诊为林奇综合征的个体进行早期和定期结肠镜筛查以有效监测。癌症风险增加归因于错配修复(MMR)基因的超突变,这是由错配修复缺陷导致的。受损的错配修复系统会削弱DNA复制过程中纠正碱基对错配的能力,导致突变积累。
林奇综合征的诊断通常包括对一种错配修复基因胚系突变的鉴定,这些基因包括MLH1、MSH2(EpCAM)、MSH6和PMS2。研究表明,60-80% 的林奇综合征相关癌症由MLH1或MSH2基因突变引起。其余病例可归因于MSH6或PMS2基因的改变。错配修复缺陷(dMMR)可由点突变、缺失或表观遗传机制(如通过DNA甲基化沉默特定错配修复启动子)引起。必需蛋白质的缺失或突变修复蛋白的存在会破坏功能性修复起始复合物的组装。MLH1与PMS1或PMS2相互作用,形成异二聚体MutLβ和MutLα,进而与异二聚体MSH2/MSH6或MSH2/MSH3结合。MLH1和MSH2中的许多突变会损害各种蛋白质复合物的组装,导致无法承受遗传毒性应激情况。此外,导致蛋白质截断和改变高度保守区域内氨基酸(AA)残基的变异通常被归类为致病性变异。在林奇综合征的基因诊断中,功能分析对于解释MLH1变异的致病性至关重要。
本研究采用靶向区域捕获方法结合下一代测序(NGS)技术,分析了受试者中与遗传性肿瘤相关基因的外显子及相邻 20 bp内含子区域的变异。这些变异包括 20 bp内的点突变和插入/缺失。通过这项检测,研究人员发现一个新的MLH1突变——一种此前未报道的MLH1框内缺失突变。此外,研究人员分析了功能丧失变异在MLH1蛋白三维结构上的分布,以预测MLH1变异的致病性,并阐明MLH1功能缺陷的结构基础。
病 例
患者女,24 岁,先证者,被诊断为横结肠癌。2018 年 3 月,在先证者横结肠中检测到一个大小约 8×5.5×4.7 cm的肿瘤。组织学分析证实该肿瘤为腺癌,已延伸至小肠中段,分期为T4bN2M1b,提示疾病已进入晚期。先证者还伴有中度贫血、慢性肺部炎症和营养不良。如图1所示,对先证者结直肠肿瘤组织的H&E染色显示出恶性肿瘤进展的特征。研究表明,MMR蛋白的免疫组化分析是检测MMR蛋白异常最有效、最敏感的筛查方法之一。因此,免疫组化分析显示肿瘤组织中MMR蛋白MLH1和PMS2表达缺失。由于MLH1和PMS2蛋白形成稳定的异二聚体并发挥功能,它们的同时缺失通常提示胚系MLH1突变,这与LS相关的CRC尤其相关。
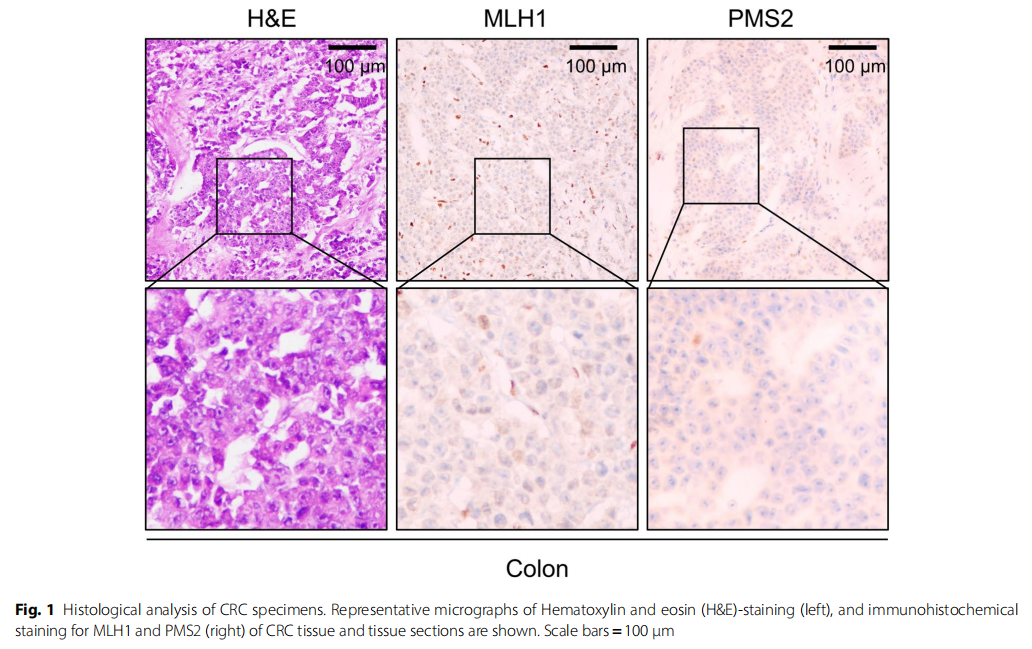
▲图1 CRC样本的组织学结果
为确定MLH1基因突变详情,采用下一代测序(NGS)技术检测了先证者中与遗传性结直肠癌相关基因的外显子及相邻 20 bp内含子区域的变异。结果显示,MLH1基因存在框内缺失突变(c.1840_1851delTTTCTGAAGAAG),导致编码蛋白的614至617位氨基酸缺失。与NGS结果一致,Sanger测序证实了MLH1基因框内缺失突变的存在(图2A)。NGS还在先证者母亲中检测到相同的框内缺失,其母亲有子宫内膜癌伴宫颈浸润病史(图2B和C)。对母亲的子宫内膜癌组织进行免疫组化分析显示,MLH1和PMS2蛋白表达同时缺失(图2C),证实错配修复通路的功能缺陷直接归因于已确认的MLH1变异。在先证者的家族谱系中,II-4和II-7号个体存在胃肠道息肉,II-5号个体曾因子宫癌前病变接受切除术以预防癌症发生。这些观察结果提示潜在的家族遗传倾向(图3)。然而,该突变的功能研究或临床意义尚未见报道,其在大规模基因组数据库中的频率也未被记录。研究人员系统查询了ClinVar、LOVD、HGMD和Ensembl等主要基因组资源,均未发现c.1840_1851del变异,证实其为新发变异,无人群频率记录。因此,根据美国医学遗传学学会(ACMG)的标准和指南,该突变被归类为意义未明的变异(VUS)。其与癌症风险的潜在相关性仍不明确,需进一步研究。
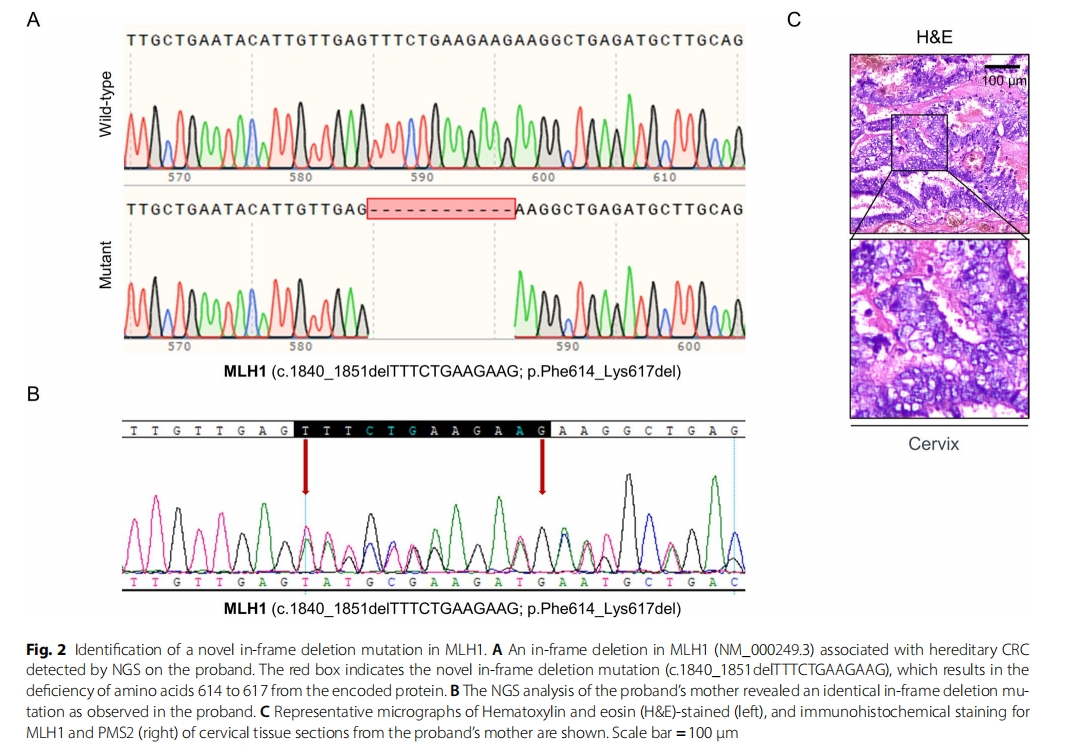
▲图2 MLH1基因检出一个新型框内缺失突变
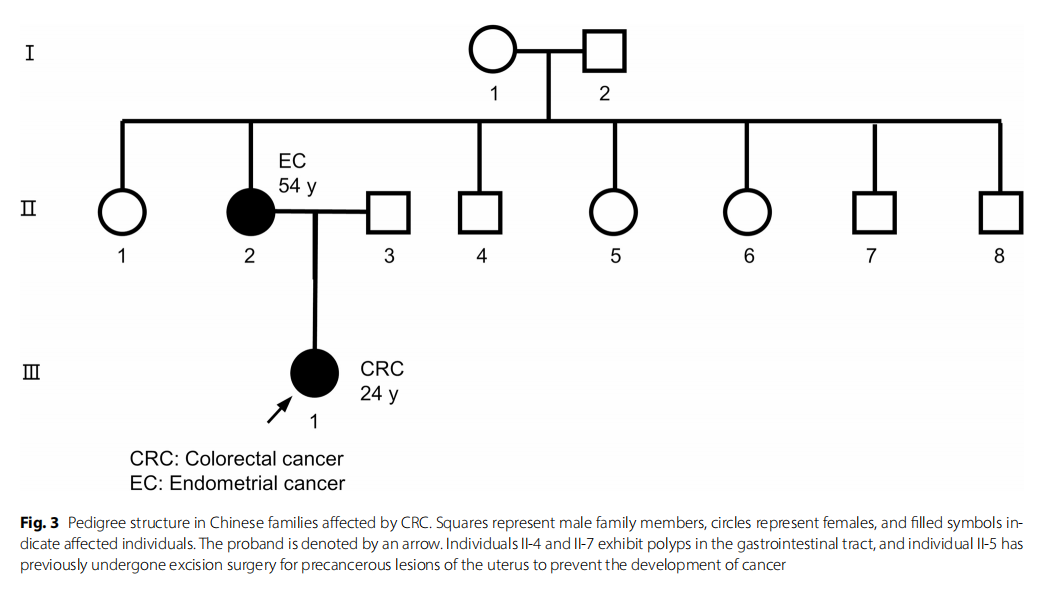
▲图3 患者家系
为阐明MLH1变异的功能-结构关系,首先从AlphaFold蛋白质结构数据库构建了MLH1蛋白的预测三维结构模型(图4A)。MLH1基因(NM_000249.3)包含 19 个编码外显子,编码由 756 个氨基酸组成的蛋白质。在AlphaFold预测结构中,Phe614至Lys617氨基酸的置信度评分均高于 90,表明结构预测的可靠性较高。如图4B所示,野生型序列中Phe614至Lys617残基与Tyr610、Val612、Lys618、Ala619和Glu632位残基形成氢键。当发生Phe614至Lys617缺失突变后,野生型蛋白的天然螺旋结构被破坏,导致初始区域的氢键相互作用消失(图4C)。这些发现表明,MLH1蛋白中这些氨基酸的缺失会诱导结构改变,可能与肿瘤发生相关。
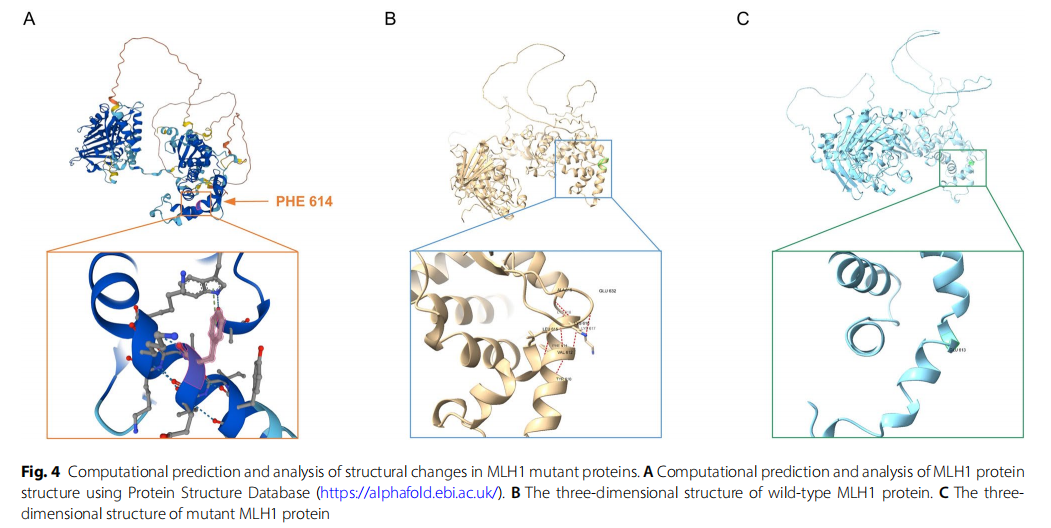
▲图4 MLH1突变蛋白结构变化的计算预测与分析
为评估MLH1基因突变对其表达水平的影响,研究人员首先构建了携带MLH1野生型(MLH1-Wt)、MLH1突变型(MLH1-Mut)和PMS2野生型(PMS2-Wt)序列的质粒(图5A和B)。随后,将编码MLH1-Wt、MLH1-Mut或PMS2-Wt的质粒分别瞬时转染至HEK-293T细胞。通过qRT-PCR和蛋白质印迹分析验证转染相应质粒后HEK-293T细胞中MLH1和PMS2基因的过表达(图5C和E)。此外,与野生型相比,MLH1变异体的蛋白表达水平降低,但在mRNA水平上未观察到显著差异。已知MLH1和PMS2蛋白可形成具有功能意义的稳定异二聚体,因此研究人员进一步研究了这两种蛋白之间的相互作用。如图5F所示,免疫共沉淀实验显示MLH1可与PMS2在HEK-293T细胞中发生物理相互作用;然而,MLH1突变导致其与PMS2的相互作用显著减弱。综上所述,这些结果表明PMS2蛋白的稳定性依赖于其与MLH1的结合,而MLH1的框内缺失突变(c.1840_1851del)会减弱这种相互作用。
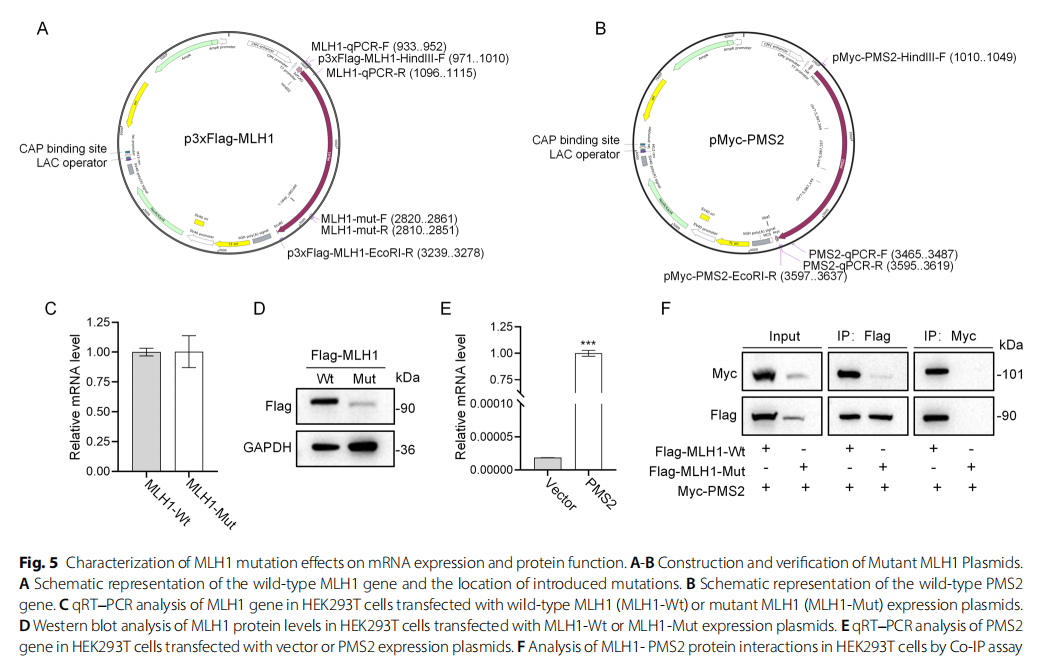
▲图5 MLH1突变对mRNA表达和蛋白质功能影响
讨 论
结直肠癌(CRC)被认为是林奇综合征(LS)中最主要的恶性肿瘤。此外,LS患者发生多种肠外癌症的风险升高,包括子宫内膜癌、小肠癌、尿路上皮癌和肾盂癌、胃癌、肝胆癌及卵巢癌。LS主要由DNA错配修复(MMR)基因的胚系突变引起,这些基因通过纠正复制错误(尤其是碱基对错配和单核苷酸重复序列的插入或缺失)在维持基因组完整性中发挥关键作用。LS的诊断通常始于对肿瘤组织的评估,以检测MMR蛋白缺陷。本研究发现,CRC先证者的结肠肿瘤组织中MMR基因MLH1和PMS2表达缺失。MLH1和PMS2蛋白形成稳定的异二聚体并发挥功能,二者表达的同时缺失提示MLH1基因存在潜在改变,在LS相关病例中可归因于MLH1基因的胚系突变。
在这种情况下,进一步的胚系基因检测是必要的。研究人员采用靶向区域捕获结合下一代测序(NGS)技术,分析了受试者中与遗传性肿瘤相关基因的变异,发现了MLH1基因中一个此前未报道的新型框内缺失突变(c.1840_1851delTTTCTGAAGAAG),导致编码蛋白的614至617位氨基酸缺失。与我们的发现一致,NGS在先证者母亲的MLH1基因中也检测到相同的框内缺失突变,提示潜在的家族遗传倾向。AlphaFold是一种先进的计算工具,可基于氨基酸序列准确预测蛋白质的三维结构。研究人员通过AlphaFold分析发现,MLH1蛋白中Phe614至Lys617位氨基酸的框内缺失突变诱导了结构改变,可能与肿瘤发生相关。然而,该突变缺乏已报道的功能研究和临床相关性,在基因组数据库中的 prevalence未被记录。因此,根据美国医学遗传学学会(ACMG)的标准和指南,它被归类为意义未明的变异(VUS),与肿瘤发生的关联尚不清楚。
关键的一点是,MLH1蛋白中的氨基酸缺失(p.Phe614_Lys617del)同时影响蛋白表达水平和功能。本研究评估了MLH1基因框内缺失突变的功能意义,这是一种此前未经过功能测定的变异。通过AlphaFold预测,研究人员阐明了MLH1蛋白功能缺陷的结构基础。结果显示,与野生型相比,MLH1变异的蛋白表达显著降低,但mRNA水平无显著差异。此外,该突变显著减弱了MLH1与PMS2的物理相互作用,影响PMS2蛋白的稳定性。
MLH1是DNA错配修复系统的关键组成部分。MLH1及其他MMR基因的突变导致突变负荷增加和微卫星不稳定性,这被认为是CRC和LS的关键驱动因素。尽管MLH1基因突变(c.1840_1851delTTTCTGAAGAAG)目前被归类为VUS,但本文研究表明,该突变与LS相关肿瘤的易感性增加存在明确关联,尤其是在年轻发病的先证者中。框内缺失导致MLH1蛋白不稳定且易降解,进一步损害PMS2的稳定性,从而促进LS的发生。这些遗传改变破坏了DNA复制和修复系统,导致基因组不稳定性和癌症易感性增加,因此被归类为致病性变异。
综上,本研究通过基因检测与功能实验相结合的方法,检出MLH1基因的一个框内缺失突变,并阐明了该突变的功能改变。研究证实,大部分功能失活突变位于Phe614至Lys617位残基,这些残基与其他残基存在氢键相互作用。数据表明,该突变与LS相关肿瘤易感性升高显著相关,因此将MLH1基因突变归类为致病性变异。本研究为评估携带MLH1突变个体及家族的癌症易感性提供了有价值的见解,可能有助于阐明MLH1在癌症发生中的功能作用,所呈现的数据或可为MLH1变异携带者的临床风险分层策略和个性化监测方案提供参考。
参考文献:
Lin, X., Bian, C., Liang, D. et al. An in-frame deletion mutation in MLH1 drives Lynch syndrome-associated colorectal cancer. BMC Cancer 25, 1165 (2025). https://doi.org/10.1186/s12885-025-14554-6
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)