首页 > 医疗资讯/ 正文
摘 要
目的 分析感染性心内膜炎外科治疗的预后及其影响因素,比较不同手术方式的术后早期和远期疗效。方法 回顾性纳入2010—2022年北京安贞医院心脏外科行瓣膜置换术或成形术的感染性心内膜炎患者,分析患者的临床资料。 结果 共纳入患者343例,其中机械瓣膜置换术197例、生物瓣膜置换术62例、瓣膜成形术84例。男238例、女105例,平均年龄(44.2±14.8)岁。200例(58.3%)感染性心内膜炎患者(76例主动脉瓣、108例二尖瓣和16例右心瓣膜)仅有单个瓣膜受累。143例(41.7%)感染性心内膜炎患者有多个瓣膜受累。60例(17.5%)患者术前有栓塞事件,其中脑栓塞32例。平均随访(60.6±43.8)个月,术后1个月内早期死亡17例(5.0%)、远期死亡19例(5.5%)。术后8例(2.3%)患者进行透析,13例(3.8%)患者发生脑卒中,6例患者再次手术,3例患者感染性心内膜炎复发。多因素分析表明,吸烟(P=0.002)、术前栓塞事件(P=0.001)、手术时间(P=0.001)、术后透析(P=0.001)是术后早期死亡的危险因素,左室射血分数≥60%(P=0.022)是术后早期死亡的保护因素。术前纽约心脏协会心功能分级Ⅲ~Ⅳ级(P=0.010)、≥3个瓣膜手术(P=0.028)是术后远期死亡的危险因素,瓣膜成形术的次要终点事件发生率明显低于瓣膜置换术。结论 对于感染性心内膜炎患者,吸烟和术前发生栓塞事件与高围手术期死亡率相关,多瓣膜手术与较差的预后相关,瓣膜成形比瓣膜置换更有优势,在感染性心内膜炎患者的外科治疗中应积极尝试瓣膜成形术。
正 文
感染性心内膜炎(infective endocarditis,IE)是临床上相对少见的心脏疾病,总发病率相对较低,约为5/10万[1]。但IE是一种非常严重的疾病,尽管在诊断和治疗方面取得了进展,住院死亡率仍高达15%~30%[2]。IE的治疗主要包括积极的药物治疗和早期手术治疗[3-5]。Meta分析[6-7]结果提示,早期手术可显著降低IE患者的死亡风险,国际指南[8]推荐IE出现难治性感染、耐药菌感染、大的赘生物、反复栓塞、瓣膜毁损引起心力衰竭等情况时应尽早手术,并根据患者情况制定个性化手术方案,但尚无具体手术方式推荐。因此,目前IE的手术方式大多依照其他瓣膜病(如风湿性/退行性瓣膜病)的标准进行选择。国外多项回顾性研究[9-11]显示,与瓣膜置换相比,瓣膜成形可为IE患者带来更好的预后。与以上这些针对某个瓣膜手术(如二尖瓣)的IE研究不同,梅奥诊所一项包含各个瓣膜手术的IE研究[12]显示,机械瓣膜与长期生存率相关。此外,IE术后死亡率较高,缺乏有效的术前预测模型。国内IE外科治疗相关研究较少,从现有的资料可知,国内心脏外科医师对IE导致瓣膜毁损的成形比较排斥,瓣膜成形率远低于国外[13]。本研究对接受手术治疗的IE患者进行最长达12年的随访,探索了术后早期和远期预后的影响因素并比较不同手术方式的临床疗效。
1 资料与方法
1.1 临床资料
回顾性纳入2010—2022年在北京安贞医院瓣膜心脏外科行心脏瓣膜手术的IE患者。纳入标准:(1)年龄不限;(2)明确诊断IE并行瓣膜置换术和/或瓣膜成形术患者。排除标准:接受肋间小切口、胸腔镜、手术机器人等非传统正中开胸术式。所有患者手术均在全身麻醉低温体外循环下进行,遵循IE手术的一般原则,包括尽量完全切除感染组织和适当的清创以及之后的重建或置换。IE的诊断依照最新Duke诊断标准,超声心动图评价瓣膜毁损及赘生物情况,瓣结构毁损情况包括断裂、穿孔、挛缩、脱垂、脓肿、窦道和赘生物附着。
1.2 资料收集和随访
回顾性收集患者的临床特征、检查结果、手术及围手术期情况、随访结果资料。随访采用电话、门诊复诊等方式。主要终点为死亡,次要终点为复合终点事件,包括死亡、脑卒中、感染复发、再手术。
1.3 统计学分析
采用SPSS 25.0软件进行统计学分析。服从正态分布的计量资料以均数±标准差(x±s)描述,两组间比较采用t检验;非正态分布的计量资料以中位数(上下四分位数)[M(P25,P75)]描述,组间比较采用非参数检验。分类变量以频数和百分比描述,组间比较采用χ2检验。采用logistic回归分析术后早期死亡的影响因素,采用Cox比例风险模型分析术后远期死亡的影响因素。将所有与结局变量相关的风险因素纳入单因素分析,再将P<0.2的因素纳入多因素分析,分析结果以比值比(odds ratio,OR)或风险比(hazard ratio,HR)表示。采用log-rank检验比较术后死亡率和复合终点事件发生率,并以生存曲线进行统计描述。双侧检验,P≤0.05为差异有统计学意义。
1.4 伦理审查
本研究已通过首都医科大学附属北京安贞医院医学伦理委员会审查,编号:KS2022064。
2 结果
2.1 患者一般资料
共纳入343例IE患者,其中男238例(69.4%),平均年龄(44.2±14.8)岁。共60例(17.5%)患者术前发生各系统栓塞事件,包括脑、肾、脾、肺栓塞等,其中32例(9.3%)发生脑栓塞。此外,7例患者发生多个系统的多次栓塞事件。239例(69.7%)患者术前长期发热,合并糖尿病20例(5.8%)、高血压59例(17.2%)、先天性心脏病80例(23.3%)。26例(7.6%)患者为人工瓣膜IE,手术指征包括难治性感染、耐药菌感染、大的赘生物、反复栓塞、瓣膜毁损引起心力衰竭等。145例(42.3%)患者术前纽约心脏协会(New York Heart Association,NYHA)心功能分级为Ⅲ~Ⅳ级,143例(41.7%)患者≥2个瓣膜受累,单独主动脉瓣受累患者76例(22.2%),单独二尖瓣受累患者108例(31.5%);见表1。
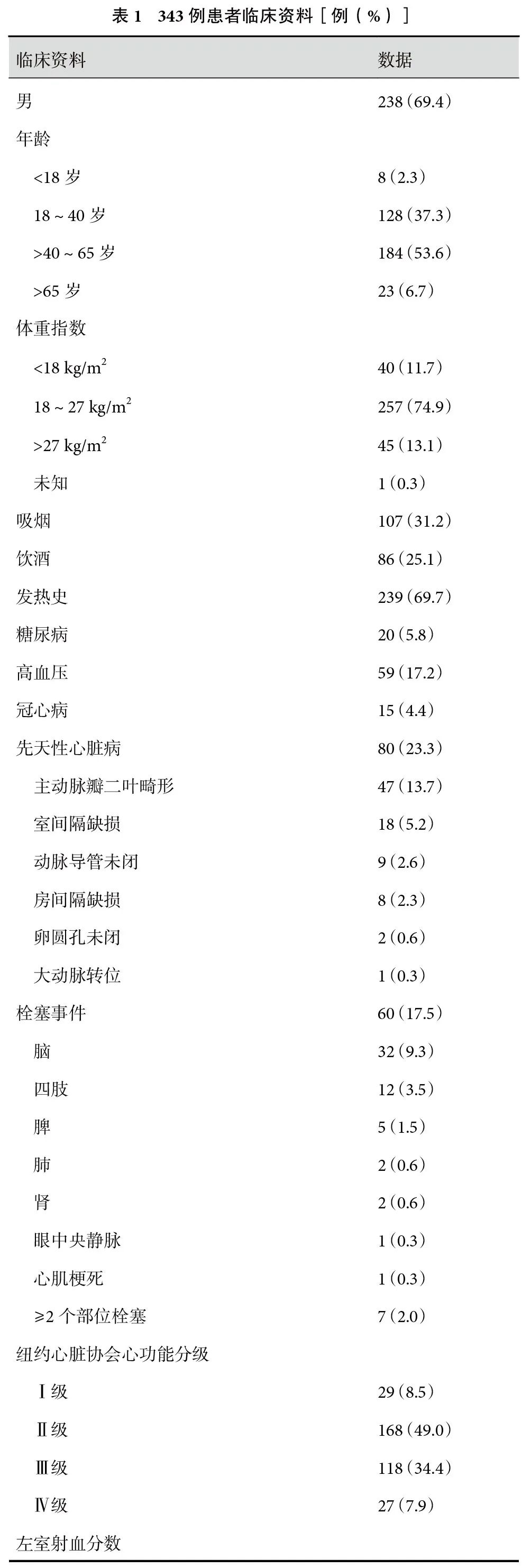

2.2 手术结果
应用最多的瓣膜手术是机械瓣瓣膜置换术(197例,57.4%),另有84例(24.5%)行单纯瓣膜成形术,62例(18.1%)行生物瓣瓣膜置换术。65例(19.0%)患者同期行非瓣膜心脏手术。平均随访时间为(60.6±43.8)个月,术后8例(2.3%)患者行透析治疗,术后1个月内早期死亡17例(5.0%)。
2.2.1 不同瓣膜手术结局比较
IE可造成心脏任一瓣膜毁损,常累及左心瓣膜即二尖瓣和主动脉瓣,较少累及右心瓣膜即三尖瓣和肺动脉瓣,不同瓣膜毁损术预后差异仍不明确。本研究比较了单纯主动脉瓣手术、单纯二尖瓣手术和单纯右心瓣膜手术的术后累计死亡率和术后复合终点事件发生率,差异无统计学意义(P>0.05);见图1a~b。
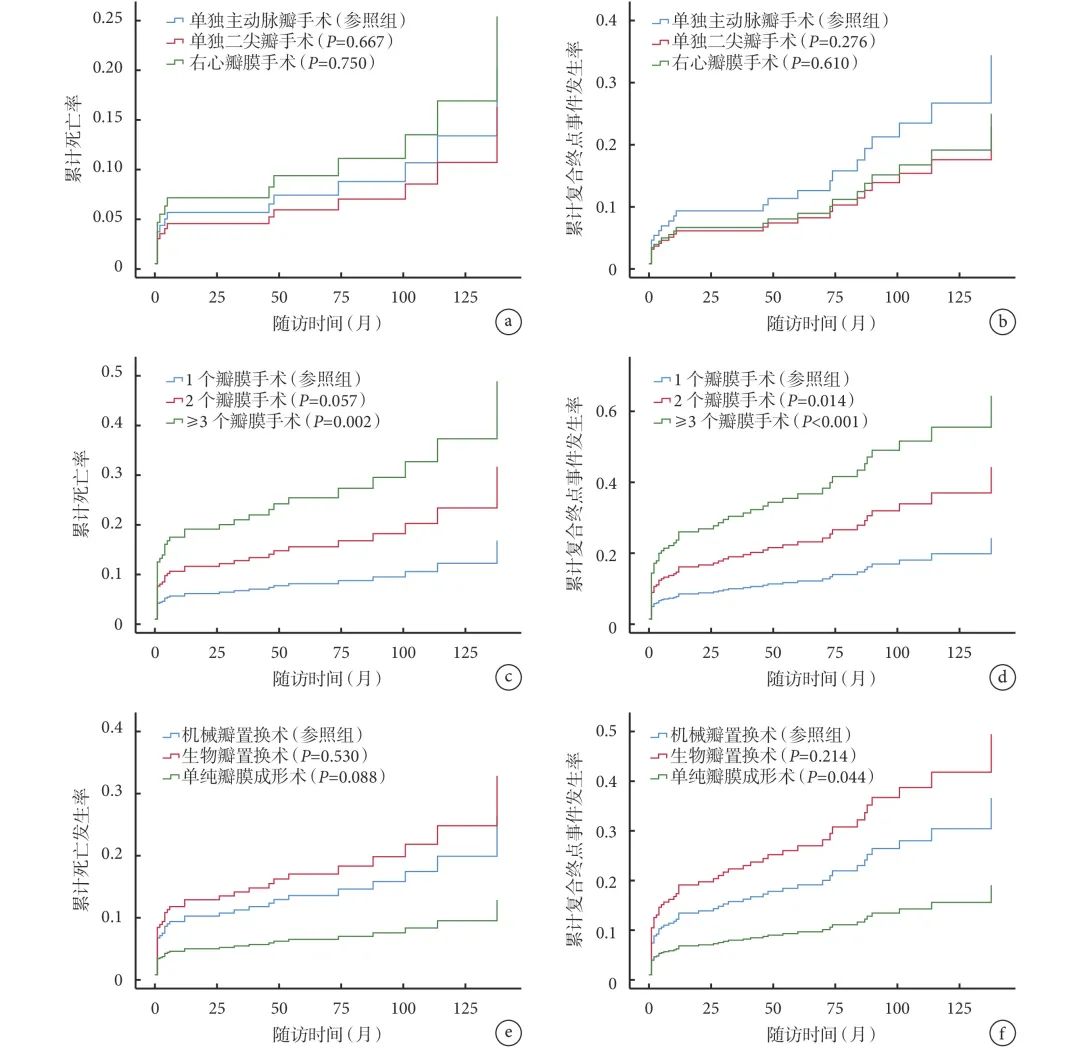
图1 术后死亡率和复合终点事件发生率
a:不同瓣膜术后累计死亡率;b:不同瓣膜术后累计复合终点事件发生率;c:不同数量瓣膜术后累计死亡率;d:不同数量瓣膜术后累计复合终点事件发生率;e:不同手术方式术后累计死亡发生率;f:不同手术方式术后累计复合终点事件发生率。
2.2.2 不同数量瓣膜的手术结局比较
IE往往更容易造成多个瓣膜的毁损,本研究中92例(26.8%)患者接受2个瓣膜的手术,50例(14.6%)患者接受3个瓣膜的手术,还有1例(0.3%)患者接受4个瓣膜的手术。结果显示多瓣膜手术的术后累计死亡率(≥3个瓣膜)和复合终点事件发生率(≥2个瓣膜)明显升高,且差异有统计学意义(P<0.05);见图1c~d。
2.2.3 不同瓣膜手术方式结局比较
343例患者中,197例(57.4%)患者使用了人工机械瓣膜,62例(18.1%)患者使用人工生物瓣膜,其余84例(24.5%)患者行单纯瓣膜成形术,未使用任何人工瓣膜。结果显示人工生物瓣膜置换术患者的累计死亡率最高,瓣膜成形术患者最低,但差异无统计学意义;见图1e。人工生物瓣膜置换术患者的复合终点事件发生率最高,瓣膜成形术患者最低,差异有统计学意义(P=0.044);见图1f。
2.3 术后早期和远期预后的影响因素
结合文献报道与临床实践将所有与结局变量相关的风险因素纳入单因素分析,然后将P<0.2的因素纳入多元logistic回归方程和Cox比例风险模型进行多因素分析。共线性检验显示方差膨胀因子<5,提示变量间不存在严重共线性。Logistic回归分析显示,吸烟(P=0.002)、术前栓塞事件(P=0.001)、手术时间(P=0.001)、术后透析(P=0.001)是术后早期死亡的危险因素,左室射血分数(left ventricular ejection fraction,LVEF)≥60%(P=0.022)是术后早期死亡的保护因素;见表2。Cox比例风险模型显示术前NYHA心功能分级Ⅲ~Ⅳ级(HR=2.391,P=0.010)、≥3个瓣膜手术(HR=4.019,P=0.028)是术后远期死亡的显著危险因素;见表3。
3 讨论
IE是一种瓣膜或非瓣膜内皮、心内人工材料的微生物感染,IE的典型病变是心内赘生物,由纤维蛋白和血小板组成,细菌和/或真菌病原体在其中增殖。此外,往往还伴有瓣膜的严重毁损[14]。因此,IE的外科治疗主要围绕瓣膜的手术干预,目前为止,IE的诊断和管理仍然存在一些挑战,总体来看IE的预后较差。尽管指南中IE手术的适应证似乎很清楚,但大部分外科医师对于IE的手术时机把握不好,临床医师只能依照其他瓣膜病(如风湿性/退行性瓣膜病)的标准对患者进行管理。显然,IE有其独特的发病机制和病理进展,其治疗方式应区别于其他瓣膜疾病,包括外科手术的时机和方式。亟待IE相关临床研究为IE的外科治疗提供经验和指导。
本研究通过对单中心接受手术的IE患者进行远期随访发现:吸烟、LVEF≥60%、术前栓塞事件、手术时间、术后透析是术后早期死亡的影响因素,其中LVEF≥60%是保护因素,然而在同一模型中合并糖尿病、高血压以及既往心脏手术都未对术后早期死亡产生影响。尽管术前反复栓塞是IE的手术适应证,但同时其也预示较差的术后早期结果。因此,外科医师应该灵活把握IE的手术指征,不应等到出现危及生命的并发症才考虑手术治疗,在IE整个进展过程中都应该考虑外科干预的可能,早期外科干预可为患者带来更佳的预后[15]。
Cox回归分析显示术前心功能差(NYHA心功能分级Ⅲ~Ⅳ级)和多个瓣膜手术是术后远期死亡的显著影响因素。不同于其他瓣膜疾病,IE可能在短时间内造成广泛的瓣膜破坏,从而导致心功能的急剧下降。本研究表明IE术前广泛瓣膜毁损特征与较差的术后远期预后显著相关,对手术瓣膜数量进行比较的结果显示,手术瓣膜数量与术后死亡率和复合终点事件发生率呈正相关。推测多瓣膜手术较差预后与其不可逆的严重心功能损伤和心脏重构相关,即使不同数量瓣膜组术前心脏泵血功能还未显现出差异或表现为同等程度的心力衰竭,但是多瓣膜毁损的患者心脏重构更加严重,而这种心脏重构与术后心力衰竭的发生和远期预后相关[16]。然而指南中的手术指征和手术时机均未提及IE多瓣膜毁损情况。本研究认为IE多瓣膜毁损患者是风险更高的人群,对于这类人群需要更加密切的随访监测以及更早的外科干预,IE患者不存在指南中的手术指征时应该考虑将多瓣膜的广泛受累作为手术干预的提示指征。
IE可以累及心脏的任一瓣膜,但是较常累及左心瓣膜,较少累及右心瓣膜。本研究探讨了手术干预不同瓣膜的术后预后差异,结果显示术后累计死亡率和术后复合终点事件发生率差异均无统计学意义。
IE常因瓣膜毁损严重而无法进行瓣膜成形,这更增加了外科医师对IE行瓣膜成形的排斥。IE成形率最高的瓣膜是二尖瓣,国外文献[17-18]报道IE患者二尖瓣成形的比例高达50%~80%。本中心的IE二尖瓣成形率为46.7%,总成形率为24.5%。但是国内瓣膜手术方式对IE患者术后预后影响的研究较少,本研究旨在探究人工瓣膜对于IE患者术后的影响,包括术后生存率、栓塞性脑卒中、IE复发等。因此,在总体人群中(包括各个瓣膜的手术)比较了机械瓣瓣膜置换术、生物瓣瓣膜置换术和瓣膜成形术的预后,结果表明人工生物瓣膜置换术后患者的复合终点事件发生率最高,而瓣膜成形术后患者的复合终点事件发生率最低,更有优势,应积极推广瓣膜成形技术在IE患者中的应用。
本研究结果提示IE多瓣膜毁损患者是风险更高的人群,对于这类人群需要更加密切的随访监测以及更早的外科干预,瓣膜成形比瓣膜置换更有优势,在IE患者的外科治疗中应积极尝试瓣膜成形术。
利益冲突:无。
作者贡献:赵双雷负责数据收集、处理,论文撰写;刘周负责数据收集、处理;温明修、李前贤、胡熠负责数据收集;王宾、孙兆庆负责统计学指导;姜文剑、韩杰、王坚刚、贡鸣负责研究指导,论文修改。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)