首页 > 医疗资讯/ 正文
摘 要
目的 探讨胰高血糖素样肽-1(glucagon-like peptide-1, GLP-1)调控糖稳态的神经基础并解析GLP-1影响糖感知神经元活动的分子机制。
方法 以雄性GLP-1R -Cre、GLP-1R KO以及野生型小鼠为研究对象。采用光纤记录腹内侧下丘脑(ventromedial hypothalamus, VMH)神经元钙信号,利用膜片钳分析GLP-1受体阳性(GLP-1RVMH)神经元的电生理特性。采用脑立体定位病毒注射和化学遗传学,结合血浆激素检测以及常规糖代谢指标检测,明确GLP-1RVMH神经元对糖稳态的调控作用。利用组织和细胞线粒体呼吸功能测定、透射电镜和常规分子生物学方法,探讨GLP-1R激动剂调节糖稳态的机制。
结果 在葡萄糖浓度从5.0 mmol/L降低至0.5 mmol/L时,GLP-1RVMH神经元的动作电位频率显著降低[(4.51±0.80) Hz vs. (1.43±0.51) Hz, P<0.01];激活GLP-1RVMH神经元显著增强了胰岛素分泌[(7.60±0.56) μU/mL vs. (11. 34±0.93) μU/mL, P<0.01],抑制该类神经元活动则损害了GLP-1激动剂的降糖效率(32.03%±0.91% vs. 25.77%±1.09%, P<0.001),其机制与GLP-1调控Drp1磷酸化,促进神经元线粒体分裂并改善线粒体能量代谢有关。
结论 GLP-1RVMH神经元是一类葡萄糖兴奋神经元,激活该类神经元能够促进胰岛素分泌,GLP-1R受体激动剂发挥降糖作用部分依赖于GLP-1RVMH神经元活动。
关键词 腹内侧下丘脑;葡萄糖稳态;胰高血糖素样肽-1;线粒体;线粒体动力相关蛋白1
腹内侧下丘脑(ventromedial hypothalamus,VMH)是参与机体血糖稳态调控的重要核团[1-2]。其中,糖感知神经元是VMH发挥糖稳态调控作用的基础,根据其电生理特性被分为糖兴奋神经元(glucose-excited neuron, GE)和糖抑制神经元(glucose-inhibited neuron, GI),其中GE神经元在葡萄糖浓度升高时去极化激活,GI神经元则与之相反[3]。而根据其特异性的分子标志,VMH糖感知神经元可以进一步分为不同的亚群,激活或抑制这类神经元能够直接调控糖稳态[4-7]。目前研究发现,VMH的糖感知神经元接受来自臂旁核(lateral parabrachial nucleus, LPBN)的投射,并支配终纹床核(bed nucleus of the stria terminalis, BNST)的活动,形成LPBN→VMH→aBNST环路来控制外周内分泌器官的活动[8-9]。然而,VMH糖感知神经元感知血液中糖浓度变化的分子机制尚不清楚。
胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)是主要由肠道L细胞产生的激素,具有显著的降糖和抑制摄食的作用[10-11]。GLP-1受体(GLP-1 receptor,GLP-1R)广泛表达在各个脑区的神经元上,其激动剂抑制摄食的作用与调控下丘脑各核团的GLP-1R阳性神经元活动有关[12-14]。然而,目前尚不清楚GLP-1R激动剂的降血糖效应是否也依赖于中枢GLP-1R阳性神经元。为此,本研究重点解决以下问题:VMH是否存在 GLP-1R阳性(GLP-1RVMH)神经元,并解析其在糖稳态调控中的作用;明确GLP-1促进胰岛素分泌是否依赖于该类神经元亚群的活动;阐明GLP-1调控该类神经元活动的分子机制。
1 材料与方法
1.1 实验动物
GLP-1R-Cre、GLP-1R KO以及野生型小鼠购于上海南方模式生物科技股份有限公司。小鼠饲养于陆军军医大学第二附属医院动物中心。本研究中所有操作严格按照《陆军军医大学第二附属医院实验动物伦理委员会实验动物操作指南》进行。
1.2 相关病毒
AAV病毒:①rAAV9-hSyn-GCaMp6s;②rAAV9-hSyn-DIO-EGFP-WPRE-hGH polyA;③rAAV9-hSyn-DIO-hM3D(Gq)-mCherry-WPRE-hGH polyA;④rAAV9-hSyn-DIO-tettoxlc-EGFP-WPRE-hGH polyA。上述病毒及其对照病毒均购于武汉枢密脑科学技术有限公司。
1.3 研究方法
1.3.1 血糖对抗调节反应(CRR)障碍小鼠模型建立 利用随机数表法将10周龄雄性野生型小鼠随机分为对照组(10只)和CRR障碍组(13只)。CRR障碍组小鼠的造模方法:小鼠空腹5~6 h后,按照0.75 IU/kg的剂量腹腔注射赖脯胰岛素(礼来公司),隔天注射1次,总共注射8次,每次注射完成后,小鼠继续禁食3 h,随后允许小鼠自由进食。对照组小鼠接受相同方案的胰岛素注射,但每次注射完成后,允许小鼠自由进食,以免发生低血糖。造模期间,CRR障碍组有2只小鼠因发生严重低血糖而淘汰,1只小鼠造模未成功,最终得到10只CRR障碍组小鼠,造模成功率约77%。
1.3.2 链脲佐菌素(STZ)诱导建立T1DM小鼠模型及分组 40只10周龄雄性GLP-1R-Cre小鼠空腹6 h后,接受腹腔注射STZ(50 mg/kg),1次/d,连续注射5 d。注射完成2 d后,检测随机血糖。若随机血糖≥16.7 mmol/L,则认为1型糖尿病(T1DM)造模成功。根据该标准,总共获得30只T1DM小鼠,另有10只小鼠因随机血糖不达标而淘汰,造模成功率约为75%。将上述T1DM小鼠采用随机数字法随机分为STZ-Vehicle组(10只),STZ-Enx4组(10只)以及STZ-VMHGLP1R-TT-Exn4组(10只)。
1.3.3 VMH病毒注射、光纤埋置和钙信号记录 利用异氟烷将上述小鼠麻醉后,将头部固定于立体定位仪上。消毒头皮并于头皮下注射利多卡因0.1 mL,剪开头皮并清理颅骨表面脑组织,根据小鼠脑图谱确定VMH的颅骨投影点为:Bregma点后1.35 mm,旁开±0.4 mm,深度5.6 mm。以投影点为中心开颅并挑开硬脑膜。缓慢将玻璃微电级进入预定深度后,按照0.7 nL/min的速度,向目标区域注射100~200 nL的病毒,注射完成并停针20~30 min后,缓慢拔针,缝合皮肤。苏醒后放回动物房继续饲养3周。
于病毒注射后1周埋置光纤。病毒注射3周后,小鼠空腹6 h,利用钙信号采集系统采集腹内侧下丘脑神经元的钙信号。先采集生理血糖水平下的钙活动30 min,然后小鼠接受腹腔注射0.75 IU/kg的胰岛素或2 g/kg的葡萄糖,15 min后进行连续30 min的钙信号采集。数据利用软件进行分析。
1.3.4 艾塞那肽(Exn4)降糖效率检测 STZ-Vehicle组、STZ-Exn4组以及STZ-VMHGLP1R-TT-Exn4组小鼠在接受相应病毒注射3周后,开始检测艾塞那肽的降糖效率。具体操作:3组小鼠空腹6 h后,STZ-Exn4组以及STZ-VMHGLP1R-TT-Exn4组小鼠接受腹腔注射Exn4(50 μg/kg)1次,STZ-Vehicle组小鼠接受同剂量的生理盐水注射,并于注射完成后的0 min、30 min、60 min、90 min、120 min检测鼠尾血糖,并计算2 h降糖效率。
1.3.5 脑片膜片钳检测 9只雄性10周龄GLP-1R-Cre小鼠在接受rAAV9-hSyn-DIO-EGFP -WPRE-hGH polyA病毒注射3周后,经心灌注95%和5% CO2处理的4 ℃ NMDG液,迅速取脑并用振荡切片机切片(250 μm)。切片用25℃氧饱和的ACSF液体孵育1 h后,开始进行电生理记录。
静息膜电位采用全细胞记录的方式,并ACSF中加入下述突触阻滞:Bicuculline (10 µmol/L), TTX (1 µmol/L), CNQX(20 µmol/L)和APV(50 µmol/L),记录在5-0.5-5 mmol/L葡萄糖条件下的膜电位,每个浓度连续记录3 min。将细胞膜电位钳制在-45 mV左右记录自发兴奋性突触后电流(sEPSCs),钳制在+10 mV记录自发抑制性突触后电流(sIPSCs)。记录在葡萄糖浓度5-0.5-5 mmol/L条件下的动作电位,每个浓度记录3 min。
1.3.6 化学遗传学及血浆激素水平检测 GLP1R-CrehM3D(Gq)组和GLP1R-Cremcherry组小鼠空腹16 h后,腹腔注射1 mg/kg的CNO,30 min后向腹腔注射葡萄糖溶液(2 g/kg),并于注射后15 min、30 min、60 min、90 min、150 min记录鼠尾血糖。为检测血浆中的胰岛素激素含量,于葡萄糖溶液(2 g/kg)注射60 min后取全血并提取血浆后,利用ELSIA试剂盒检测胰岛素含量。
为检测胰高血糖素、肾上腺素、去甲肾上腺素以及醛固酮含量, 相关小鼠空腹6 h后,向腹腔注射赖脯胰岛素(0.75 IU/kg),于注射后60 min取眼球血,离心后取上清液。其中,肾上腺素和去甲肾上腺素采用HPLC的方式检测,醛固酮和胰高血糖素利用ELISA试剂盒检测。
1.3.7 透射电镜观察下丘脑神经元线粒体形态 3只雄性WT小鼠和3只雄性GLP-1R KO小鼠麻醉后,经心灌注预冷的生理盐水和4% PFA后,迅速取脑在体式显微镜下切割分离腹内侧下丘脑,浸泡于2.5%戊二醛。经过后续的包埋-后固定-脱水及浸透-切片及定位-烘烤-切片-染色等步骤,进行透射电镜观察并拍照。每只做3张切片并拍照,统计每张切片上的线粒体长度和长/宽。
1.3.8 N2a细胞培养 N2a细胞购于普诺赛公司,采用Neuro-2a [N2a]细胞专用培养基[MEM(含NEAA)+10% FBS+1% P/S]进行培养,培养箱温度为37℃,CO2浓度为5%。
1.3.9 高分辨率线粒体呼吸耗氧功能测定 利用碧云天组织或细胞线粒体分离试剂盒提取线粒体后,其呼吸功能采用高分辨率线粒体呼吸功能测定仪Oxygraph-2K测定。操作过程:待氧耗量曲线平稳后,加入洋地黄皂苷(digitonin,10 μg/106 cells)用来改变细胞膜的通透性(组织线粒体不需要该步)。接着,按下述顺序依次加入苹果酸(M,2 mmol/L)、谷氨酸盐(G,5 μmol/L)和二磷酸腺苷(ADP,5 mmol/L),以测定线粒体复合物Ⅰ氧化磷酸化能力;加琥珀酸钠(S,10 mmol/L)测定复合体 I+II 的氧化磷酸化功能(CI+IIOXPHOS);分次加入羰基氰对三氟甲氧基苯腙(FCCP,1-1.5 μmol/L)至得到最高耗氧速率,测定复合体I+II的电子传递能力(CI+IIETS);加入鱼藤酮(Rot,0.5 μmol/L)测定线粒体复合物II非偶联状态下的电子传递能力(CIIETS)。最后,加入抗霉素A(Ama,2.5 μmol/L)测定残余氧耗量(ROX)。
1.3.10 免疫荧光染色 小鼠进行麻醉后,经心脏灌注4 ℃预冷的PBS和4%多聚甲醛。取出大脑,浸入4%多聚甲醛48 h,将脑组织通过冰冻切片机切成20 μm厚的薄片。通过洗涤、抗原修复、通透、封闭等处理后,滴加一抗(抗c-Fos抗体,1∶800)4 ℃孵育过夜,第2天在室温下PBST浸洗3次,每次5 min,滴加羊抗兔荧光二抗在室温下孵育120 min,再次PBST浸洗3次,每次5 min,最后用抗淬灭剂封片,于共聚焦显微镜下采集VMH区域c-Fos荧光图片。
1.3.11 腹内侧下丘脑切割及免疫印迹实验 小鼠断头处死后,迅速剥离大脑并用组织胶包埋后冻于-80 ℃。利用冰冻切片机将脑组织切片,厚度为100 μm。根据小鼠脑图谱保留含有VMH的脑片,浸泡在人工脑脊液中。用体视显微镜和眼科手术器械,迅速切割双侧VMH组织。每10~15只小鼠的VMH组织混合在一起进行蛋白提取和定量。
配制好SDS-PAGE 凝胶后,利用微量取样器将大约50 μg变性的蛋白上样至每孔,并在最后一孔中加入预染Marker,放入电泳槽中电泳,蛋白进入分离胶前电压为80 V,后换电压为120 V,直至溴酚蓝到玻璃板底部;采用半干转的方法进行转膜后,根据蛋白是否为磷酸化蛋白分别采用5%的BSA或封闭奶粉在室温下振荡封闭2 h,转速为50 r/min;封闭完成后,将一抗用稀释液稀释(1∶200~1∶5000),并在孵育盒中4 ℃条件下摇动孵育12 h;孵育完毕后用PBST溶液洗膜3次,每次10 min;二抗稀释比例为1∶5000~1∶10000,在室温下孵育3 h;洗膜完毕后用Western blot全自动曝光仪进行曝光检测。
1.4 统计学方法
采用GraphPad Prism 9.3软件进行统计学分析。采用Shapiro-Wilk检验评估数据分布的正态性。正态分布的计量资料用均数±标准误表示,非正态分布用M (QL,QU)表示。对正态分布且方差齐(通过Bartlett检验验证)的数据,两组间比较采用t检验,多组间比较采用单因素方差分析,部分数据采用双因素方差分析-Sidak多重比较。对非正态分布或方差不齐数据组间比较,采用Kruskal-Wallis H检验进行全局分析,并用Dunn’s法进行多重比较校正。检验水准α=0.05。
2 结果
2.1 腹内侧下丘脑可能直接参与糖稳态调控 为明确VMH是否与糖稳态调控直接相关,本研究利用光纤记录WT小鼠在不同血糖状态下VMH神经元的钙活动(图1A)。结果显示,与生理状态下相比,高血糖显著增强VMH神经元的钙活动(图1B、C,P<0.05);与之相反的是,胰岛素诱发的低血糖显著抑制该脑区的神经元钙活动(图1D、E,P<0.05)。上述钙信号记录的结果证明:VMH中存在能够直接感受血糖浓度变化的神经元。
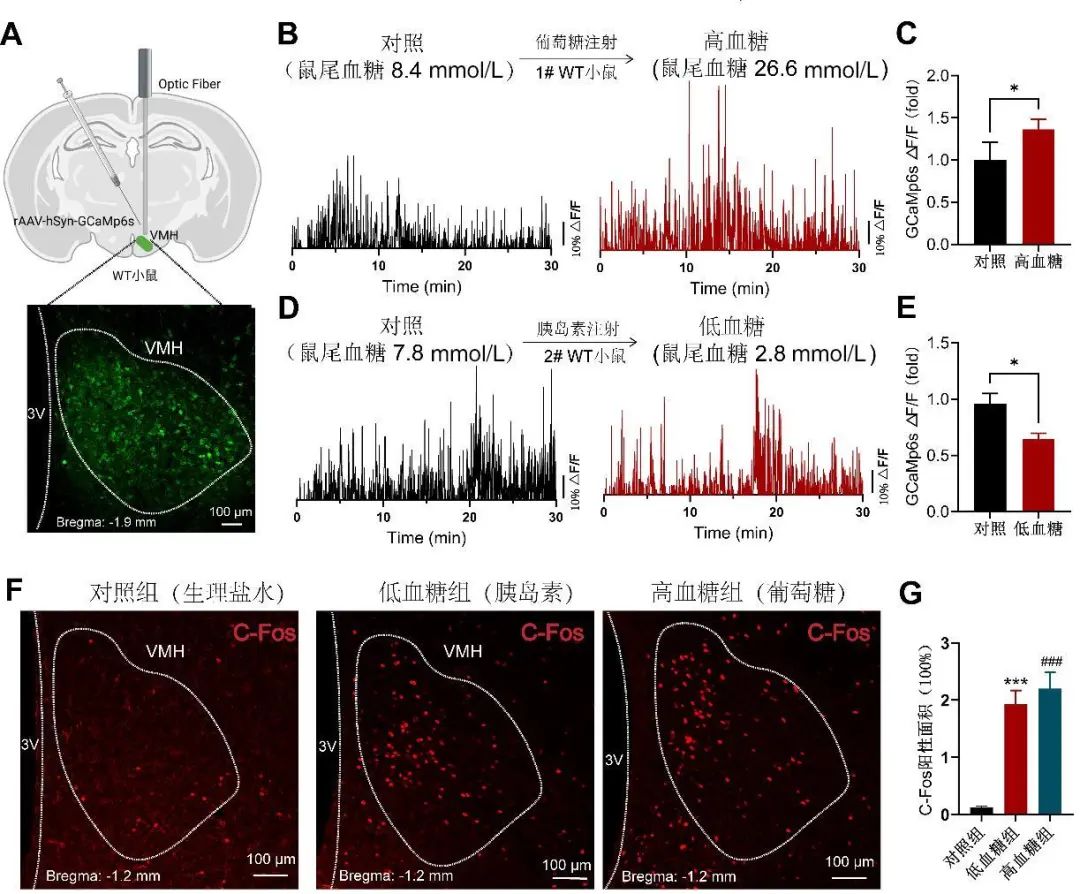
图1 光纤记录VMH神经元钙活动以及c-Fos染色 A. 示意图:WT小鼠VMH注射rAAV-hSyn-GCaMp6s病毒, 及病毒注射3周后GCaMp6s的表达情况。B、C. 光纤记录VMH神经元在生理血糖(对照)水平和高血糖条件下(腹腔注射2 g/kg的葡萄糖溶液15 min后, 血糖>16.7 mmol/L)的钙活动情况。对照和高血糖状态均连续记录30 min。统计结果显示在C图。n=4,t检验,*P<0.05。D、E. 光纤记录VMH神经元在生理血糖(对照)水平和低血糖条件下(腹腔注射0.75 IU/kg的赖脯胰岛素后15 min,血糖<3.9 mmol/L)的钙活动情况。对照和低血糖状态均连续记录30 min。统计结果显示在E图。n=4,t检验,*P<0.05。F、G. VMH c-Fos免疫荧光染色。c-Fos阳性面积统计结果显示在G图。n=6,t检验,***P<0.001,###P<0.001。Fig.1 Recording of Ca2+ signals and c-Fos staining in VMH
c-Fos基因的表达水平是衡量神经元对外界刺激是否做出响应的关键指标。因此,本研究检测了高/低血糖条件下WT小鼠VMH的c-Fos表达情况。结果显示,高血糖和低血糖均显著增强VMH c-Fos表达水平(图1F、G,P<0.001),该结果进一步证明VMH神经元可能参与糖稳态调控。
2.2 腹内侧下丘脑GLP-1R的表达在CRR障碍小鼠中显著下调 VMH的糖稳态调控作用是否依赖于GLP-1R阳性神经元尚不清楚,为此,本团队首先利用胰岛素反复诱发低血糖发作构建了CRR障碍小鼠模型(图2A)。如图2B,8次胰岛素诱发低血糖反复发作后,这些小鼠的CRR出现显著的损害,表现为接受相同剂量的胰岛素后,血糖水平更低且恢复正常血糖需要的时间更长;此外,在给与胰岛素60 min后,比较两组小鼠血液中的升血糖激素水平,结果显示,CRR障碍组小鼠血浆胰高血糖素(图2C,P<0.05)、肾上腺素(图2D,P<0.05)、去甲肾上腺素(图2E,P<0.01)和皮质酮(图2F,P<0.01)均出现显著下降。这些结果证实,利用胰岛素成功构建了CRR障碍小鼠模型。
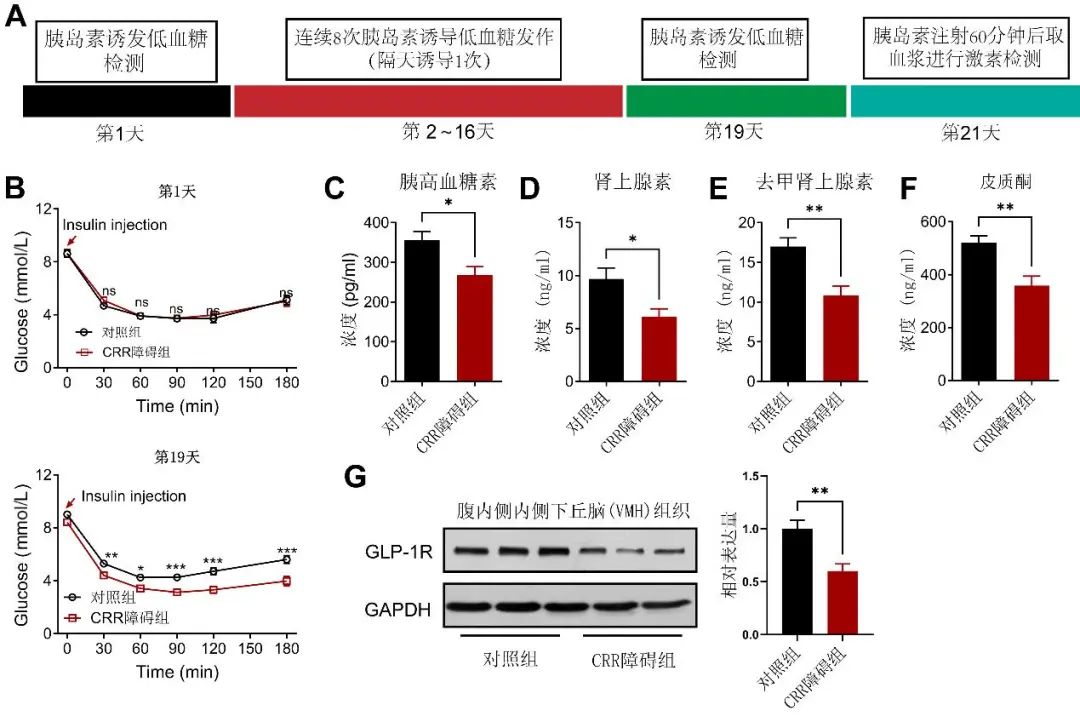
图2 糖稳态调节紊乱小鼠模型建立及VMH组织GLP-1R蛋白含量检测 A. 示意图:CRR障碍小鼠模型的构建;B.在胰岛素干预前(第1天)和造模结束后(第19天)进行胰岛素敏感性实验(ITT)。n=10,双因素方差分析-Sidak多重比较,*P<0.05,**P<0.01,***P<0.001。C~F. ELISA检测胰岛素注射60 min后血浆胰高血糖素(C)和皮质酮(F)含量,以及高效液相色谱法检测血浆肾上腺素(D)和去甲肾上腺素(E)含量。n=8,t检验,*P<0.05,**P<0.01。G. WB检测VMH组织GLP-1R蛋白表达量,n=3,Mann-Whitney U 检验,*P<0.05。Fig.2 Establishment of CRR disorder model and detection of GLP-1R expression
为探索糖调节紊乱的发生是否与GLP-1有关,本研究检测了VMH组织中GLP-1受体(GLP-1R)的蛋白表达量。结果显示,GLP-1R在VMH中有表达,且其表达量在CRR障碍组小鼠VMH中显著降低(图2G,P<0.01),提示GLP-1R在VMH中有表达,且GLP-1R可能参与糖稳态调控。
2.3 GLP-1RVMH神经元是糖兴奋神经元 既往研究发现,对糖代谢具有调控作用的神经元均是糖感知神经元[15]。GLP-1R阳性神经元是否也是糖感知神经元呢?为此,本研究利用膜片钳记录GLP-1RVMH神经元在不同葡萄糖浓度下电活动(图3A)。如图3B所示,当人工脑脊液中的葡萄糖浓度从5 mmol/L降低至0.5 mmol/L时,GLP-1RVMH神经元的动作电位(AP)频率也明显降低[(4.51±0.80) Hz vs. (1.43±0.51) Hz,P<0.01],而当葡萄糖浓度从0.5 mmol/L恢复至5 mmol/L后,其AP频率又恢复到正常水平[(1.43±0.51) Hz vs. (3.04±0.71) Hz,P<0.01];进一步的膜电位记录显示,利用Bicuculline(10 µmol/L)、TTX(1 µmol/L)、CNQX(20 µmol/L)和APV (50 µmol/L)阻滞突触传递后,葡萄糖浓度从5 mmol/L降低至0.5 mmol/L时,GLP-1RVMH神经元的膜电位出现显著的超极化[(-40.89±1.94) mV vs. (-47.70±1.58) mV,P<0.001],而当葡萄糖浓度恢复至5 mmol/L后,其膜电位又出现显著的去极化[(-47.70±1.58) mV vs. (-40.85±2.18) mV,P<0.001](图3C)。上述动作电位和膜电位记录结果提示:GLP-1RVMH神经元是能够直接感受细胞外糖浓度变化的糖感知神经元,且是一类糖兴奋神经元。
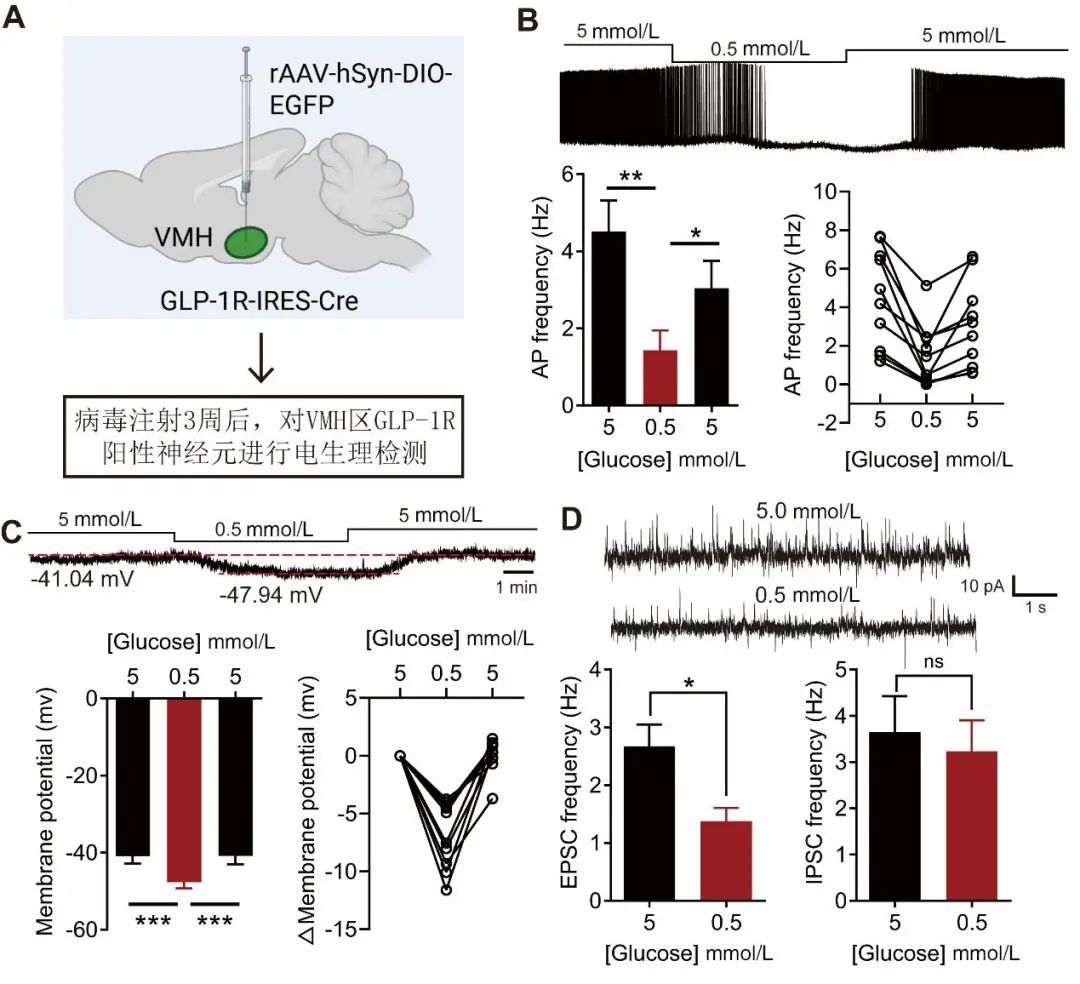
图3 膜片钳记录GLP-1RVMH神经元在不同糖浓度下的电活动 A. 示意图:GLP-1R-Cre小鼠VMH注射rAAV-hSyn-DIO-EGFP病毒 (200 nL)。B. GLP-1RVMH神经元在5-0.5-5 mmol/L葡萄糖时的动作电位。下方为动作电位频率的统计和频率变化图。n=9(3只小鼠),t检验,*P<0.05,**P<0.01。C. 阻断突触传递后[Bicuculline (10 µmol/L),TTX(1 µmol/L),CNQX(20 µmol/L)和APV(50 µmol/L)],记录GLP-1RVMH神经元在葡萄糖浓度为5-0.5-5 mmol/L时的膜电位。下方为膜电位统计图和膜电位差。n=6(3只小鼠),t检验,***P<0.001。D. GLP-1RVMH神经元在5 mmol/L和0.5 mmol/L葡萄糖浓度时的兴奋性突触后电流(sEPSC)及抑制性突触后电流(sIPSC)。下方sEPSC和sIPSC的频率统计,n=9 (3只小鼠),t检验,*P<0.05。Fig.3 The electrical activity of GLP-1RVMH neurons recorded by patch clamp
自发兴奋性突触后电流(sEPSC)以及自发抑制性突触后电流(sIPSC)记录结果显示,当葡萄糖浓度降低至0.5 mmol/L时,sEPSC的频率出现显著降低(P<0.05),而sIPSC的频率没有显著变化(P>0.05)(图3D),说明GLP-1RVMH神经元不仅能直接感受糖浓度变化,同时也接受来自其他脑区的投射。
2.4 激活GLP-1RVMH神经元促进胰岛素分泌并降低血糖 尽管已明确GLP-1RVMH神经元是糖兴奋神经元,但GLP-1是否通过VMH发挥糖调控作用还需更直接的证据。为此,本研究向GLP-1R-Cre小鼠VMH注射化学遗传学激活病毒(图4A),以探讨GLP-1RVMH神经元的糖稳态调节作用。结果显示,利用CNO激活GLP-1RVMH神经元显著降低了高血糖(图4B,P<0.05),并且促进胰岛素分泌[(7.60±0.56) μU/mL vs. (11.34±0.93) μU/mL,P<0.01] (图4C)。
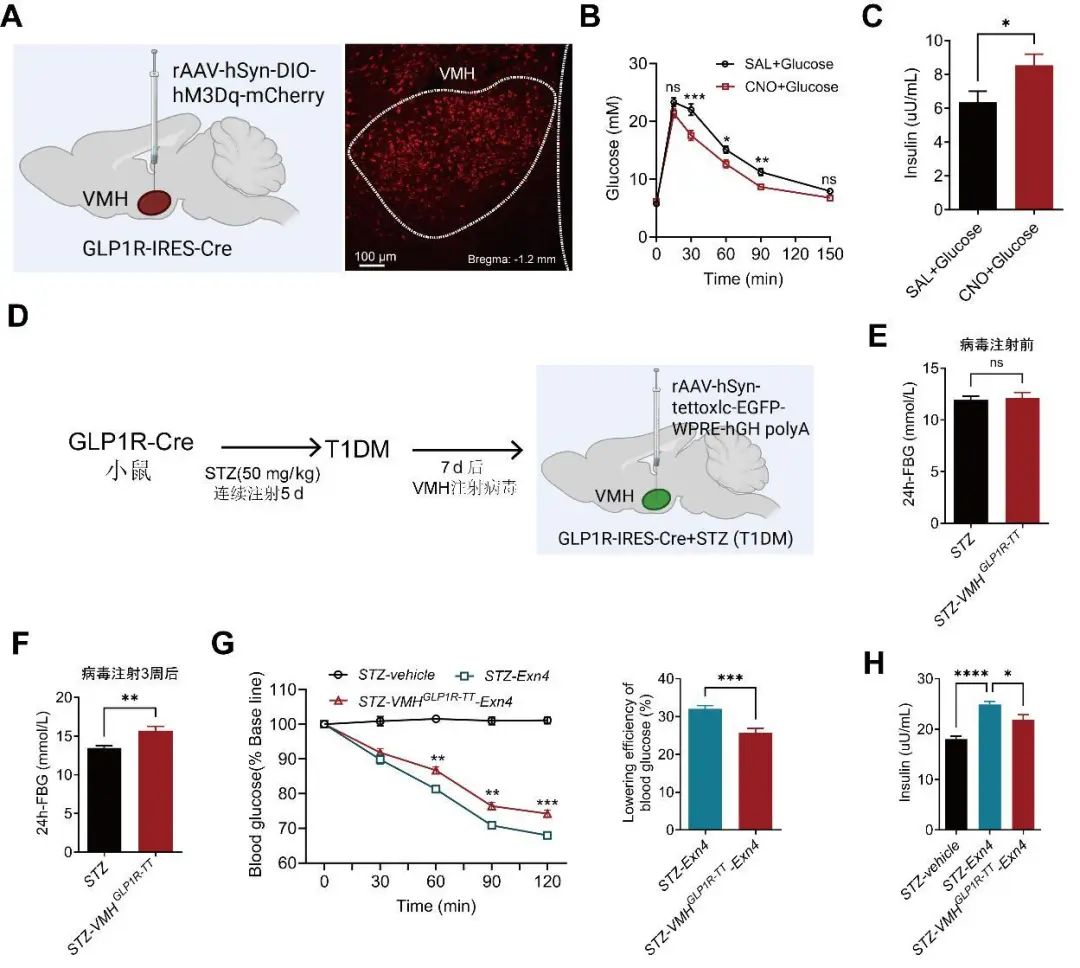
图4 激活GLP-1RVMH神经元促进胰岛素分泌,降低高血糖 A.示意图:GLP-1R-Cre小鼠VMH注射rAAV-hSyn-DIO-hM3Dq-mCherry病毒(100 nL)。右图为病毒注射3周后GLP-1RVMH神经元mCherry的表达情况。B. 化学遗传学激活GLP-1RVMH神经元显著降低高血糖。CNO,氯氮平N-氧化物,1 mg/kg;SAL,生理盐水。n=10,双因素方差分析-Sidak多重比较,ns代表P>0.05,*P<0.05,**P<0.01。C. 化学遗传学激活GLP-1RVMH神经元显著促进胰岛素分泌。n=8,t检验,**P<0.01。D. 示意图: STZ(50 mg/kg,连续注射5 d)皮下注射构建1型糖尿病GLP-1R-Cre小鼠,并向VMH注射rAAV-hSyn-DIO-tettoxlc-P2A- WPREs (100 nL)。E、F. 病毒注射前、后的24 h空腹血糖。n=10,t检验,ns代表P>0.05, *P<0.05。G. GLP-1激动剂艾塞那肽(Exn-4,50 μg/kg)注射后血糖变化情况及降糖效率。n=10,双因素方差分析-Sidak多重比较,**P<0.01,***P<0.001.H. 艾塞那肽注射60 min后的血浆胰岛素含量。n=8,*P<0.05,***P<0.001。Fig.4 GLP-1RVMH neurons activation promoting insulin secretion and reducing hyperglycemia
为进一步探讨GLP-1R激动剂控制高血糖是否也通过VMH发挥作用,本研究利用STZ构建1型糖尿病GLP-1R-Cre 小鼠,并向该小鼠VMH注射rAAV-hSyn-DIO-tettoxlc-P2A-WPREs病毒,达到长时间抑制GLP-1RVMH神经元信号传递的效果(图4D)。结果显示,抑制GLP-1RVMH神经元信号传递后,小鼠的24 h空腹血糖显著升高(图4F,P<0.01),提示GLP-1RVMH神经元可能参与糖尿病的进展。更重要的是,抑制GLP-1RVMH神经元的信号传递使艾塞那肽(Exendin-4,GLP-1R激动剂)的降糖效率从33%降到24%(图4G,P<0.001),同时也显著抑制了GLP-1的促胰岛素分泌作用(图4H,P<0.05)。
2.5 GLP-1促进Drp1介导的线粒体分裂,改善神经元线粒体能量代谢 线粒体功能障碍会显著损害糖感知神经元的糖感知功能[16]。考虑到GLP-1的降糖作用依赖于GLP-1RVMH神经元活动,推测GLP-1可能调节神经元的线粒体功能。为此,本研究检测了GLP-1R KO小鼠VMH神经元的线粒体形态,透射电镜结果显示,GLP-1R KO小鼠VMH神经元的线粒体出现明显融合(图5A),表现为线粒体长度增长(图5B,P<0.05),线粒体长/宽增加(图5C,P<0.05),提示GLP-1R敲除可能抑制线粒体分裂。进一步的线粒体呼吸功能测定发现,GLP-1R敲除显著损害VMH神经元线粒体复合体I和复合体II的电子传递能力(图5C,P<0.01)。此外,GLP-1R KO小鼠VMH组织中的ATP含量也显著降低。
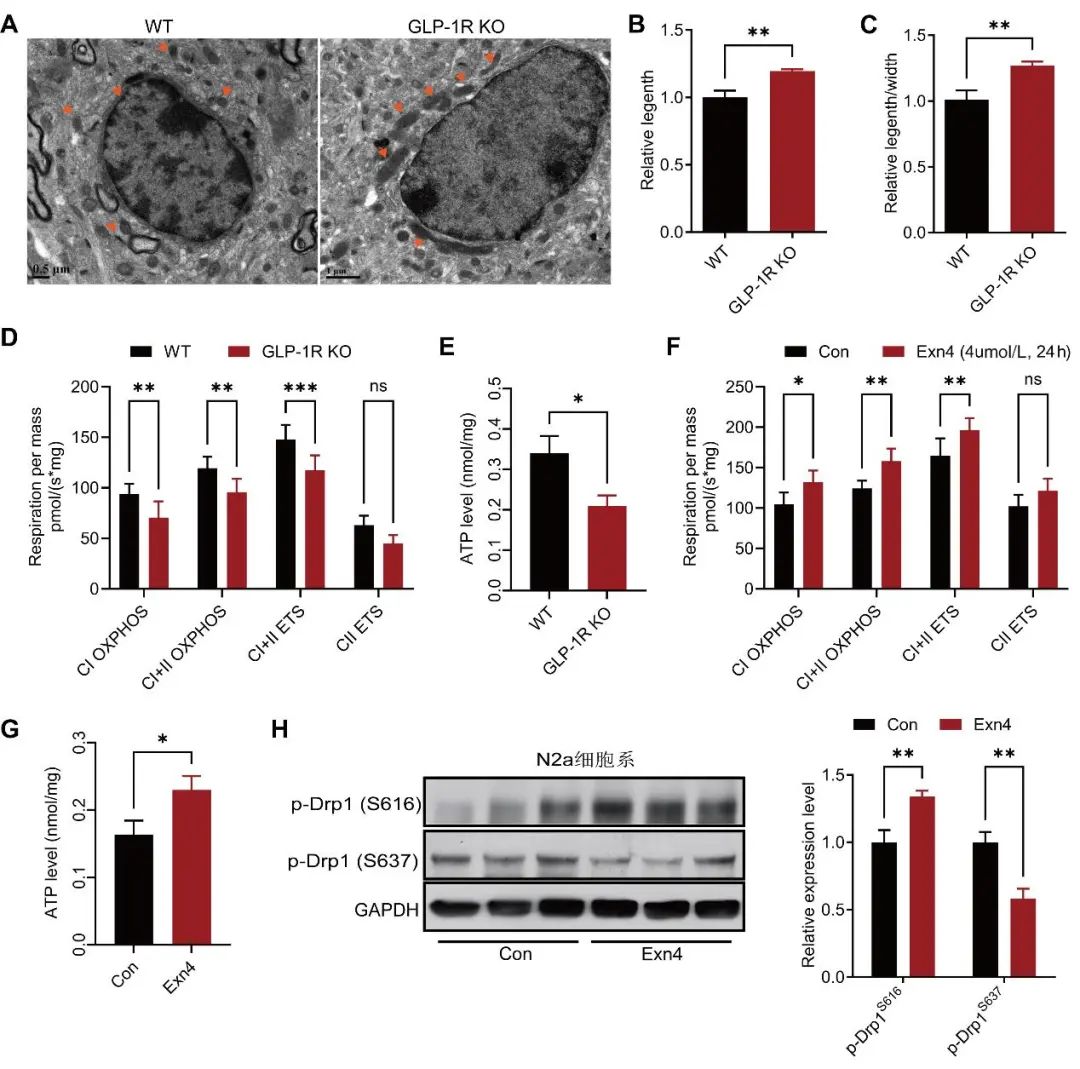
图5 GLP-1调控Drp1磷酸化影响线粒体功能 A. 代表性的透射电镜图片显示WT小鼠和GLP-1R敲除小鼠(GLP1R KO)VMH神经元的线粒体形态。B、C. 线粒体长度和长/宽。n=3,t检验,**P<0.01。D、E. 小鼠VMH组织线粒体呼吸功能(D)和ATP含量(E)。CI OXPHOS, 线粒体复合物 I 的氧化磷酸化能力;CII OXPHOS, 线粒体复合物II氧化磷酸化能力;CI+II OXPHOS,线粒体复合物I和II的氧化磷酸化能力;CI+II ETS,线粒体复合物I和II的电子传递能力;CII ETS,线粒体复合物 II 的电子传递能力。n=6,双因素方差分析-Sidak多重比较(D),t检验(E),ns,P>0.05,*P<0.05,**P<0.01,***P<0.001。F、G. N2a细胞线粒体呼吸功能(F)和ATP含量(G)。n=6,双因素方差分析-Sidak多重比较(A),t检验 (B),ns代表P>0.05,*P<0.05,**P<0.01。H. WB检测艾塞那肽(4 μmol/L)干预N2a细胞24 h后,p-Drp1(S616)和p-Drp1(S637)的蛋白表达。n=3, Mann-Whitney U检验, **P<0.01。Fig.5 GLP-1 affect mitochondrial function by regulating Drp1 phosphorylation
进一步,本研究发现艾塞那肽显著增强N2a细胞的线粒体呼吸功能(图5F,P<0.05),并增加ATP含量(图5G,P<0.05)。WB结果也显示,艾塞那肽干预显著增强N2a细胞p-Drp1(S616)的表达,而抑制p-Drp1(S637)的表达(图5H,P<0.01),提示GLP-1R激动剂可能是通过调节Drp1磷酸化来影响神经元的线粒体形态和功能。
3 讨论
本团队首次利用电生理技术证明了GLP-1RVMH神经元是葡萄糖兴奋神经元。激活GLP-1RVMH神经元能够显著促进胰岛素分泌并降低高血糖,且外源性GLP-1的降血糖作用部分依赖于GLP-1RVMH神经元活动。机制上,本研究发现GLP-1通过调节Drp1磷酸化,促进GLP-1RVMH神经元线粒体分裂和并改善线粒体呼吸功能。
先前研究认为,GLP-1的降血糖作用主要依赖于激活外周组织的GLP-1R信号通路,而中枢GLP-1信号主要与抑制进食有关[13,17]。下丘脑糖感知神经元对外周葡萄糖水平的感知,在调节糖代谢与糖稳态中起重要作用[18-19]。糖感知神经元首次在VMH中被发现,随后在臂旁核、中央杏仁核、下丘脑弓状核、终纹床核、伏隔核、迷走神经背核和孤束核中陆续发现该类神经元[20]。目前尚不清楚的是,GLP-1RVMH神经元是否为具有糖稳态调节能力的糖感知神经元。
尽管之前有研究报告,条件性敲除Nkx2.1-Cre或nestin-Cre小鼠GLP-1R对糖代谢无显著影响[21-22],我们推测这可能与胚胎发育期产生的代偿效应有关。而本研究通过化学遗传学激活成年GLP-1R-Cre小鼠GLP-1RVMH神经元,发现能够显著降低高血糖;此外,抑制糖尿病小鼠GLP-1RVMH神经元的信号传递,部分阻断了艾塞那肽的降糖作用,证明GLP-1的降血糖作用部分依赖于GLP-1RVMH神经元的活动。此外,电生理结果也证实大部分GLP-1RVMH神经元是糖兴奋神经元。但本研究并没有进一步探讨GLP-1RVMH神经元是否同样具有调控摄食的作用。
线粒体是神经元营养感知的中枢,线粒体产生的ATP通过影响离子通道的开关调控神经元的兴奋性,呼吸链产生的ROS也能调控离子通道的翻译后修饰[23]。细胞在应对各种环境或代谢应激时,通过线粒体分裂、融合、生物合成以及线粒体自噬等机制来维持能量平衡以适应环境[24]。下丘脑POMC神经元在感知到食物存在时,会迅速刺激肝细胞线粒体分裂,抑制肝糖异生[25]。肥胖和糖尿病的发生发展与代谢调控相关的神经元线粒体形态和功能异常, 导致机体能量摄入、吸收和消耗等各环节紊乱密切相关[26-28]。既往研究发现,GLP-1的降糖、减重和保护心肌等有益作用主要来源于对线粒体形态和功能的改善,例如,通过促进星形胶质细胞线粒体的稳定性改善脑组织的糖代谢平衡[29],通过改善心肌细胞和肝细胞线粒体结构和功能,抑制心肌肥大、心脏纤维化和肝脏纤维化[30-31]。但目前尚不清楚GLP-1是否能影响神经元线粒体功能。而本研究发现,GLP-1R敲除小鼠VMH的线粒体明显延长,其氧化磷酸化功能出现显著降低;而艾塞那肽则显著增强N2a细胞的线粒体功能。分子机制研究发现,GLP-1可能是通过调节Drp1的磷酸化水平来促进线粒体分裂,进而改善线粒体能量代谢。
综上所述,团队首次发现GLP-1RVMH神经元是一类糖兴奋神经元。激活GLP-1RVMH神经元能够降低高血糖,且GLP-1R激动剂降低血糖的效应部分依赖于GLP-1RVMH神经元。机制研究则发现, GLP-1通过调节神经元Drp-1的磷酸化来调控其线粒体形态和功能,这些研究结果进一步丰富了GLP-1降血糖的分子机制。
参考文献:
1. POZO M, CLARET M. Hypothalamic control of systemic glucose homeostasis: The pancreas connection[J]. Trends Endocrinol Metab, 2018, 29(8): 581-594.
2. ROUTH V H, HAO L, SANTIAGO A M, et al. Hypothalamic glucose sensing: Making ends meet[J]. Front Syst Neurosci, 2014, 8: 236.
3. MELNICK I V, PRICE C J, COLMERS W F. Glucosensing in parvocellular neurons of the rat hypothalamic paraventricular nucleus[J]. Eur J Neurosci, 2011, 34(2): 272-282.
4. HE Y, XU P, WANG C, et al. Estrogen receptor-alpha expressing neurons in the ventrolateral VMH regulate glucose balance[J]. Nat Commun, 2020, 11(1): 2165.
5. SUTTON HICKEY A K, GOFORTH P B, GONZALEZ I E, et al. Melanocortin 3 receptor-expressing neurons in the ventromedial hypothalamus promote glucose disposal[J]. Proc Natl Acad Sci U S A, 2021, 118(15).
6. KHODAI T, NUNN N, WORTH A A, et al. PACAP neurons in the ventromedial hypothalamic nucleus are glucose inhibited and their selective activation induces hyperglycaemia[J]. Front Endocrinol (Lausanne), 2018, 9: 632.
7. FLAK J N, GOFORTH P B, DELL’ORCO J, et al. Ventromedial hypothalamic nucleus neuronal subset regulates blood glucose independently of insulin[J]. J Clin Invest, 2020, 130(6): 2943-2952.
8. GARFIELD A S, SHAH B P, MADARA J C, et al. A parabrachial-hypothalamic cholecystokinin neurocircuit controls counterregulatory responses to hypoglycemia[J]. Cell Metab, 2014, 20(6): 1030-1037.
9. MEEK T H, NELSON J T, MATSEN M E, et al. Functional identification of a neurocircuit regulating blood glucose[J]. Proc Natl Acad Sci U S A, 2016, 113(14): E2073-E2082.
10. MOJSOV S, WEIR G C, HABENER J F. Insulinotropin: glucagon-like peptide I (7-37) co-encoded in the glucagon gene is a potent stimulator of insulin release in the perfused rat pancreas[J]. J Clin Invest, 1987, 79(2): 616-619.
11. GARVEY W T, FRIAS J P, JASTREBOFF A M, et al. Tirzepatide once weekly for the treatment of obesity in people with type 2 diabetes (SURMOUNT-2): A double-blind, randomised, multicentre, placebo-controlled, phase 3 trial[J]. Lancet, 2023, 402(10402): 613-626.
12. SINGH I, WANG L, XIA B, et al. Activation of arcuate nucleus glucagon-like peptide-1 receptor-expressing neurons suppresses food intake[J]. Cell Biosci, 2022, 12(1): 178.
13. KIM K S, PARK J S, HWANG E, et al. GLP-1 increases preingestive satiation via hypothalamic circuits in mice and humans[J]. Science, 2024, 385(6707): 438-446.
14. SHEN J, WANG M, PANG G, et al. GLP-1 receptor agonist exendin-4 suppresses food intake by inhibiting hindbrain orexigenic NPY neurons[J]. Am J Physiol Endocrinol Metab, 2025, 328(5): E661-E674.
15. BENTSEN M A, MIRZADEH Z, SCHWARTZ M W. Revisiting how the brain senses glucose-and why[J]. Cell Metab, 2019, 29(1): 11-17.
16. RAMIREZ S, GOMEZ-VALADES A G, SCHNEEBERGER M, et al. Mitochondrial dynamics mediated by mitofusin 1 is required for POMC neuron glucose-sensing and insulin release control[J]. Cell Metab, 2017, 25(6): 1390-1399.
17. CHEN Z, DENG X, SHI C, et al. GLP-1R-positive neurons in the lateral septum mediate the anorectic and weight-lowering effects of liraglutide in mice[J]. J Clin Invest, 2024, 134(17): e178239.
18. HILL J W, ELIAS C F, FUKUDA M, et al. Direct insulin and leptin action on pro-opiomelanocortin neurons is required for normal glucose homeostasis and fertility[J]. Cell Metab, 2010, 11(4): 286-297.
19. TAN H L, YIN L, TAN Y, et al. Leptin-activated hypothalamic BNC2 neurons acutely suppress food intake[J]. Nature, 2024, 636(8041): 198-205.
20. ANAND B K, CHHINA G S, SHARMA K N, et al. Activity of single neurons in the hypothalamic feeding centers: Effect of glucose[J]. Am J Physiol, 1964, 207: 1146-1154.
21. HUANG Z, LIU L, ZHANG J, et al. Glucose-sensing glucagon-like peptide-1 receptor neurons in the dorsomedial hypothalamus regulate glucose metabolism[J]. Sci Adv, 2022, 8(23): eabn5345.
22. SISLEY S, GUTIERREZ-AGUILAR R, SCOTT M, et al. Neuronal GLP1R mediates liraglutide’s anorectic but not glucose-lowering effect[J]. J Clin Invest, 2014, 124(6): 2456-2463.
23. ORFALI R, ALWATBAN A Z, ORFALI R S, et al. Oxidative stress and ion channels in neurodegenerative diseases[J]. Front Physiol, 2024, 15: 1320086.
24. YOULE R J, VAN DER BLIEK A M. Mitochondrial fission, fusion, and stress[J]. Science, 2012, 337(6098): 1062-1065.
25. HENSCHKE S, NOLTE H, MAGOLEY J, et al. Food perception promotes phosphorylation of MFFS131 and mitochondrial fragmentation in liver[J]. Science, 2024, 384(6694): 438-446.
26. GOMEZ-VALADES A G, POZO M, VARELA L, et al. Mitochondrial cristae-remodeling protein OPA1 in POMC neurons couples Ca2+ homeostasis with adipose tissue lipolysis[J]. Cell Metab, 2021, 33(9): 1820-1835.
27. LIAO Y, LIM Y S, CHU P, et al. Inflammatory milieu induces mitochondrial alterations and neuronal activations in hypothalamic POMC neurons in a time-dependent manner[J]. Mol Neurobiol, 2023, 60(3): 1164-1178.
28. KANG G M, MIN S H, LEE C H, et al. Mitohormesis in hypothalamic POMC neurons mediates regular exercise-induced high-turnover metabolism[J]. Cell Metab, 2021, 33(2): 334-349.
29. TIMPER K, DEL RIO-MARTIN A, CREMER A L, et al. GLP-1 receptor signaling in astrocytes regulates fatty acid oxidation, mitochondrial integrity, and function[J]. Cell Metab, 2020, 31(6): 1189-1205.
30. BOLAND M L, LAKER R C, MATHER K, et al. Resolution of NASH and hepatic fibrosis by the GLP-1R/GcgR dual-agonist Cotadutide via modulating mitochondrial function and lipogenesis[J]. Nat Metab, 2020, 2(5): 413-431.
31. MA Y, KONG C, GUO Z, et al. Semaglutide ameliorates cardiac remodeling in male mice by optimizing energy substrate utilization through the Creb5/NR4a1 axis[J]. Nat Commun, 2024, 15(1): 4757.
【引用格式】贺承康,龚昌雄,彭舟舟,等.腹内侧下丘脑GLP-1R阳性神经元在糖稳态调控中的作用和机制[J]. 中国神经精神疾病杂志,2025,51(6):354-362.
【Cite this article】HE C K,GONG C X,PENG Z Z,et al.The role and mechanism of GLP-1RVMH neuron inregulating glucose homeostasis[J]. Chin J Nervous Mental Dis,2025,51(6):354-362.
DOI:10.3969/j.issn.1002-0152.2025.06.006
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)