首页 > 医疗资讯/ 正文
摘 要
欧洲心胸外科协会(European Association for Cardio-Thoracic Surgery,EACTS)近期更新并发布了《2024 EACTS成人心脏手术围手术期药物治疗管理指南》,该指南基于最新循证医学证据在基础疾病管理、抗血栓治疗、抗心律失常治疗、其他支持治疗等方面更新了相关推荐。本文旨在对该指南进行总结与解读,以促进临床医师在成人心脏手术围手术期规范化药物治疗,同时为相关领域临床研究的开展提供参考借鉴。
正 文
心脏手术是外科治疗成人心脏疾病的重要方式。心脏手术的预后不仅取决于手术适应证的正确选择和规范技术操作,还依赖于针对潜在原发或伴发疾病以及手术并发症的药物治疗。因此,围手术期药物治疗是确保心脏手术近期和远期疗效的关键,同时也对患者的生活质量和医疗费用具有重要影响。欧洲心胸外科协会(European Association for Cardio-Thoracic Surgery,EACTS)更新并发布了《2024 EACTS成人心脏手术围手术期药物治疗管理指南》[1],与上一版本(2017版)[2]相比,该指南基于最新循证医学证据,在基础疾病管理、抗血栓治疗、抗心律失常治疗、支持治疗等多个方面进行了更新(核心插图见附件图1)。本文旨在对该指南相关内容进行总结与解读,以促进我国临床医师对指南相关内容的借鉴,优化成人心脏手术围手术期药物治疗。
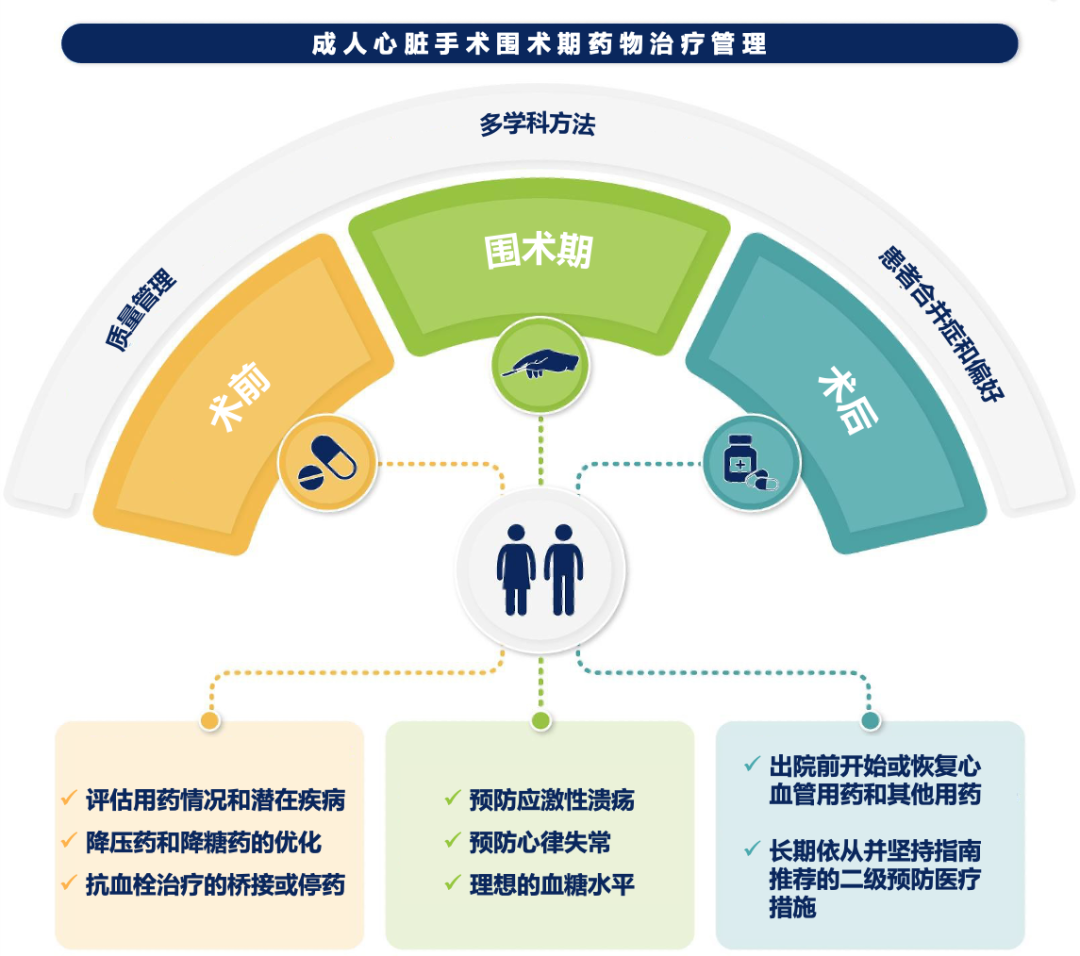
附件图1 成人心脏手术围术期药物治疗管理[1]
1 方法学
为充分体现心脏外科围手术期管理涉及的广泛专业领域,选择来自不同领域、地区,以及临床和研究背景的专家组成多学科工作组。采用标准化“人群、干预、对照、结局、时间”(Population,Intervention,Comparison,Outcome and Time,PICOT)问题格式开展系统文献回顾。基于对当前知识和证据的全面审查制定推荐意见,基于学会推荐的方法学[3],评估干预措施的风险和获益,推荐强度与证据等级遵循美国心脏协会(American Heart Association,AHA)、美国心脏病学会(American College of Cardiology,ACC)和欧洲心脏病学会(European Society of Cardiology,ESC)通用标准。
2 术前管理
择期心脏外科患者术前绝大多数正在服用需要特殊关注的药物,包括抗血小板、抗凝、降压和降糖药物等,因此建议在择期手术前7~14 d进行系统的药物梳理和调整,优化术前各种药物治疗(继续或中止),以确保患者安全和手术效果。
2.1 术前高血压(循证推荐1)
约75%的冠状动脉(冠脉)旁路移植术(coronary artery bypass grafting,CABG)患者和超过80%的外科主动脉瓣置换术(surgical aortic valve replacement,SAVR)患者合并高血压。高血压与患者住ICU时间延长和围手术期死亡率升高相关。术前收缩压>180 mm Hg(1 mm Hg=0.133 kPa)和舒张压>110 mm Hg,应该延缓手术。虽然抗高血压药物的血药浓度达峰值时间仅为数小时,但其临床作用可能持续数周,在术前管理该类药物时需要引起特别关注,应在术前仔细评估药物的降压作用以及其他临床获益,但也应该考虑其对围手术期血流动力学的影响。β 受体阻滞剂可降低手术死亡率和心房颤动(房颤)发生率,术前可持续使用至手术日。长效血管紧张素转化酶抑制剂(angiotensin-converting enzyme inhibitor,ACEI)、血管紧张素受体拮抗剂(angiotensin Ⅱreceptor blocker,ARB)应在术前24 h停药,术后早期根据血流动力学谨慎恢复。术前使用钙离子拮抗剂(calcium channel blocker,CCB)是安全的,但手术日同时使用β 受体阻滞剂和CCB需要十分谨慎,因为叠加负性肌力和减慢心率作用。已经在服的α2-肾上腺素能受体激动剂可继续使用,但不建议术前预防性使用。利尿剂可以持续使用至手术日,其副作用低血容量和电解质失衡很容易纠正。术前高血压用药建议见附件表1[1,4-6]。
附件表1. 术前高血压用药建议[1]

2.2 围手术期心律失常的预防(循证推荐2)
术后新发房颤(postoperative atrial fibrillation,POAF)是心脏术后最常见的心律失常,发生率约为15%~50%,其中90%发生于术后6 d内。POAF与卒中、血栓栓塞等并发症及远期死亡风险相关,早期复发的房颤可能增加未来心力衰竭住院风险。围手术期需重视心律失常的预防,指南[1]推荐在术前和术后继续使用β 受体阻滞剂,但对于术前无房颤患者应从小剂量、短效制剂开始。使用胺碘酮预防术后房颤的循证依据尚未明确,故推荐等级不高。此外,指南[1]明确不建议术前早期使用类固醇类激素或他汀类药物预防术后房颤。围手术期心律失常预防建议见附件表2[1,7-12]。
附件表2. 围术期心律失常预防建议[1]

2.3 应激性溃疡的预防(循证推荐3)
心脏术后消化道出血发生率为0.5%~1%,但相关死亡率高达30%~40%。指南[1]建议术前及术后早期阶段使用胃黏膜保护药物以降低消化道并发症风险,并推荐优先使用质子泵抑制剂(proton pump inhibitors,PPIs)而非组胺-2 受体拮抗剂(histamine-2 receptor blockers,H2RBs)。应激性溃疡的预防建议见附件表3。
附件表3. 应激性溃疡预防建议[1]

3 抗栓治疗
抗血栓药物包括抗血小板药和抗凝药,可有效降低缺血事件风险,但不可避免增加出血风险。围手术期需平衡血栓预防与出血风险,心脏手术根据紧急程度可分为:急诊手术(24 h内)、限期手术(本次住院期间)、择期手术(可延迟),抗栓药物的使用应根据不同手术紧急程度作出相应决策。
3.1 阿司匹林(循证推荐4)
许多明确诊断冠脉粥样硬化性心脏病(冠心病)并拟行CABG的患者,已经接受低剂量阿司匹林(75~100 mg/d)治疗作为二级预防。持续使用阿司匹林可以降低心肌梗死风险,但会增加血液丢失和输血,而不增加再次开胸风险。出血风险与阿司匹林剂量相关(>100 mg)。对于高危冠心病及急性冠脉综合征(acute coronary syndrome,ACS)患者,需要平衡停药增加的缺血事件与持续使用导致的外科出血风险,术前停用阿司匹林仅适用于出血高危患者,如二次手术、慢性肾病4/5期、凝血功能障碍等。因此,推荐CABG患者术前持续使用低剂量阿司匹林,而非CABG心脏手术可于术前3 d停药。CABG患者术后应尽早(6 h内)恢复低剂量阿司匹林治疗,可减少死亡和缺血并发症,以及静脉桥血管闭塞。高剂量(如325 mg/d)阿司匹林可能会增加消化道出血风险。阿司匹林用药建议见附件表4和附件图2[1,13]。
附件表4. 阿司匹林用药建议[1]

CABG:冠状动脉旁路移植术。
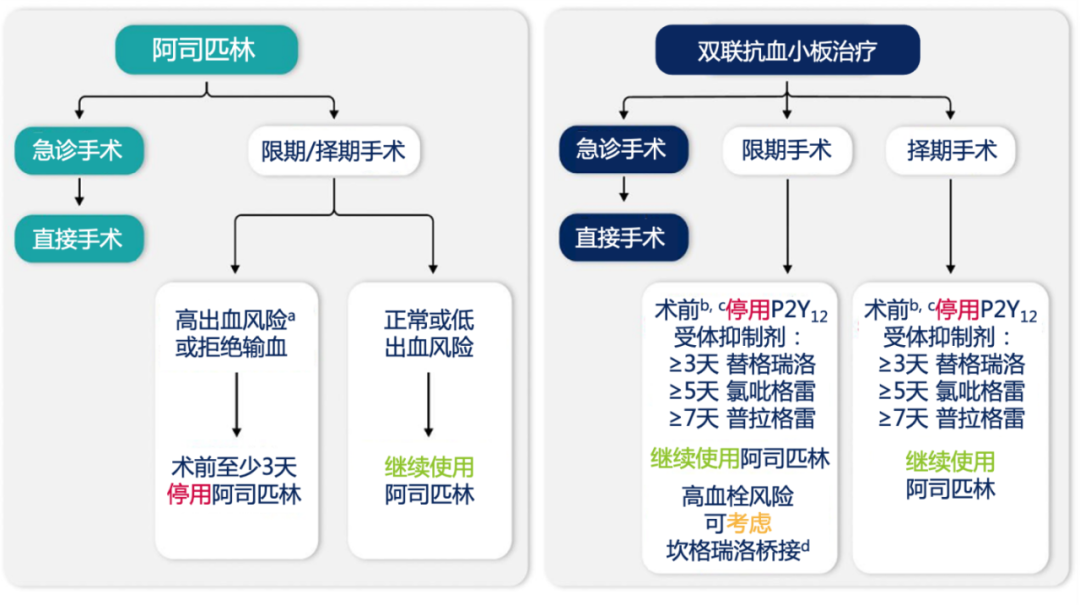
附件图 2. 接受心脏手术患者的单药或双联抗血小板药物管理[1]
a:复杂和二次手术、严重肾功能不全、先天性或获得性出血性疾病;b:临床情况允许下的最佳停药时间;c:可考虑进行血小板功能检测以优化手术时机;d:近期支架植入、近期血栓事件或冠脉造影结果高危。
3.2 P2Y12受体抑制剂(循证推荐5)
双联抗血小板治疗(dual antiplatelet therapy,DAPT)为阿司匹林联合P2Y12受体抑制剂(氯吡格雷、替格瑞洛、普拉格雷),被推荐应用于冠脉介入治疗(percutaneous coronary intervention,PCI)和ACS患者,但会增加自发性大出血和外科出血。 因此,推荐心脏手术前应尽可能及时停用P2Y12受体抑制剂,择期手术可能需要推迟到DAPT完成;急诊和限期手术患者,尤其是ACS合并或不合并并发症,则无法停药等待手术,可以采用半衰期超短的P2Y12受体抑制剂坎格瑞洛进行桥接。术前P2Y12受体抑制剂停药时间取决于药物代谢动力学,在停药期间,阿司匹林应该继续使用。推荐氯吡格雷术前停药至少5 d,替格瑞洛至少3 d,普拉格雷至少7 d。术前血小板功能检测有助于评估残存血小板抑制和凝血功能恢复情况,尤其在ACS患者,优化手术时机和提升手术安全性方面,很有价值。术后管理方面,推荐ACS综合征患者应尽早(如术后48 h)重启DAPT,包括CABG和非冠脉心脏手术,可降低桥血管闭塞、全因死亡和缺血事件风险。CABG术后DAPT的临床获益可能被增加的出血风险抵消,ACS患者的获益要高于慢性冠脉综合征患者,替格瑞洛的获益要大于氯吡格雷。归根结底,DAPT需要个体化,根据患者特征、手术指征,权衡抗栓获益与出血风险。在安全前提下,ACS患者和/或PCI后需要DAPT的患者,CABG术后应该尽快恢复DAPT。P2Y12受体抑制剂用药建议见附件表5和附件图2[1,14-24]。
附件表5. P2Y12受体抑制剂用药建议[1]

DAPT:双联抗血小板治疗;PCI:经皮冠状动脉介入治疗;CABG:冠状动脉旁路移植术。
3.3 糖蛋白Ⅱb/Ⅲa受体拮抗剂(循证推荐6)
由于高效的口服和静脉P2Y12受体抑制剂治疗日趋普遍,糖蛋白Ⅱb/Ⅲa 受体拮抗剂(如依替巴肽、替罗非班)的使用已变得有限,指南[1]仅对其术前停用时间作出了低证据等级的推荐。糖蛋白Ⅱb/Ⅲa受体拮抗剂用药建议见附表6。
附件表6. 糖蛋白Ⅱb/Ⅲa受体拮抗剂用药建议[1]

CABG:冠状动脉旁路移植术。
3.4 术前抗凝和桥接(循证推荐7)
口服抗凝治疗(oral anticoagulation,OAC)对预防血栓栓塞至关重要。择期手术需平衡抗凝中断的出血风险与血栓风险。对于使用维生素 K 拮抗剂(vitamin K antagonist,VKA)的患者,推荐术前停用VKA至少4 d,可以接受手术的目标国际标准化比值(international normalized ratio,INR)≤1.5,而且至少2次,其中1次为手术当日。INR>1.8,则需口服或静脉低剂量维生素K(1.0~2.5 mg)。直接口服抗凝药(direct oral anticoagulant,DOAC)目前被推荐应用于静脉血栓预防和非瓣膜病性房颤,心脏手术前其具体停药时间取决于药物类型、半衰期、剂量方案、适应证以及患者的肝肾功能。肾功能正常的患者应在手术前 36~48 h停用,肾功能不全的患者,尤其主要经过肾脏代谢的药物(如达比加群),则停药时间需要更长(沙班类72~96 h,达比加群96 h)。接受DOAC治疗的患者,限期心脏手术应该延期48 h,择期手术则根据药物检测结果和凝血酶原时间(prothrombin time,PT)。针对VKA停药后的桥接治疗,仅对于高血栓事件风险的患者,首选普通肝素(unfractionated heparin,UFH)或低分子量肝素(low-molecular-weight heparin,LMWH),且推荐在术前 2~4 h停用 UFH,并检查活化部分凝血活酶时间(activated partial thromboplastin time,APTT)水平,同时考虑 LMWH 的类型及剂量,最晚在术前 12 h停用LMWH。通常情况下,由于快速和可逆转药物代谢动力学,DOAC停药后无需桥接治疗。目前尚无确切的循证依据明确UFH和LMWH的最佳术前停用时间,根据药物半衰期,推荐术前2~4 h停用UFH,术前至少12 h停用LMWH。对于急诊心脏手术患者,无法及时停用VKA,推荐凝血酶原复合物(包括凝血因子Ⅱ、Ⅶ、Ⅸ和Ⅹ)联合维生素K作为一线治疗拮抗VKA,根据体重和INR调整剂量。对于急诊非出血并接受抗活化凝血因子X(activated coagulation factor X,FXa)DOAC的患者,建议使用4-因子凝血酶原复合物(50 U/kg)进行拮抗。术前使用达比加群的急诊手术患者,可以使用凝血酶原复合物、重组Ⅶ因子、伊达鲁珠单抗进行拮抗。但是,安替奈坦α在急诊手术逆转沙班类抗凝剂的安全性和有效性尚未证实。术前抗凝治疗建议见附件表7和附件图3[1,25-26]。
附件表7. 术前抗凝治疗建议[1]

VKA:维生素K拮抗剂;INR:国际标准化比值;DOAC:直接口服抗凝剂;APTT:活化部分凝血活酶时间。
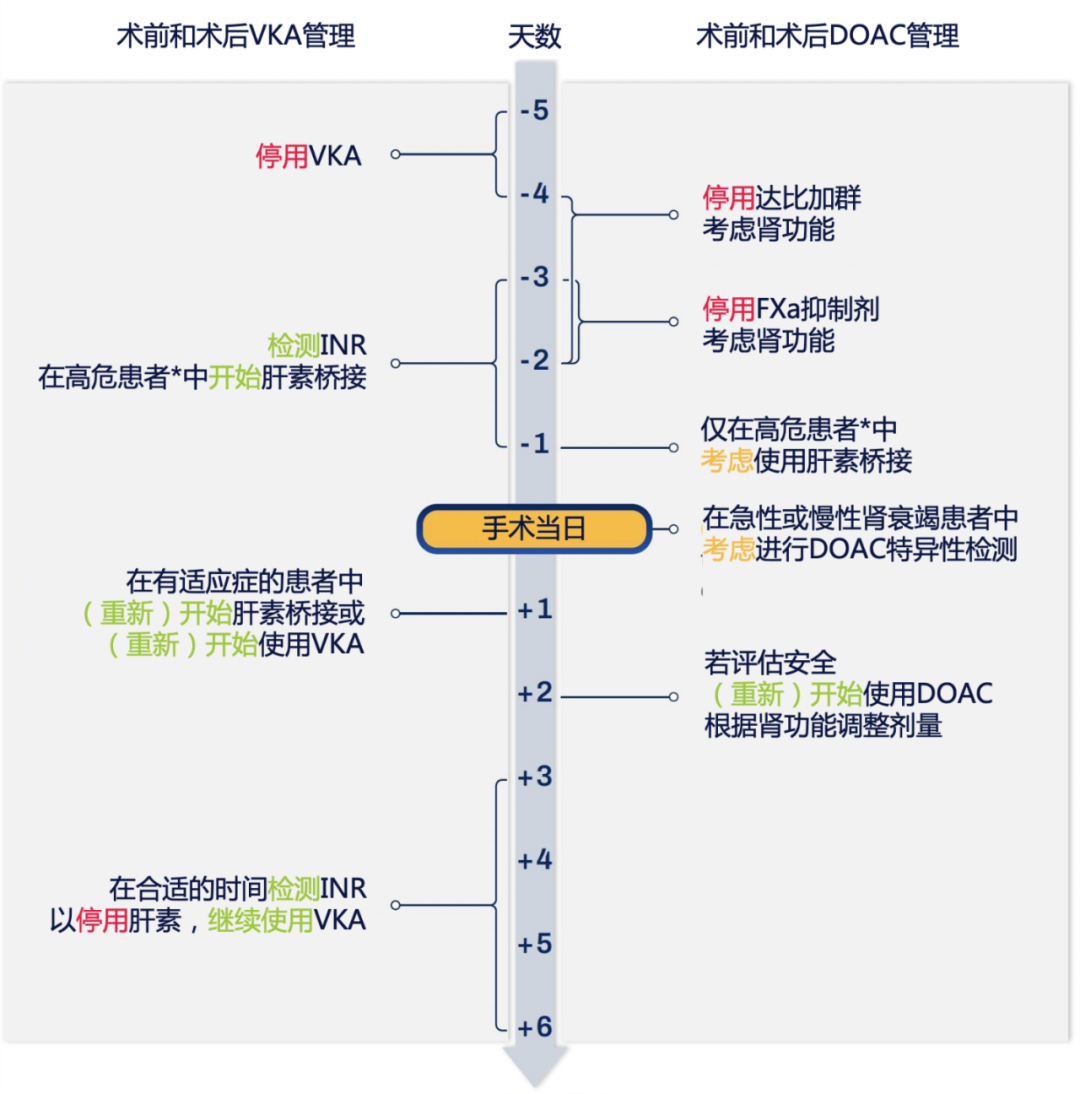
附件图3:VKA和DOAC的围术期管理[1]
*高危患者包括:机械瓣植入、风湿性瓣膜病合并房颤、近期(12周内)急性血栓事件、遗传或获得性易栓症、左心室心尖血栓。
3.5 术后桥接和长期抗栓药物管理
3.5.1 机械瓣(循证推荐8)
心脏手术中植入人工心脏瓣膜和人工材料显著增加血栓栓塞风险,因此,根据植入物类型和解剖部位,进行抗栓预防性治疗十分重要。
机械瓣置换术后患者需终身使用VKA并定期监测INR,术后第1天即可启动VKA治疗。为了降低血栓事件风险,在术后出血风险降低后(通常24 h内),可以联合肝素桥接(UFH或LMWH),在连续2次INR达标后停用肝素。机械瓣膜植入后1个月血栓栓塞风险达到高峰,并持续增加至术后6个月。INR目标值取决于机械瓣膜类型和瓣位(如主动脉瓣、二尖瓣、三尖瓣),以及患者特征(如近期血栓、年龄、肾功能),对于严重的先天性和后天性高凝状态、左室射血分数(left ventricular ejection fraction,LVEF)<35%、二尖瓣和三尖瓣位心脏瓣膜,目标INR为 3.0(2.5~3.5)。足够的治疗范围时间(time in therapeutic range,TTR)≥70%提示VKA治疗质量较高并可改善预后。新一代主动脉机械瓣或可降低INR目标,但对二尖瓣机械瓣患者仍需谨慎。药物与食物的相互作用、遗传因素、患者特征和合并症的巨大差异,导致VKA治疗的复杂性。因此,患者教育显得尤其重要,可提升治疗依从性、理想INR目标值和治疗质量。其他潜在的改进策略还包括基因检测指导剂量、药师干预的抗栓管理、应用程序(APP)线上用药管理等。目前DOAC在机械瓣患者中因血栓/出血风险增加而禁用。尽管VKA联用小剂量阿司匹林可能减少血栓事件,但会增加出血风险,仅推荐于合并动脉粥样硬化疾病或反复血栓栓塞而且INR在治疗范围内的患者。对于接受机械瓣膜并需要DAPT的患者,如近期冠脉支架植入或ACS,可在VKA基础上联合低剂量阿司匹林和氯吡格雷短期使用1个月,但不推荐替格瑞洛或普拉格雷。术后瓣膜抗栓治疗用药建议见附件表8和附件图4[1,27-41]。
附件表8. 术后瓣膜抗栓治疗用药建议[1]

a:包括机械瓣植入、风湿性瓣膜病合并房颤、近期(12周内)急性血栓事件、遗传或获得性易栓症、左心室心尖血栓。DOAC:直接口服抗凝剂;INR:国际标准化比值;TAVI:经导管主动脉瓣植入术;VKA:维生素K拮抗剂。
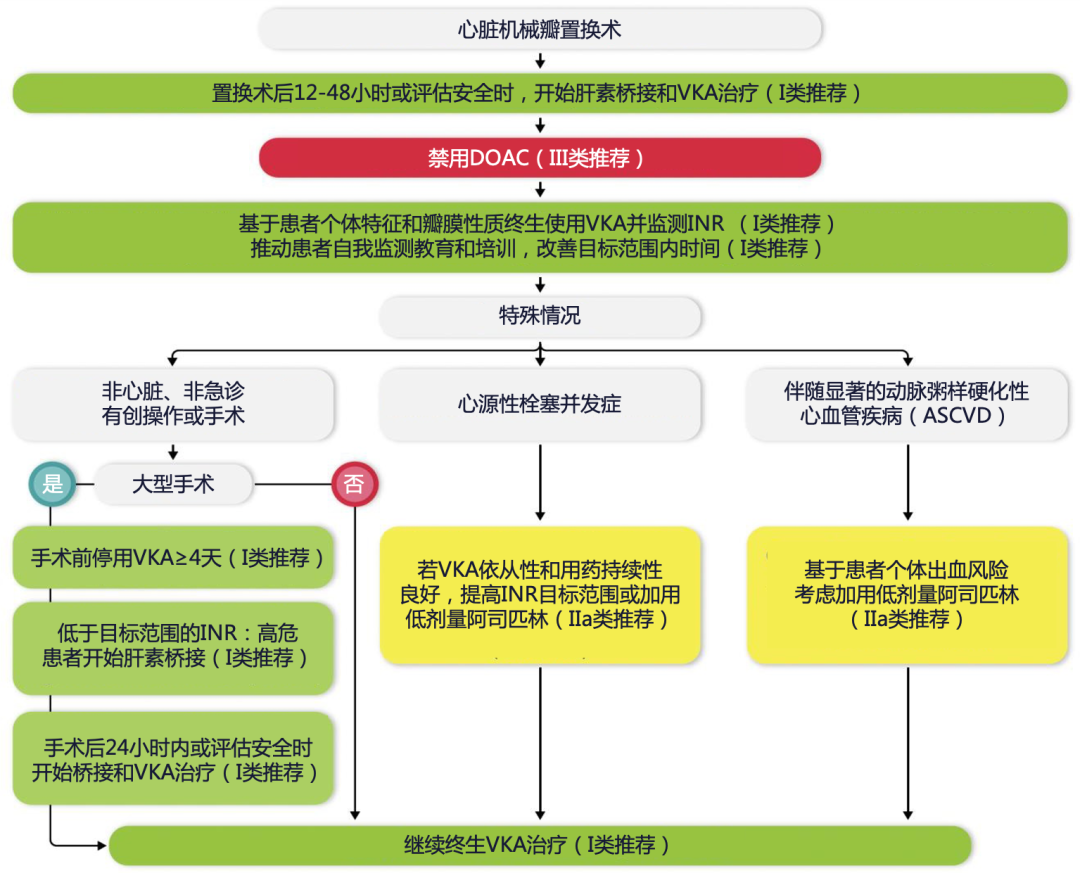
附件图4. 机械瓣膜置换术后患者的管理[1]
DOAC:直接口服抗凝剂;INR:国际标准化比值;VKA:维生素K拮抗剂。
3.5.2 生物瓣和瓣膜修复术(循证推荐8)
在15%~40%主动脉瓣生物瓣置换患者中,计算机断层扫描(computed tomography,CT)/磁共振成像(magnetic resonance imaging,MRI)可检出亚临床瓣叶血栓,引起收缩期跨瓣压差增大、主动脉瓣反流甚至缺血性脑卒中。因此,对于术前无OAC适应证的生物瓣置换患者,术后推荐使用VKA或小剂量阿司匹林3个月,但需要考虑患者出血风险,VKA高于阿司匹林。二尖瓣和三尖瓣位置更应考虑华法林治疗。治疗时间是否需要延长至6个月或12个月,研究结果不一致。对于术前就有OAC指征的主动脉瓣生物瓣置换患者,推荐术后长期使用OAC,而且对于该类患者临床上有DOAC逐渐替代VKA的趋势,但其获益与风险仍有争议,需更大规模研究验证。
瓣膜修复术后抗栓治疗目前缺乏高质量随机对照试验证据。大样本观察性研究显示,无OAC适应证的二尖瓣修复患者,术后使用VKA并不能降低脑栓塞风险,反而增加大出血风险,因此这类患者优先推荐选择小剂量阿司匹林治疗3个月。保留主动脉瓣的根部置换术和三尖瓣修复术的血栓风险较低,可参考类似策略,但需个体化评估。
经导管主动脉瓣植入术(transcatheter aortic valve implantation,TAVI)后无OAC适应证的患者,单用阿司匹林优于DAPT或利伐沙班+阿司匹林的治疗方案,后两者明显增加出血风险。对于有OAC适应证的TAVI患者,推荐术后继续单独使用OAC。单独使用OAC或VKA与其联合氯吡格雷的临床效果相当。目前缺乏TAVI术后12个月以上阿司匹林使用证据。经导管二尖瓣/三尖瓣植入后的抗栓策略也尚不明确,需个体化决策。瓣膜术后抗栓治疗用药建议见附件表8和附件图5[1,27-41]。
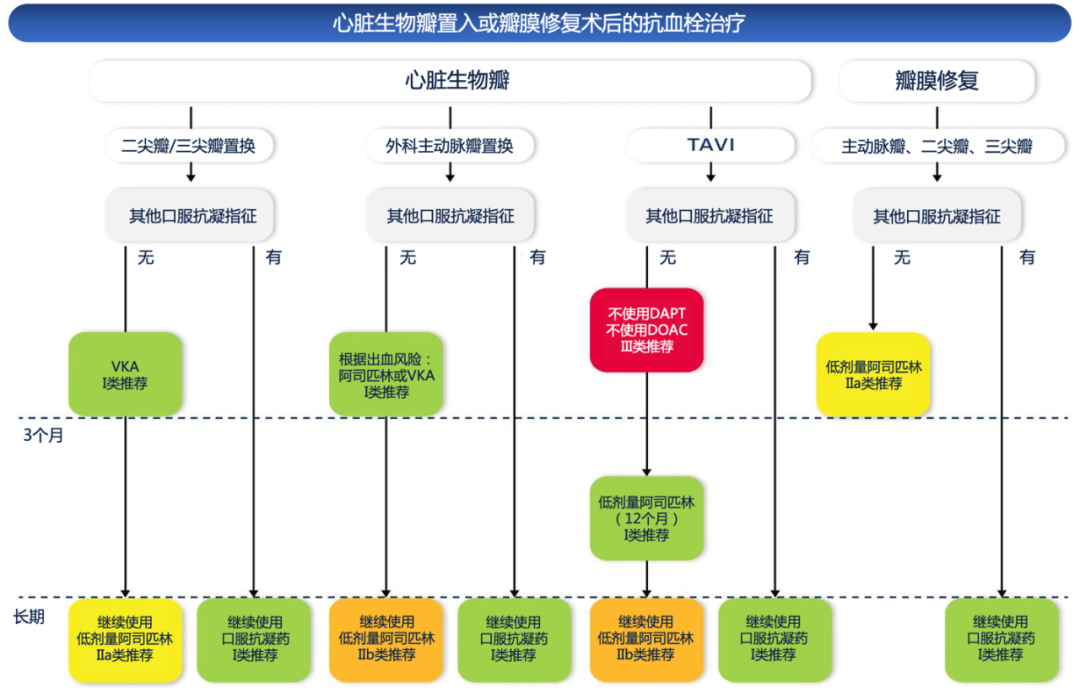
附件图5. 心脏生物瓣置换和瓣膜修复术后的抗血栓治疗[1]
TAVI:经导管主动脉瓣植入术。
4 术后新发房颤的抗心律失常药物治疗(循证推荐9)
POAF是指无房颤病史的新发房颤,发生率高达50%,危害包括增加术后并发症和延长住院时间,并与围手术期死亡、卒中、心肌梗死、急性肾功能损伤、远期死亡以及心力衰竭等相关。围手术期管理主要包括复律、心率控制治疗及血栓栓塞防治。血流动力学不稳定的患者,推荐紧急电复律。血流动力学稳定的患者,节律控制优先于心率控制,首选胺碘酮。对于心率控制的药物选择,在 LVEF 正常的患者中,首选β受体阻滞剂或地尔硫卓/维拉帕米(如果 β受体阻滞剂禁忌),而LVEF降低的患者应使用β受体阻滞剂,洋地黄均可以用于这两种情况。血栓栓塞预防方面,目前尚无明确证据支持何时或是否应开始使用 OAC 治疗,需要根据个体出血和血栓风险进行权衡。一旦发生持续性POAF,24 h内应该启动UFH(最常用)或LMWH治疗,直到窦性节律恢复或启用OAC。VKA或者DOAC应在POAF发作48 h后启动并维持至少4周。对于非瓣膜性POAF,选择DOAC是合理的。抗心律失常药物用药建议见附件表9[1,42-45]。
附件表9. 抗心律失常药物用药建议[1]

POAF:术后心房颤动。
5 术后肾素-血管紧张素-醛固酮系统抑制剂、醛固酮受体拮抗剂和钠-葡萄糖协同转运蛋白-2抑制剂的应用(循证推荐10)
肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)抑制剂包括:ACEI、ARB、醛固酮受体拮抗剂(mineralocorticoid receptor antagonist,MRA)和直接肾素抑制剂(direct renin inhibitor,DRI)四类药物,用于治疗全身性高血压和射血分数降低型心力衰竭(heart failure with reduced ejection fraction,HFrEF),且对肾功能有保护作用。无论心脏手术后心功能状况如何,RAAS抑制剂可以改善心室重构、提高远期生存率。因此,无论 LVEF 是否正常,均建议在术后对心力衰竭患者启动 RAAS 抑制剂治疗,如果不能耐受ACEI,则推荐ARB作为替代,但是二者不能同时使用以避免低血压、高血钾和肾功能损害并发症。对于HFrEF患者,建议联合使用 MRA。对于 LVEF 降低(≤40%)且尽管已接受 ACEI、β 受体阻滞剂、MRA 及钠-葡萄糖协同转运蛋白2(sodium-glucose cotransporter-2,SGLT2)抑制剂治疗后仍有症状的HFrEF 患者,建议用沙库巴曲/缬沙坦替代 ACEI(注意换药从小剂量开始使用,监测并防治低血压)。无论患者的LVEF如何,心力衰竭患者均建议术后使用 SGLT2 抑制剂,但可能存在发生正常血糖性酮症酸中毒的风险。术后RAAS抑制剂、MRA和SGLT2抑制剂的用药建议见附件表10[1,46-56]。
附件表10. 术后肾素-血管紧张素-醛固酮系统抑制剂、醛固酮受体拮抗剂和钠-葡萄糖协同转运蛋白-2抑制剂的用药建议[1]

ACEI:血管紧张素转化酶抑制剂;ARB:血管紧张素受体阻滞剂;LVEF:左室射血分数;eGFR:估算的肾小球滤过率;MRA:醛固酮受体拮抗剂;RAAS:肾素-血管紧张素-醛固酮系统;SGLT2:钠-葡萄糖共转运蛋白2;CABG:冠状动脉旁路移植术;TAVI:经导管主动脉瓣植入术。
6 术后β-受体阻滞剂的应用(循证推荐11)
心脏手术后β受体阻滞剂的短期应用可明确降低术后房颤和各类心律失常风险,尤其对合并心肌梗死史或LVEF<35%的患者还可减少死亡。目前建议对合并心肌梗死史或LVEF低下的患者启用或维持β受体阻滞剂治疗,但对术后稳定患者长期使用的必要性仍需更多高质量研究证实。术后β受体阻滞剂的用药建议见附件表11[1,57-58]。
附件表11. 术后β受体阻滞剂的用药建议[1]

LVEF:左心室射血分数。
7 降脂药物(循证推荐12)
基于STICS(Statin Therapy in Cardiac Surgery)等研究的明确结论,术前不推荐未使用者启动他汀治疗,因其不能降低围手术期心肌损伤或房颤风险,反而可能增加急性肾损伤风险;但长期服用者可考虑在术前继续用药。CABG术后强烈推荐他汀治疗,尤其是高强度方案,可显著降低心血管事件发生率和再次血运重建风险。对于冠心病患者,推荐高强度或最大耐受剂量的他汀治疗,治疗目标为低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)<1.4 mmol/L或较基础值降低50%,可以显著降低CABG远期死亡率。单纯他汀治疗不达标时,推荐联合使用依折麦布、前蛋白转化酶枯草溶菌素9(PCSK9)抑制剂或贝派地酸(他汀不耐受者)。对于高甘油三酯血症患者,一线药物仍然为他汀,如果疗效欠佳,可考虑联合二十碳五烯乙酯,但需个体化评估。长期坚持他汀治疗对改善心脏手术后患者预后至关重要。主动脉瓣置换术后患者也可能从他汀治疗中获益。降脂药的用药建议见附件表12[1,10-12,46,59-66]。
附件表12. 降脂药的用药建议[1]

LDL-C:低密度脂蛋白胆固醇;CABG:冠状动脉旁路移植术;PCSK9:前蛋白转化酶枯草溶菌素9; TAVI:经导管主动脉瓣植入术。
8 类固醇(循证推荐13)
类固醇虽可能缩短ICU/住院时间并降低呼吸系统并发症风险,但无法降低死亡率,减少心肌梗死、卒中或肾衰竭等主要不良事件,且可能增加心肌损伤风险,故不建议在心脏手术中常规预防性使用类固醇。<65岁或炎症反应强烈的患者可能受益,但需进一步研究验证。长期使用类固醇者应维持术前剂量治疗。类固醇预防性用药建议见附件表13[1,67-68]。
附件表13. 类固醇预防性用药建议[1]

9 抗生素(循证推荐14)
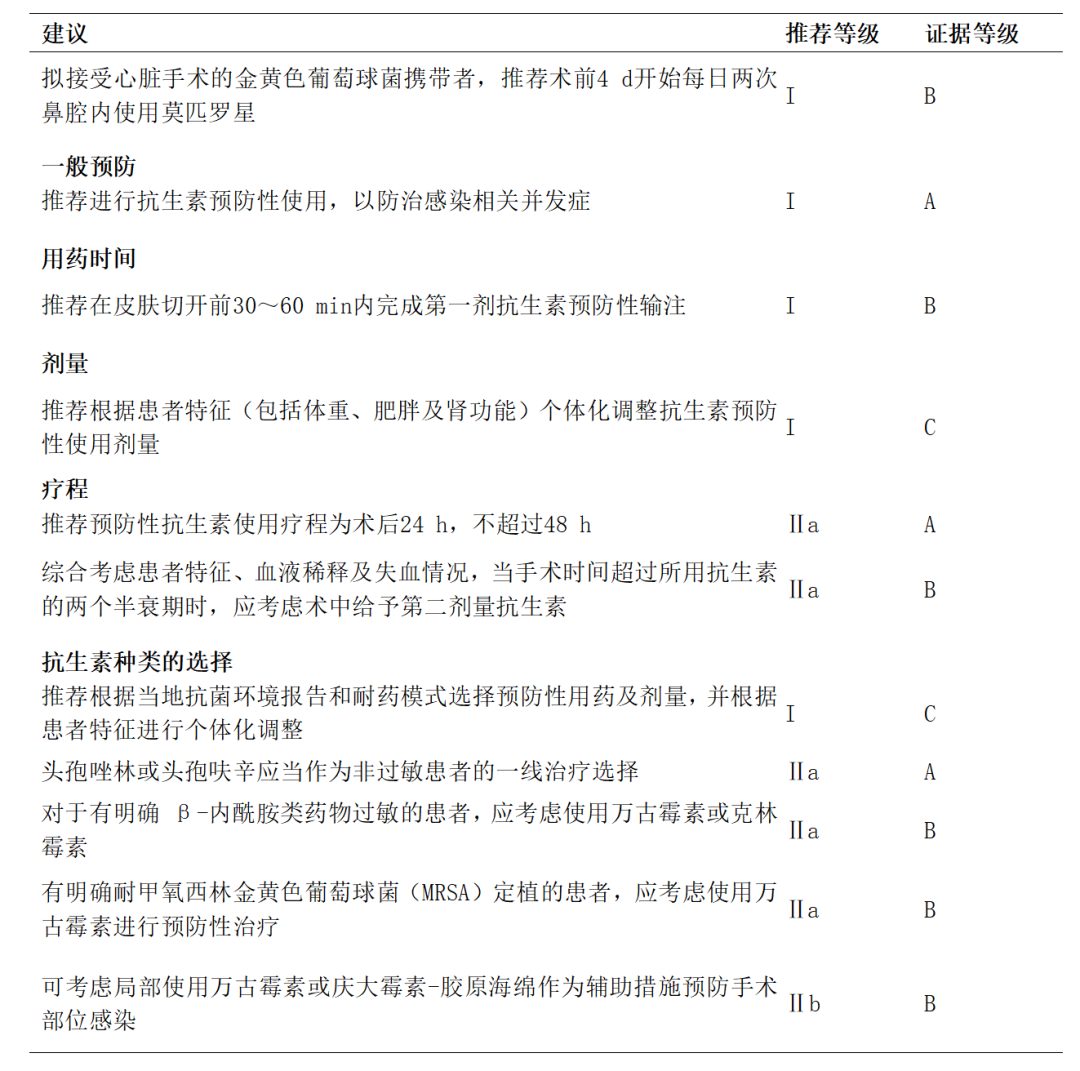
心脏手术后感染并发症发生率可达20%,胸骨深部伤口感染是严重并发症,显著增加患者死亡率。预防性抗生素使用可大幅降低手术部位感染风险,β-内酰胺类药物为首选。术前筛查金黄色葡萄球菌携带者并采取针对性预防措施尤为重要。抗生素应在皮肤切开前30 min内开始使用,并在体外循环期间追加剂量,术后持续24~48 h。特殊人群如β-内酰胺类过敏患者、肥胖患者和肾功能不全者需个体化调整用药方案。局部抗菌药物应用也可作为辅助预防措施。规范化的围手术期感染防控策略对降低心脏手术后感染风险至关重要。抗生素用药建议见附件表14[1,69-71]。
附件表14. 抗生素用药建议[1]
10 血糖管理(循证推荐15)
除术前确诊糖尿病的患者外,约30%的心脏手术患者存在未确诊空腹血糖升高,术前空腹血糖升高(>6.6 mmol/L)预示更高的术后并发症风险,建议入院时常规筛查空腹血糖和糖化血红蛋白(haemoglobin A1c,HbA1c)。围手术期血糖控制,必要时静脉应用胰岛素,目标值建议维持在<10 mmol/L,既要避免高血糖(>10 mmol/L)导致的感染和器官损伤风险,也要防止低血糖(<5.6 mmol/L)带来的危害。
SGLT2抑制剂被用于糖尿病、心力衰竭和慢性肾病治疗,但围手术期使用会增加酮症酸中毒(约0.1%)和尿路感染风险,建议在择期手术前3~4 d停用;未停用SGLT2抑制剂的急诊手术患者,应当密切关注血气酸中毒和尿液酮体;术后正常饮食、血流动力学平稳后,应该恢复SGLT2抑制剂的使用,可以降低手术死亡、心力衰竭再住院率。胰高血糖素样肽-1受体激动剂(glucagon-like peptide-1 receptor agonists,GLP-1RA)术前1 d~1周停药可降低误吸风险。噻唑烷二酮类药物因其潜在的液体潴留风险,禁用于合并心力衰竭的糖尿病患者。术后血糖管理应由多学科团队协作,目标HbA1c控制在7%以下。此外,规范的围手术期血糖管理策略对改善手术预后至关重要。血糖管理用药建议见附件表15和附件图6[1,72-75]。
附件表15. 血糖管理用药建议[1]

SGLT2:钠-葡萄糖共转运蛋白2;HbA1c:糖化血红蛋白。
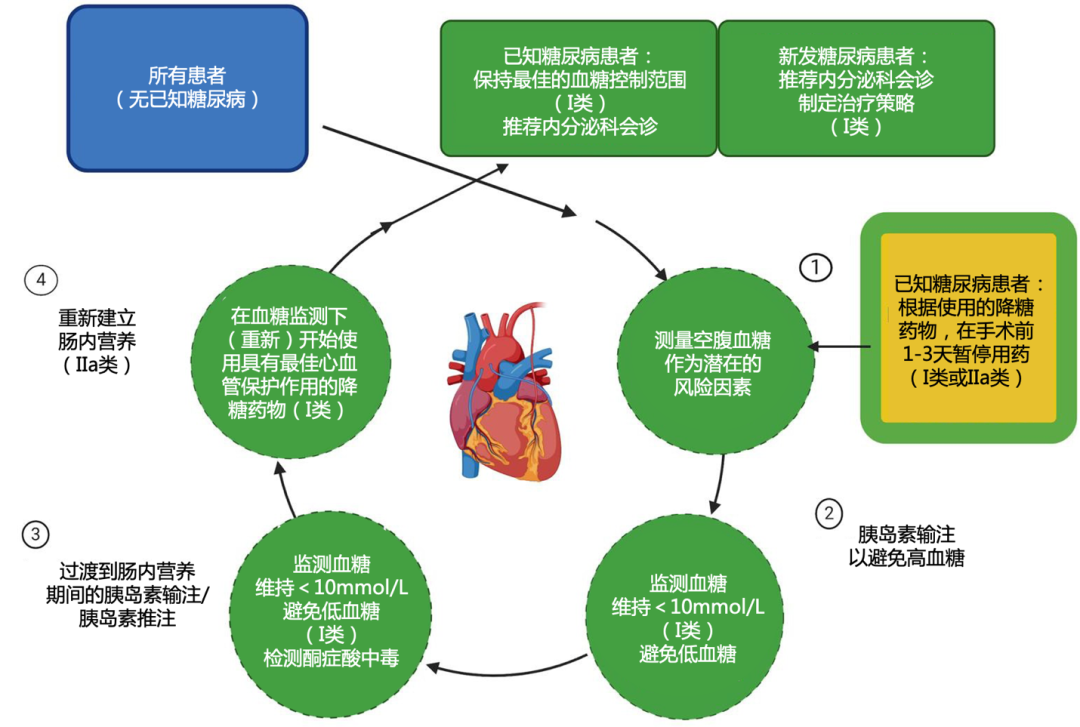
附件图6. 心脏手术前、手术中及手术后血糖监测与控制的管理[1]
11
抗抑郁药(循证推荐16)
心脏手术后抑郁发生率高达60%,谵妄10%~50%,会显著延长住院时间、增加并发症和死亡风险。选择性5-羟色胺再摄取抑制剂(SSRIs)和5-羟色胺-去甲肾上腺素再摄取抑制剂(SNRIs)是围手术期常用且相对安全的抗抑郁药物。由于联合使用会增加胃肠道出血风险,故不推荐手术患者在使用SSRIs的同时使用非甾体抗炎药(NSAIDs)。术后谵妄与高龄、术前抑郁和认知障碍相关,虽然苯二氮䓬类药物的影响尚存争议,但对老年患者仍建议尽量减少使用。三环类抗抑郁药因心脏毒性应避免用于手术患者,必要时需在精神科会诊后停药。抗抑郁药用药建议见附件表16[1,76]。
附件表16. 抗抑郁药的用药建议[1]

SSRIs:选择性5-羟色胺再摄取抑制剂;NSAIDs:非甾体抗炎药。
12 术后药物治疗的优化(循证推荐17)
心脏手术后指南指导的药物治疗(guideline-directed medical therapy,GDMT)对改善患者长期预后至关重要,但临床依从性普遍不足。对于CABG患者,指南[1]推荐终身使用小剂量阿司匹林和他汀类药物,ACEI/ARB适用于所有患者(无论是否合并高血压、糖尿病、慢性肾功能不全或左室功能减退),β受体阻滞剂则优先用于心肌梗死后、左室功能减退或残余心绞痛者。
非冠脉心脏手术(如主动脉瓣置换术SAVR和TAVI)患者同样能从长期他汀和ACEI/ARB治疗中获益,可降低全因死亡和主要心血管事件风险,但β受体阻滞剂的疗效尚存争议。
临床实践中,多药联用(≥5种药物)、药物不良反应及经济负担是影响GDMT持续性的主要障碍。改善策略包括:利用住院窗口期启动优化治疗、推广固定复方制剂、建立质量监测指标体系,以及通过远程监护和人工智能技术强化长期管理。医疗机构需制定个体化用药方案,定期评估潜在药物相互作用,同时加强患者教育,强调即使无症状也需坚持药物治疗,方能最大化手术获益。术后药物治疗优化的建议见附件表17[1,46,77-80]。
附件表17. 术后药物治疗优化的建议[1]
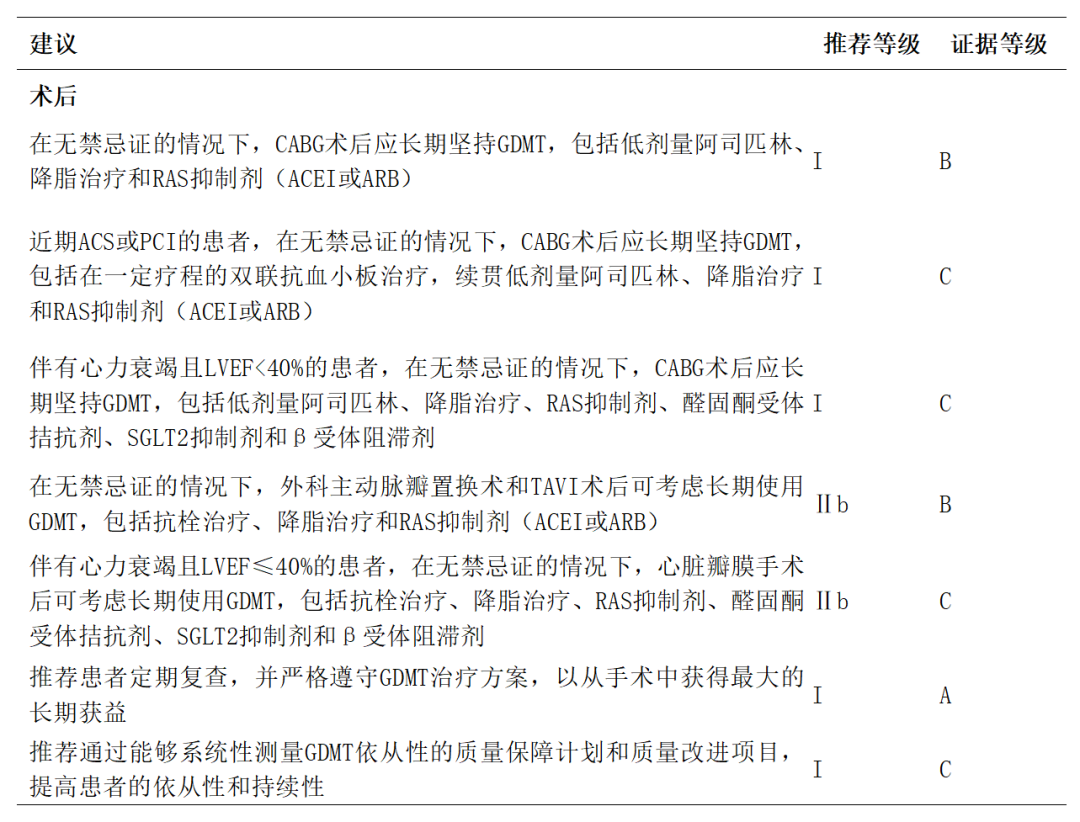
ACEI:血管紧张素转化酶抑制剂;ACS:急性冠脉综合征;ARB:血管紧张素 Ⅱ 受体拮抗剂;GDMT:指南推荐的药物治疗;LVEF:左心室射血分数;RAS:肾素-血管紧张素系统(renin-angiotensin system);SGLT2:钠-葡萄糖协同转运蛋白-2 ;TAVI:经导管主动脉瓣植入术。
13 知识缺口
心脏手术围手术期用药管理尚需深入研究以优化各治疗阶段;见附件附录1[1]。
附件附录1[1]:
知识缺口
术前管理
-
RAAS抑制剂停药与重启时机需明确
-
术前短期启用β受体阻滞剂预防术后心律失常需RCT验证
-
药物/非药物减重对心脏手术短期及长期结局的影响待阐明
抗栓药物
-
需平衡出血与血栓风险以优化术前抗栓方案
-
阿司匹林术前继续vs.停用、未用药者术前启用的必要性待验证
-
CABG后长期单抗选择(P2Y12抑制剂vs.阿司匹林)需比较
-
慢性冠脉综合征患者CABG后双抗是否优于单抗需明确
-
DOAC特异性拮抗剂(如Andexanet alfa)在心脏手术中的应用证据不足
-
外科主动脉瓣生物瓣置换或瓣膜修复后3个月内抗栓方案(阿司匹林vs. VKA/DOAC)需对比研究
术后房颤(POAF)
-
血栓/出血风险评估体系待建立
-
需明确哪些POAF患者需抗凝治疗及最佳疗程
术后管理
-
RAAS抑制剂术后重启时机与剂量需优化
-
非心衰患者β受体阻滞剂的应用价值待确认
他汀治疗
-
术前继续/暂停他汀的决策缺乏依据
-
非CABG心脏手术后长期他汀疗效不确定
感染防控
-
术前常规皮肤菌群筛查与局部抗生素预防价值待验证
-
体外循环手术中追加抗生素的必要性需评估
-
特殊人群(极低/肥胖体重、老年、糖尿病患者)的抗生素剂量调整策略待完善
血糖管理
-
术前HbA1c作为风险预测因子的价值未明确
-
术中/术后最佳血糖范围(尤其下限)需确立
-
持续血糖监测技术对个体化血糖管理的改进作用待研究
-
SGLT2抑制剂术前停药时间与正常血糖酮症酸中毒预防需更多数据
-
GLP-1RA联合胰岛素围术期应用的获益需验证
精神类药物
-
苯二氮䓬类药物风险收益比需进一步评估
-
SNRIs在心脏手术患者中的应用证据不足
指南指导药物治疗(GDMT)
-
非CABG手术后GDMT的实施效果亟待前瞻性研究
-
需探索不同人群对GDMT的响应差异以优化治疗方案
14 总结
随着心血管治疗手段的日益复杂化和患者特征(共病状态、老龄化、多重用药)的多样化,成人心脏手术围手术期用药管理需要心脏外科、心内科、麻醉科、重症监护和临床药理等多学科团队协同合作,并积极引导患者参与,以实现短期和长期治疗效益最大化、风险最小化。本指南由EACTS支持的多学科专家组制定,在整合最新证据基础上提供围手术期用药的循证建议(如抗栓治疗、糖尿病、高血压等特定临床情境的并发症预防),对证据不足领域则给出专家共识意见,同时强调需通过医患合作、跨学科协作来提升治疗依从性、改善手术质量和患者生活质量。指南着重优化3个关键环节:(1)从现有治疗到手术的平稳过渡;(2)围手术期新方案(感染预防、血糖控制、心律失常管理等)的时机与适应证;(3)基于循证证据的出院后长期管理,旨在系统性降低围手术期风险,并通过规范化的药物策略改善患者远期预后,最终实现医疗成本与健康效益的平衡(附件图7)。

附件图7. 《2024年EACTS成人心脏手术围术期用药指南》的关键信息[1]
RAAS:肾素-血管紧张素-醛固酮系统;SGLT2:钠-葡萄糖协同转运蛋白-2;TAVI:经导管主动脉瓣植入术。
利益冲突:无。
作者贡献:朱云鹏、张恒撰写初稿;韩梦圆翻译原文及图表;韩家炜整理参考文献;赵强、郑哲审阅并修改。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)