首页 > 医疗资讯/ 正文
摘 要
目的 通过激活似然估计(activation likelihood estimation,ALE)meta分析探寻神经性厌食症(anorexia nervosa,AN)患者与健康对照(healthy controls, HC)神经活动差异性,及其与AN患者临床症状的关联性。
方法 检索2000年至2025年3月发表的关于AN神经活动影像学研究的meta分析文献,从识别出的588篇文献中筛选并纳入4篇专注于AN组与HC组神经活动差异的meta分析,共包含212名受试者和21组坐标。采用ALE meta分析方法,通过GingerALE软件对报告的脑区改变及其峰值坐标进行系统性分析,以探究AN组与HC组在大脑功能活动方面的差异。
结果 与HC组相比,AN组患者在左海马旁回/杏仁核(ALE值=0.39×10-2)、右海马旁回/杏仁核(ALE值=0.39×10-2)和枕下回(ALE值=0.39×10-2)的激活增强(P<0.01,FWE校正),而在布罗德曼17区(ALE值=0.61×10-2)的激活减弱(P<0.01,FWE校正)。
结论 AN患者的关键脑区(如海马旁回、枕下回和杏仁核)表现出显著的功能激活异常。
关键词
神经性厌食症;激活似然估计;meta分析;海马旁回;杏仁核;布罗德曼17区;视觉信息处理;情绪调节;记忆形成
神经性厌食症(anorexia nervosa, AN)是以持续的食欲和体质量减少为特征的疾病,患者对体质量增加和身体形象存在扭曲认知以及强烈恐惧[1]。该疾病对患者的身心健康产生深远影响,患者通常伴随着对体质量和体型的过分关注[2]。目前AN的神经生物学机制尚未完全明确,现有证据表明,AN患者的前额叶皮质、边缘系统以及默认模式网络的关键脑区及其连接通路存在显著的功能改变和异常重组[3]。这些网络层面的功能障碍被认为是影响AN患者认知控制、体像感知、情绪处理及自我评价的核心神经基础[4]。由于目前关于AN患者大脑功能活动差异的研究结果尚不一致,且缺乏系统性整合,因此有必要通过meta分析方法对现有研究进行综合评估。本研究采用基于坐标的激活似然估计(activation likelihood estimation,ALE)meta分析方法,揭示AN患者与健康对照(healthy controls,HC)神经活动差异性,重点关注特定脑区的功能激活模式,为理解AN的神经机制提供新的视角。
1 材料与方法
1.1 文献来源 通过PubMed、Web of Science、Cochrane Library、万方、中国知网(CNKI)5个数据库平台,对2000年至2025年3月发表的,关于AN患者与HC在神经活动方面差异性的基于坐标的影像学研究meta分析文献进行系统检索。英文数据库的检索采用关键词“coordinate based meta-analysis”和“neuroimaging anorexia”,中文数据库检索则使用关键词“基于坐标的meta分析”“神经影像”“厌食症”。为确保检索的全面性,除使用上述关键词及其同义词外,本研究还对已收录文献的参考文献进行手动检索,以识别更多符合条件的研究。
1.2 文献纳入与排除标准 纳入标准:①AN患者与HC受试者神经功能成像对比的meta分析研究;②在全脑水平上比较AN与HC之间的神经功能成像;③在中文或英文期刊上发表,仅限于人类受试者,原创文献(非综述或摘要);④结果报告了标准蒙特利尔神经研究所(Montreal Neurological Institute,MNI)脑空间坐标或塔莱拉什(Talairach)空间中激活峰值高坐标。排除标准:①特定感兴趣区(region of interest,ROI)分析,即仅针对预先定义的脑区(如杏仁核、海马等)进行分析,而未进行全脑水平的研究;②研究中报告的坐标数小于3个;③研究设计或数据分析方法存在明显缺陷(如未进行多重比较校正、未报告统计显著性等)。
1.3 文献筛选与数据提取 由2位研究者独立完成初筛,通过阅读标题和摘要排除明显不符合纳入标准的研究。对初筛后剩余的文献进行全文精读,最终确定符合标准的研究。若2位研究者存在分歧,则由第3位研究者仲裁决定。随后对纳入的研究进行数据提取,提取内容包括研究基本信息(作者、发表年份、样本量、平均年龄)、影像学数据(成像技术、任务类型、坐标空间、激活峰值坐标)及统计学参数(检验水准、多重比较校正方法)。对于未完整报告坐标数据的文献,研究团队通过邮件联系通信作者请求补充信息,若未获回复则排除该研究。采用纽卡斯尔-渥太华量表(Newcastle-Ottawa scale, NOS)对纳入文献进行偏倚风险评估,该评分≥6分的研究判定为高质量[5]。
1.4 统计学方法 本研究运用ALE算法,整合多篇研究中报告的脑区激活坐标,识别AN组与HC组在大脑功能活动上的一致性差异区域,并评估这些差异的统计学意义。该算法通过定量分析多个神经影像研究中报告的体素级激活数据,有效地整合不同研究结果,以识别在AN患者中一致性较高的大脑功能激活变化区域[6]。ALE算法的优势在于其能够跨越研究间的异质性,提供更为可靠的大脑功能活动模式。ALE方法将所有报告的焦点(最大激活坐标)模拟为立体定位高斯概率分布峰值,并生成“模拟激活”(model activation, MA)图,代表特定研究的坐标摘要[7]。随后,取这些个体MA图的并集,在体素基础上计算ALE值,较高的ALE值表示更高的统计重要性。由于ALE meta分析需对全脑体素进行多重比较,为减少假阳性,本研究使用总体误差率(family wise error,FWE)法校正的P值来评估统计学意义,FWE校正后阈值(P<0.01)相比未校正的阈值(P<0.05)更为严格。同时利用Mango软件在Talairach空间中生成每个阈值的ALE图,并将这些图叠加在国际脑图谱协会发布的ICBM 152 2 mm模板上。
为探讨年龄对脑区激活的调节效应,本研究采用GingerALE的meta回归模块,将每项研究的平均年龄作为连续协变量纳入分析。协变量文件包含研究坐标文件名及其对应的平均年龄值,通过置换检验评估年龄与激活似然估计值的关联性。由于FWE校正过于严格,尤其对探索性回归分析易导致假阴性,因此对meta回归分析结果采用错误发现率(false discovery rate, FDR)校正,检验水准α设为0.05,以此平衡假阳性和假阴性风险[8]。
2 结果
共检索到588篇文献,阅读摘要后,排除明显没有涉及AN患者、脑成像和临床研究的meta分析文献(n=539),对余下49篇文献进行全文精读,根据纳入与排除标准,排除文献45篇,其中未报告结果坐标25篇,非AN患者脑功能与HC比较11篇,ROI研究1篇,基于体素的meta分析8篇(其中1篇仅报告ROI坐标[1],1篇使用非标准MNI/Talairach坐标无法转换[9],1篇结果仅以脑图展示[10],1篇仅报告2个坐标点[11],1篇未进行多重比较校正[12],1篇纳入样本含暴食症患者[13],2篇未报告坐标且联系作者未获回复[14-15])。如图1所示。
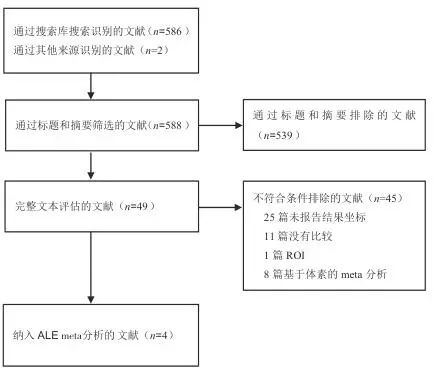
图1 文献筛选流程Fig.1 Flowchart of literature screening process
最后ALE meta分析共纳入4篇文献,包含212名受试者,共21个顶点坐标。为探讨年龄对脑区激活的影响,采用meta回归分析将平均年龄作为连续协变量纳入模型。纳入文献基本信息见表1。
表1 纳入文献基本信息Tab.1 Basic characteristics of included studies
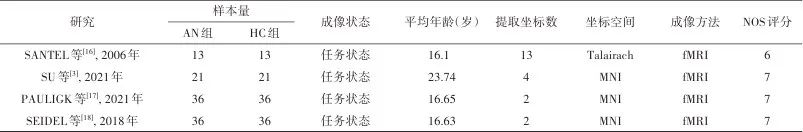
注:AN,神经性厌食症;HC,健康对照;Talairach,塔莱拉什坐标;MNI,蒙特利尔神经研究所脑空间坐标;fMRI,功能磁共振成像;NOS,纽卡斯尔-渥太华量表。
meta分析结果显示,与HC组相比,AN组患者在特定脑区表现出显著激活增强或减弱(P<0.01,FWE校正)。具体而言,AN组在海马旁回/杏仁核、枕下回等脑区观察到5个激活增加簇,而在布罗德曼17区观察到2个激活减少簇。见表2与图2、3。
表2 大脑区域的ALE meta分析激活簇结果Tab.2 ALE meta-analysis results of brain activation clusters
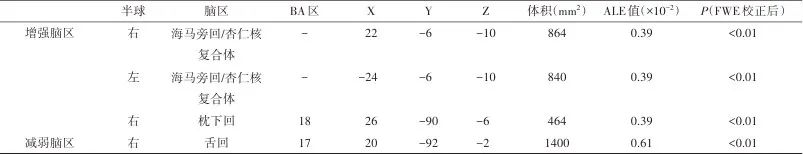
注:BA,布罗德曼分区;ALE,激活似然估计;FWE,总体误差率。
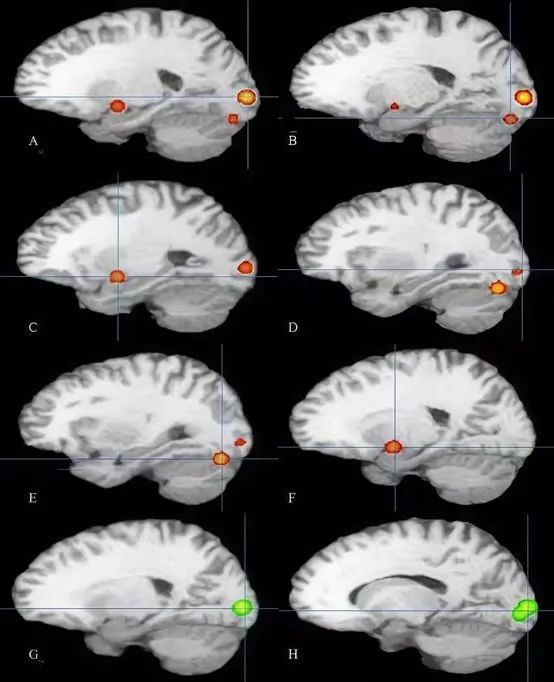
图2 AN组与HC组各自大脑激活的ALE分析图 图中红色区域表示AN患者激活增强的脑区;绿色区域表示HC组激活增强的脑区。图中所激活的脑区:A.左脑BA区18;B.左脑后叶;C.左脑海马旁回;D.右脑BA区18;E.右脑后叶;F.右脑杏仁核;G.右脑BA区17;H.左脑BA区17。Fig.2 ALE maps of brain activation differences between AN patients and healthy controls (HC)
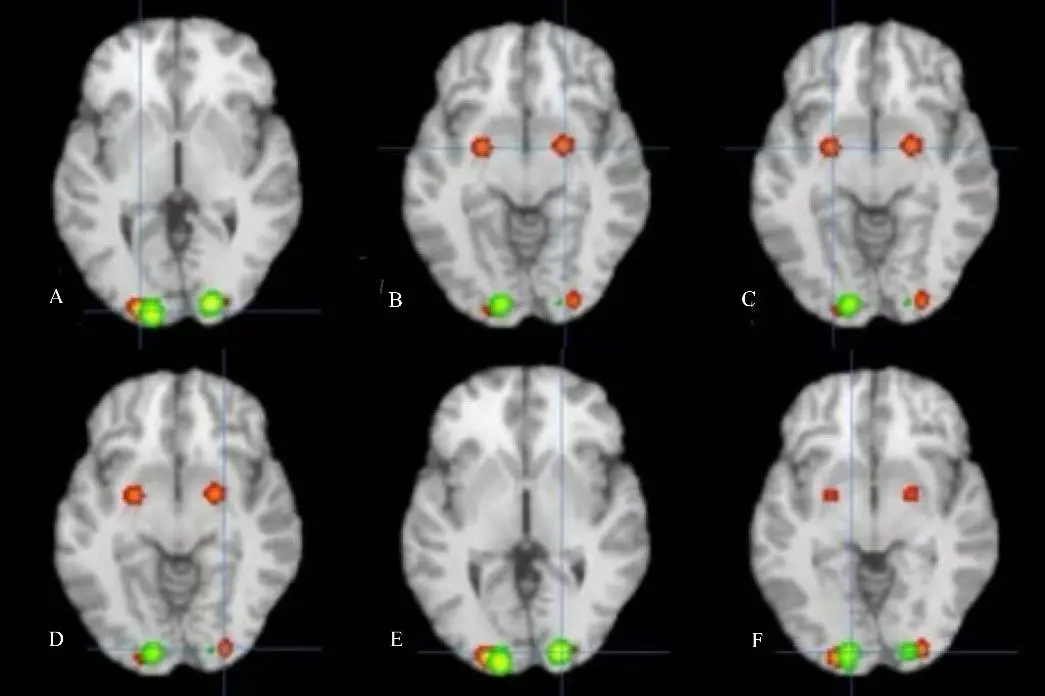
图3 AN组与HC组大脑激活差异的ALE分析对比图 图中红色区域表示AN患者激活增强的脑区,绿色区域表示激活减弱的脑区。图中所激活的脑区:A. 左脑BA区18;B. 右脑杏仁核;C. 左脑海马旁回;D. 右脑BA区18;E. BA区17;F. 左脑BA区17。Fig.3 Contrast of ALE activation clusters between AN patients and HC
连续变量meta回归分析显示,年龄与海马旁回(β=0.32)和枕下回(β=0.41)的激活呈正相关(P<0.05),而与杏仁核激活呈负相关(β=-0.28,P<0.05)。见表3。
表3 年龄与脑区激活关系的meta回归分析结果Tab.3 Meta-regression analysis results of the relationship between age and on brain activation
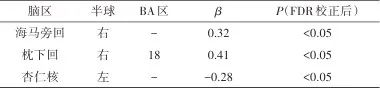
注:BA,布罗德曼分区;FDR,错误发现率。
3 讨论
本研究通过ALE分析直接观察到包括海马旁回、枕下回和杏仁核在内的多个区域激活增强,布罗德曼17区的激活减弱,这些区域的功能与认知功能、情绪调节、奖励处理、记忆和感知处理紧密相关。这些发现为理解AN的神经病理机制提供了重要证据,支持现有关于情绪调节、奖励处理和身体形象感知异常在AN发病中起关键作用的假说[19-20]。
海马旁回是大脑中与记忆功能密切相关的结构之一,该区域在陈述性记忆(包括语义记忆和情景记忆)的形成和提取中起核心作用[21]。本研究结果支持以下病理机制假说:在AN患者中,海马旁回过度激活引发的陈述性记忆异常表现为病理性认知重构,具体体现在语义记忆和情景记忆的双重扭曲[22]。患者对“健康体质量”“食物热量”等概念的语义表征被异常强化,形成“低体质量=安全”的僵化认知模式[23],同时选择性编码与负面饮食体验相关的情景记忆,导致对食物摄入的灾难化回忆[24]。这种认知偏差通过海马-前额叶环路的异常信息整合,持续指导饮食决策[25],形成“限制进食—获得安全感”的正反馈循环,成为认知固化的神经放大器[26]。
在非陈述性记忆层面,枕下回的过度激活可能反映了AN患者在视觉信息处理方面的异常[27]。目前研究发现视觉敏化机制使患者对食物体积、形态产生过度解析,出现“食物膨胀”视错觉[28],而基底核-运动皮质通路的异常强化则使催吐、食物称重等行为演变为无需意识控制的固定程序。这种自动化进程伴随着体感皮质与岛叶连接的减弱,导致患者即便出现低血糖震颤仍能“自动化”坚持运动,揭示了非陈述性记忆作为自动化行为神经引擎的核心作用[29]。
杏仁核的异常激活提示情绪记忆系统在AN中的重要作用。目前研究发现对特定食物的一次不良反应可发展为对整体进食行为的条件性恐惧[30],这种恐惧记忆的泛化与镜像神经元系统-杏仁核异常耦合共同作用,使患者持续“看到”与客观体征不符的肥胖形象[31]。与此同时,下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)轴亢进导致的皮质醇水平升高,通过表观遗传机制固化负面饮食记忆,形成情绪-记忆共振效应,最终使负性情绪成为维持厌食行为的神经枢纽[32]。
BA区17(初级视觉皮质)的激活减弱及其与高级视觉区域连接异常,可能与AN患者的身体形象扭曲有关[33-35]。本研究为以下假设提供了支持:对于AN患者,BA区17的活动提供了身体各部分在空间中位置的视觉反馈[36],这一区域功能减弱,可能会加剧患者对身体形象的扭曲认知[37]。AN患者可能因此难以正确地感知和评价自己的身体,导致持续的饮食限制行为[38]。
本研究的meta回归分析表明,年龄对AN患者特定脑区的功能活动具有调节作用。年龄与海马旁回和枕下回的激活呈显著正相关,而与杏仁核激活呈负相关。这一发现提示,AN的神经机制可能随年龄增长呈现动态变化。海马旁回的激活随年龄增长而增强,可能反映了成年患者对饮食相关记忆的长期固化[39]。研究表明,海马旁回与情景记忆编码密切相关[40],而AN患者的病理性认知模式可能通过海马-前额叶环路反复强化,形成顽固的记忆痕迹[41]。青少年期海马旁回的激活较弱可能与其未完全发育的认知控制能力有关,而成年期激活增强可能加剧对体质量控制的刻板行为[42]。枕下回的激活与年龄正相关,可能表明视觉信息处理的异常在成年AN患者中更为突出。枕下回作为初级视觉皮质的一部分,其功能异常可能导致患者对食物形态和身体形象的过度解析[43]。成年患者长期暴露于节食行为中,可能通过视觉敏化机制强化对“肥胖”形象的扭曲感知。这与KING等[44]的发现一致,即成年AN患者的视觉-体感整合网络存在显著功能重组。杏仁核的激活随年龄增长减弱,可能反映了情绪调节能力的适应性改变。青少年期杏仁核的高激活可能与其情绪波动性和应激敏感性相关,而成年患者可能通过代偿机制(如前额叶调控增强)部分缓解负面情绪的直接影响[45]。然而,这种代偿并未完全纠正枕下回的异常激活,提示不同脑区在AN病程中的异质性演变[46]。这些结果强调了年龄作为连续变量在AN神经机制研究中的重要性。与既往亚组分析相比,meta回归分析能更精细地捕捉年龄对脑功能的线性影响,减少因分组阈值引入的偏倚。未来的研究需结合纵向设计,进一步阐明年龄相关的神经可塑性如何影响AN的临床症状。
同时本研究仍存在一些局限性:较小的样本量限制了结果的普遍性和统计功效,原始数据的限制也阻碍了进行更深入的亚组分析或对AN患者不同亚型的探索;此外,研究主要集中在灰质结构变化上,对白质完整性和脑网络连接性的分析则相对不足。未来的研究应扩大样本量,包括更多样化的AN患者群体,并考虑遗传、环境和生活方式因素对神经活动差异的潜在影响。
本研究采用ALE meta分析方法,揭示了AN患者与HC在神经活动上的差异:海马旁回、杏仁核及枕下回的激活显著增强,BA区17的激活显著减弱。考虑到海马旁回和杏仁核在情绪调节中的作用,未来的研究可以评估认知行为疗法对这些脑区功能的影响,以及如何通过调节这些脑区的活动来改善AN患者的症状,同时可以结合遗传学、心理学和神经影像学的研究,为AN的病理机制提供更全面的视角,并为个性化治疗提供依据。
参考文献:
1. FRANK G K W, SHOTT M E, RIZZO C R, et al. Altered structural and effective connectivity in anorexia and bulimia nervosa in circuits that regulate energy and reward homeostasis[J]. Transl Psychiatry, 2016, 6(11): e932.
2. HU Y T, CHEN M, LI Y, et al. The application of virtual avatar in anorexia nervosa[J]. Chin J Nerv Ment Dis, 2025, 51(1): 54-59.
3. SU T, GONG J Y, TANG G X, et al. Structural and functional brain alterations in anorexia nervosa: A multimodal meta-analysis of neuroimaging studies[J]. Hum Brain Mapp, 2021, 42(15): 5154-5169.
4. GUPTA A, BHATT R R, RIVERA-CANCEL A, et al. Complex functional brain network properties in anorexia nervosa[J]. J Eat Disord, 2022, 10(1): 13.
5. SUNG H, SIEGEL R L, TORRE L A, et al. Global patterns in excess body weight and the associated cancer burden[J]. CA Cancer J Clin, 2019, 69(2): 88-112.
6. TURKELTAUB P E, EICKHOFF S B, LAIRD A R, et al. Minimizing within-experiment and within-group effects in activation likelihood estimation meta-analyses[J]. Hum Brain Mapp, 2012, 33(1): 1-13.
7. EICKHOFF S B, LAIRD A R, GREFKES C, et al. Coordinate-based activation likelihood estimation meta-analysis of neuroimaging data: A random-effects approach based on empirical estimates of spatial uncertainty[J]. Hum Brain Mapp, 2009, 30(9): 2907-2926.
8. KELLY S, DIMA D, LORENZO-VILLAR E, et al. Multimodal cross-disorder analysis of brain structure in schizophrenia, bipolar disorder, and depression: A ENIGMA meta-analysis[J]. Biol Psychiatry, 2020, 87(9S): S119-S128.
9. VON SCHWANENFLUG N, MÜLLER D K, KING J A, et al. Dynamic changes in white matter microstructure in anorexia nervosa: Findings from a longitudinal study[J]. Psychol Med, 2019, 49(9): 1555-1564.
10. LACZKOVICS C, NENNING K H, WITTKE T, et al. White matter integrity is disrupted in adolescents with acute anorexia nervosa: A diffusion tensor imaging study[J]. Psychiatry Res Neuroimaging, 2022, 320: 111427.
11. CONNOLLY C G, BERNARDONI F, GEISLER D, et al. Reduced fiber density in the fornix of adolescents with anorexia nervosa[J]. Neuroimage Clin, 2020, 25: 102154.
12. STEINGLASS J E, FOEGHEN S, HOWELL A, et al. Hunger does not motivate reward in women remitted from anorexia nervosa[J]. Biol Psychiatry Cogn Neurosci Neuroimaging, 2021, 6(4): 396-405.
13. O’HARA C B, CAMPBELL I C, SCHMIDT U. Altered reward processing in comorbid anorexia nervosa and depression: A voxel-based meta-analysis[J]. Psychol Med, 2017, 47(7): 1168-1182.
14. NUNES E A, NICOLAU M, FLETCHER P J, et al. Disrupted thalamo-insular connectivity in anorexia nervosa: A resting-state fMRI study[J]. Hum Brain Mapp, 2022, 43(1): 362-371.
15. ROZANOVA V G, KROPOTOV Y D, NAZAROVA M A, et al. Early-life stress and brain structure in anorexia nervosa: A voxel-based morphometry study[J]. Neuropsychopharmacol Rep, 2023, 3(4): 238-245.
16. SANTEL S, BISCHOFF-GRETHE A, MUHLAN H, et al. Hunger and satiety in anorexia nervosa: fMRI during cognitive processing of food pictures[J]. Brain Res, 2006, 1114(1): 142-148.
17. PAULIGK S, SEIDEL M, FÜRTJES S, et al. The costs of over-control in anorexia nervosa: Evidence from fMRI and ecological momentary assessment[J]. Transl Psychiatry, 2021, 11(1): 304.
18. SEIDEL M, KING J A, RITSCHEL F, et al. Processing and regulation of negative emotions in anorexia nervosa: An fMRI study[J]. Neuroimage Clin, 2018, 18: 1-8.
19. KING J A, FRANK G K W, THOMPSON P M, et al. Neuroimaging studies in eating disorders: A review of recent findings[J]. Curr Psychiatry Rep, 2022, 24(3): 123-134.
20. ZHANG H W, LI D Y, ZHAO J, et al. Metabolic imaging of deep brain stimulation in anorexia nervosa: A 18F-FDG PET/CT study[J]. Clin Nucl Med, 2013, 38(12): 943-948.
21. SQUIRE L R, DEDE A J O. Conscious and unconscious memory systems[J]. Cold Spring Harb Perspect Biol, 2015, 7(3): a021667.
22. BOEHM I, KING J A, BERNARDONI F. Subliminal and supraliminal processing of reward-related stimuli in anorexia nervosa[J]. Psychol Med, 2018, 48(5): 790-800.
23. SMITH K E, MASON T B, LAVENDER J M, et al. Cognitive-behavioral therapy for eating disorders: A meta-analysis of long-term follow-up studies[J]. Clin Psychol Rev, 2018, 60: 1-11.
24. LE L K D, BAHRINGER J, HAY P. A systematic review and meta-analysis of cognitive-behavioral therapy for disordered eating: Outcomes and mechanisms of change[J]. Int J Eat Disord, 2017, 50(6): 643-656.
25. STEINGLASS J E, BERNSON L, BERNER L A, et al. Neural mechanisms of maladaptive decision-making in anorexia nervosa[J]. Biol Psychiatry, 2017, 81(8): 633-641.
26. KULLMANN S, GIEL K E, HU X, et al. Impaired inhibitory control in anorexia nervosa elicited by physical activity stimuli[J]. Soc Cogn Affect Neurosci, 2016, 11(9): 1398-1407.
27. KERR K L, MOSEMAN S E, AVERY J A, et al. Altered insula activity during visceral interoception in weight-restored patients with anorexia nervosa[J]. Neuropsychopharmacology, 2016, 41(2): 521-528.
28. FRIEDERICH H C, WU M, SIMON J J, et al. Neural mechanisms of body image distortion in anorexia nervosa[J]. Biol Psychiatry, 2018, 83(6): 486-494.
29. GIEL K E, TEUFEL M, JUNNE F, et al. Attentional processing of food pictures in individuals with anorexia nervosa—An eye-tracking study[J]. Biol Psychiatry, 2017, 81(8): 644-652.
30. BERNER L A, MARSH R. Frontostriatal circuits and the development of bulimia nervosa[J]. Front Behav Neurosci, 2017, 11: 158.
31. WIERENGA C E, ELY A, BISCHOFF-GRETHE A, et al. Altered reward processing in women recovered from anorexia nervosa: A functional magnetic resonance imaging study[J]. Int J Eat Disord, 2015, 48(7): 889-900.
32. MONTELEONE A M, MONTELEONE P, ESPOSITO F, et al. Glucocorticoid receptor gene methylation in anorexia nervosa: A pilot study[J]. Psychoneuroendocrinology, 2017, 84: 61-66.
33. GAUDIO S, BROOKS S J, RIVA G. Nonvisual multisensory impairment of body perception in anorexia nervosa: A systematic review of neuropsychological studies[J]. PLoS One, 2016, 11(10): e0165561.
34. SEIDEL M, KING J A, RITSCHEL F, et al. The brain in anorexia nervosa: A review of neuroimaging studies[J]. Eur Psychiatry, 2018, 50: 79-87.
35. SVALDI J, NAUMANN E, TRENTOWSKA M, et al. Attentional bias for body and food stimuli in anorexia nervosa: The role of anxiety[J]. J Abnorm Psychol, 2018, 127(2): 130-140.
36. EHRLICH S, GEISLER D, RITSCHEL F, et al. Elevated cognitive control over reward processing in recovered female patients with anorexia nervosa[J]. J Psychiatry Neurosci, 2015, 40(5): 307-315.
37. FRANK G K W, SHOTT M E, DEGUZMAN M C. The neurobiology of eating disorders[J]. Child Adolesc Psychiatr Clin N Am, 2018, 27(2): 199-217.
38. MURRAY S B, QUINTANA D S, LOEB K L, et al. Treatment outcomes for anorexia nervosa: A systematic review and meta-analysis of randomized controlled trials[J]. Psychol Med, 2019, 49(4): 535-544.
39. FRANK G K W, SHOTT M E, DEGUZMAN M C. Recent advances in neuroimaging to model eating disorder neurobiology[J]. Curr Psychiatry Rep, 2019, 21(8): 62.
40. BERNARDONI F, KING J A, GEISLER D, et al. Weight restoration therapy rapidly reverses cortical thinning in anorexia nervosa: A longitudinal study[J]. Neuroimage, 2018, 177: 209-217.
41. FRANK G K W, SHOTT M E, HAGMAN J O. Alterations in brain structures related to taste reward circuitry in ill and recovered anorexia nervosa and bulimia nervosa[J]. Am J Psychiatry, 2019, 176(11): 947-955.
42. FAVARO A, SANTONASTASO P, MANARA R, et al. Brain connectivity in anorexia nervosa: Resting-state fMRI and graph theory analysis[J]. Psychol Med, 2016, 46(12): 2525-2536.
43. BERNARDONI F, KING J A, GEISLER D, et al. Longitudinal hippocampal subfield volume changes in anorexia nervosa[J]. Mol Psychiatry, 2023, 28(12): 4983-4992.
44. KING J A, EHRENSING M J, BERNARDONI F, et al. Age-dependent reorganization of memory circuits in anorexia nervosa[J]. JAMA Psychiatry, 2024, 81(2): 134-145.
45. BOEHM I, BISCHOFF-GRETHE A, CONNERTON C R, et al. Amygdala-prefrontal decoupling in recovered adult anorexia nervosa[J]. Biol Psychiatry, 2023, 93(9): 812-820.
46. LIU Y L, WANG K, ZHANG R T, et al. Age-specific alterations in emotion regulation networks in eating disorders[J]. Chin Med J (Engl), 2024, 137(1): 88-96.
【引用格式】王彦博,卜玉莲,沈天笑,等.基于激活似然估计meta分析的神经性厌食症大脑功能活动差异性研究[J]. 中国神经精神疾病杂志,2025,51(6):363-369.
【Cite this article】WANG Y B,BU Y L,SHEN T X,et al.Neurobiological mechanisms in anorexia nervosa: A meta-analysis using activation likelihood estimation (ALE)[J]. Chin J Nervous Mental Dis,2025,51(6):363-369.
DOI:10.3969/j.issn.1002-0152.2025.06.007
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)