首页 > 医疗资讯/ 正文
慢性淋巴细胞白血病(CLL)的治疗格局因新药(尤其是共价BTK抑制剂[cBTKis]和BCL-2抑制剂[BCL2is])的出现而发生了变革,许多CLL患者的预后显著改善,部分患者的预期寿命甚至可以与普通人群相比。然而,那些双重难治患者(即在接触过上述两类药物后仍出现疾病进展的患者)往往面临选择有限和预后较差的窘境,据报道中位生存期仅2.2年。
近年来,针对既往接受过BTKi和cBCL-2i治疗的CLL,出现了两种有前景的治疗选择:非共价BTK抑制剂(ncBTKi)匹妥布替尼和CD19 CAR-T疗法lisocabtagene maraleucel(liso-cel)。这些新方法具有独特的机制、疗效特点以及安全性和操作性考量,随着真实世界经验和试验数据的积累,其在临床实践中的应用也在不断发展。此外,异基因造血干细胞移植(allo-SCT)仍然是某些患者(尤其是高危且选择有限的患者)的可行选择。
然而总的来说,临床指导方面仍存在关键空白,特别是在治疗选择、序贯治疗以及专科治疗转诊时机的确定上。
《Blood》近日发表综述,Fred Hutch癌症中心Mazyar Shadman教授等通过几个病例,介绍了接受过cBTKis和BCL-2i治疗的CLL患者的管理方法,讨论了目前的治疗选择、巩固治疗的作用以及新兴策略的整合,以改善患者预后。

临床病例1
P.D.是一位78岁男性,患CLL已有9年,伴TP53突变、5种异常的复杂核型以及IGHV未突变。由于CLL,患者出现血细胞减少,并在六年前开始服用伊布替尼治疗;然而由于显著的关节和肌肉疼痛,尽管进行了剂量减少,症状仍未改善,在五个月后停止治疗。停用伊布替尼三个月后,淋巴结开始肿大并引起疼痛,随后开始接受维奈克拉和利妥昔单抗的联合治疗。完成了两年的疗程,并在三年多的时间里保持缓解状态。现在患者出现进行性淋巴结肿大细胞减少,符合治疗启动标准。患者目前需讨论治疗方案。
区分“双药暴露”与真正的“双药难治”CLL的重要性
该病例强调了一个重要观点,即先前接受过这两种主要药物类别治疗并不妨碍它们在后续复发中的使用。在这个案例中,患者因不耐受(而非疾病进展)而减少伊布替尼剂量后最终停药。尽管减少伊布替尼剂量有时是一种有效的策略,但许多患者需要换用二代cBTKis。前瞻性临床试验表明,二代cBTKis(如阿可替尼和泽布替尼)可以安全有效地用于对伊布替尼不耐受的患者。此外,对于那些对阿可替尼不耐受的患者,在接受泽布替尼治疗时,70%的不良事件并未在泽布替尼治疗期间复发,尽管患者接受泽布替尼治疗的时间比阿可替尼更长。因此,作者一般采取的方法是确保在宣布患者对cBTKi不耐受之前,确保已使用了这两种第二代cBTKis(阿可替尼和泽布替尼)。在极少数患者对所有cBTKis都不耐受的情况下,可以尝试使用匹妥布替尼,因为BRUIN试验的亚组分析显示,在cBTKi不耐受后匹妥布替尼具有耐受性,尽管其中对二代cBTKis(阿卡替尼或泽布替尼)不耐受的患者不到10%。
同样,先前接受过限时含维奈克拉方案治疗并不排除未来再次使用维奈克拉的可能性。在这个案例中,患者通过维奈克拉治疗获得了超过三年的缓解,因此在临床上再次考虑基于维奈克拉的治疗是合理的。前瞻性研究和回顾性研究支持这种方法的可行性,目前正在对ReVenG进行前瞻性试验以进一步研究(NCT04895436),早期数据表明维奈克拉再治疗很可能有效。
总之,由于cBTKis和维奈克拉是治疗CLL的两大最重要药物类别,强烈建议尽一切努力使用它们,除非记录到真正的不耐受或疾病进展。
临床病例2
R.L.是一位56岁女性,患有具有高危特征(del(17p)和IGHV未突变)的小淋巴细胞淋巴瘤(SLL)。出现大包块淋巴结肿大并开始维奈克拉和奥妥珠单抗一线治疗。完成治疗四年后,患者因进行性血细胞减少符合再治疗标准,开始接受泽布替尼治疗。患者保持缓解状态三年,但在泽布替尼治疗期间出现了进行性、有症状的淋巴结肿大。影像学检查和后续活检排除Richter转化,患者现在正在寻求有关治疗方案的信息。
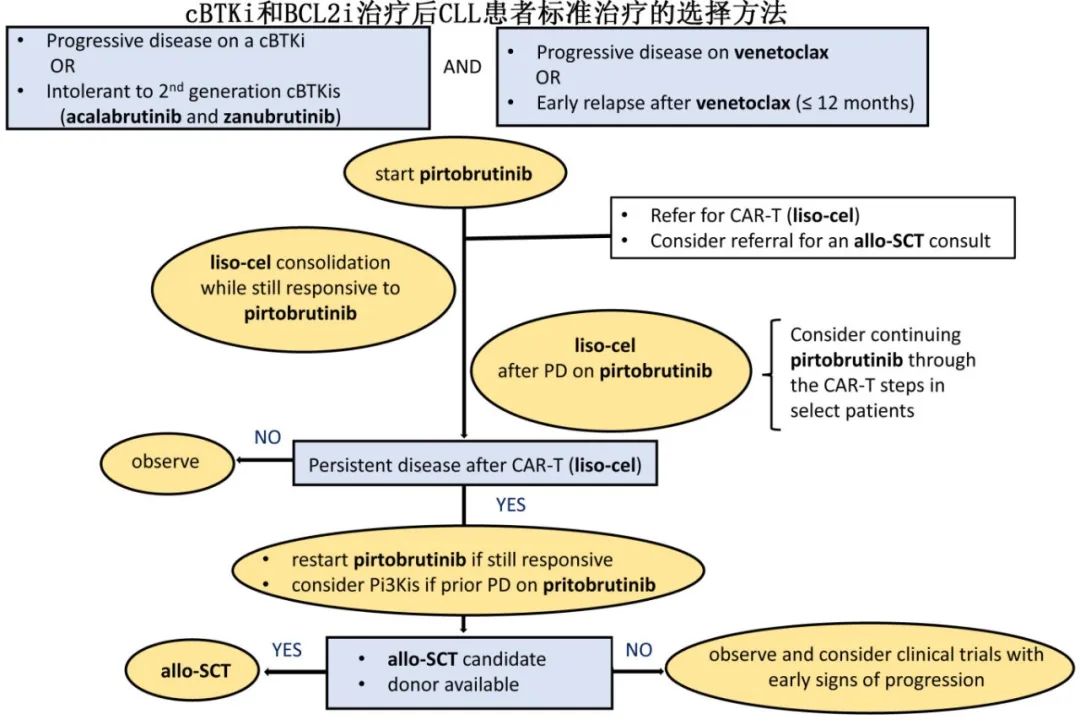
针对接受cBTKi治疗时疾病进展的患者的治疗选择
对于在接受cBTKi治疗期间疾病进展的患者,继续使用该药物直至有后续治疗方案并能获得治疗是至关重要的,因为过早停药可能导致疾病迅速恶化。如果决定将维奈克拉作为后线治疗药物,建议继续使用cBTKi直至达到维奈克拉的治疗剂量,以维持充分的疾病控制。cBTKi(伊布替尼、阿可替尼、泽布替尼)不应该用于在另一种cBTKi治疗期间疾病进展的患者,因为它们具有相同的机制和共享的耐药机制。如案例1所述,鉴于维奈克拉方案后的缓解持续时间,维奈克拉可以重新考虑作为治疗选择。如前所述,如果重新使用维奈克拉,通常需要与之前的cBTKi重叠使用。在某些情况下,快速维奈克拉剂量递增并在住院期间密切监测可能被采用,因为迅速达到治疗/目标剂量至关重要。尽管这不是维奈克拉的标准剂量策略,但这种方法在实际中已得到应用,并且一项关于快速、住院剂量递增的前瞻性试验正在进行中,初步结果已报告(NCT04843904)。
除了基于维奈克拉的治疗,还可以考虑两种新的CLL治疗方法:非共价BTK抑制剂(ncBTKi)匹妥布替尼和CAR-T产品liso-cel。选择这些选项取决于临床、疾病和患者特定因素。
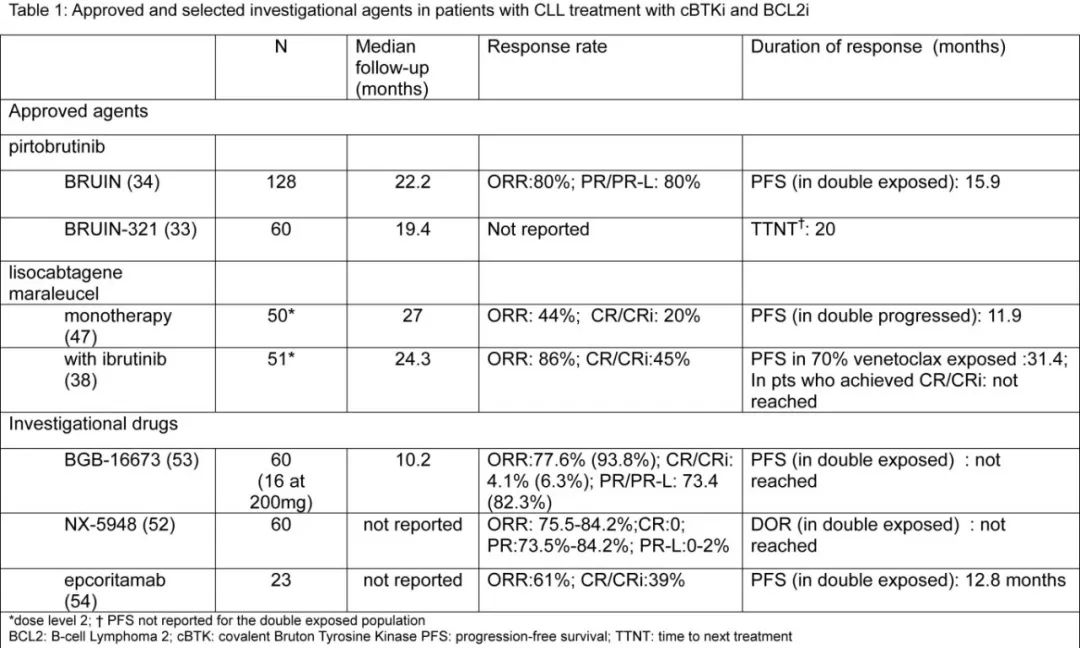
匹妥布替尼在BRUIN和BRUIN-321试验中显示出高缓解率,适用于具有高危特征且既往接受过cBTKi和维奈克拉治疗的患者。BRUIN是一项I/II期试验,其中100%的患者既往接受过cBTKi治疗,40.5%的患者接受过BCL2i治疗。BRUIN CLL-321是一项随机III期试验,比较了匹妥布替尼与标准治疗(研究者选择的伊布替尼联合利妥昔单抗或苯达莫司汀联合利妥昔单抗)。在这项研究中,所有患者均接受过cBTKi治疗,50%的患者接受过BCL2i治疗。两项研究显示,匹妥布替尼的缓解持续时间不到24个月,具体时间因高危遗传特征和既往治疗史而异。在BRUIN研究中,接受过维奈克拉治疗的患者的中位无进展生存期(PFS)为15.9个月。在BRUIN-321研究中,接受过维奈克拉治疗的患者的中位至下次治疗时间为20个月。
匹妥布替尼的一个优势是可以在停止使用cBTKi后立即开始使用,从而快速控制疾病并提供便利性。匹妥布替尼的疗效似乎与cBTKi失败后观察到的最常见耐药突变无关。然而,某些耐药突变(T474T和L528W)在匹妥布替尼和二代BTK抑制剂之间共享。作者常规对在cBTKi治疗期间疾病进展的患者进行耐药突变检测。但根据目前的数据,仍然优先使用匹妥布替尼,无论发现何种突变,因为即使存在耐药突变,仍可观察到临床反应。如果患者存在预先存在的匹妥布替尼耐药突变,尤其是当这些突变以高变异等位基因频率(VAF)存在时,患者可能经历比预期更短的PFS。因此,识别这些突变有助于指导治疗计划,包括更早地考虑使用CAR-T疗法或allo-SCT进行巩固治疗。
Liso-cel已获批用于既往接受过cBTK抑制剂和BCL-2抑制剂治疗的CLL患者。CAR-T疗法需要进行物流准备,因此无法立即实施。疾病负荷(治疗前的Rai分期、肿瘤体积(直径乘积之和)和β2微球蛋白)与较差的临床结局相关,因此在转诊、白细胞分离和清淋过程中维持疾病稳定至关重要。尽管长期缓解和持续疾病控制可行,但主要存在于达到完全缓解(CR)的患者,尤其是达到可测量残留病阴性(uMRD)的患者。然而事实上,接受liso-cel治疗的患者中,只有约20%能实现这种高质量缓解。
在一项非随机队列中,伊布替尼与liso-cel联合使用显示出改善liso-cel疗效的信号,CR率约为40%。伊布替尼可能通过减少B和T细胞的免疫抑制细胞因子、提高T细胞的细胞毒性以及改善抗CLL免疫来改善CAR-T的结果。在实际应用中,由于之前不耐受或在复发情况下考虑CAR-T治疗的患者中,伊布替尼通常并非复发情况下首选的BTKi。因此,如果可用,下一代BTKi(特别是ncBTKi匹妥布替尼)可以在围CAR-T期使用,但目前尚无关于这种方法的已发表数据。
对于希望将liso-cel作为下一步治疗的患者,作者仍会使用匹妥布替尼来控制疾病并维持低疾病负荷,作为CAR-T治疗的桥接。因为匹妥布替尼起效快,这对于应对CAR-T相关的挑战(如产品供应、生产延迟以及CAR-T文献中缺乏意向治疗数据)尤为重要。
磷脂酰肌醇3-激酶抑制剂(PI3Kis),如idelalisib和duvelisib,也可以在复发的CLL中考虑使用。然而,这些药物的批准基于未包括既往接受过cBTKi或BCL2i治疗的患者的研究。在BRUIN CLL-321试验中,对照组包括伊布替尼联合利妥昔单抗或苯达莫司汀联合利妥昔单抗,其中位PFS仅为7.6个月。此外,这些药物的副作用特征,包括感染并发症和免疫介导的毒性,在复发的CLL环境中可能特别具有挑战性。由于这些限制,作者仅在其他标准治疗或研究治疗方案不可用时才考虑使用PI3Ki。
临床病例3
M.S. 是一位 63 岁男性CLL患者,具有高危特征,包括 del(17p)和 IGHV未突变。患者出现有症状的淋巴结肿大和脾肿大,开始接受阿可替尼治疗。治疗 18 个月后,在 2-3 个月内逐渐注意到淋巴结进行性肿大。随后开始接受维奈克拉和利妥昔单抗的联合治疗,与阿可替尼有短暂重叠。然而,在治疗 15 个月期间,仍在服用维奈克拉时,患者出现全身淋巴结肿大。进行 PET-CT 扫描显示,全身淋巴结肿大,FDG 亲和力与 CLL 一致,未见提示组织学转化的放射学征象。在讨论各种治疗方案后,转为使用匹妥布替尼治疗,疾病得到控制。目前患者在开始使用匹妥布替尼治疗后 5 个月到诊所进行临床评估,并讨论巩固治疗的潜在作用。
关于在匹妥布替尼治疗下疾病得到控制的双药难治CLL患者的讨论要点
对于双药难治CLL 患者,匹妥布替尼可作为标准治疗(SOC)首选的立即治疗方案。虽然匹妥布替尼目前作为复发 CLL 的单一疗法已获得加速批准,但在完全停用维奈克拉之前,可以至少暂时考虑将匹妥布替尼添加到维奈克拉和利妥昔单抗中。这种联合疗法已被证明是安全有效的,并且正在进行一项前瞻性试验(NCT04965493)。
作为单药,匹妥布替尼在两项前瞻性试验中显示出高缓解率;然而,尽管其初期疗效显著,但匹妥布替尼的PFS通常不到两年。在 BRUIN 试验中,既往接受过 cBTKi 和 BCL2i 治疗的患者中位 PFS 为 15.9 个月。需要注意的是,该研究没有区分 “双药难治” 和 “双药暴露” 患者。同样,BRUIN CLL-321 试验纳入所有既往接受过 cBTKi 治疗的高危患者,其中一半接受过 BCL2i 治疗。匹妥布替尼组的中位 PFS 为 14 个月,但在双药暴露人群中未报告 PFS。研究者报告称,在匹妥布替尼组,未接受过维奈克拉治疗的患者下次治疗时间为 29.5 个月,而接受过维奈克拉治疗的患者为 20 个月。
在患者对匹妥布替尼出现疾病进展后,预后较差。在一项多中心回顾性研究中,Thompson 等报告了 90 名停止使用 ncBTKi 治疗的患者的中位 PFS 为 15 个月。75% 的患者要么出现 CLL 进展,要么经历 Richter 转化。对于未接受过维奈克拉治疗的患者(n=39),PFS 为 23 个月。而在 6 名接受过维奈克拉治疗的患者中,中位 PFS 仅为 8 个月。
因此,尽管匹妥布替尼是立即控制疾病的有效药物,但缓解通常不持久,至进展时间为 1-2 年,这意味着复发是预期之中的。因此,作者通常会向患者说明预期的缓解持续时间,并讨论巩固治疗(如 CAR-T 治疗或allo-SCT)的潜在作用。在开始使用匹妥布替尼之前,如果存在高危遗传风险或基线非 C481S 耐药突变,特别是在高 VAF(例如:T474I 或 L528W)的情况下,可能更需要在治疗早期追求巩固治疗,因为人们担心缓解时间会比预期短,尽管需要随访数据来了解非 C481S BTK 耐药突变对缓解持续时间的影响。
当 CAR-T 治疗(liso-cel)可用时,作者通常更倾向于在考虑异基因造血干细胞移植之前使用 liso-cel(见临床病例4),因为其安全性更有利,且在物流上有显著优势。作者会向患者强调,控制良好的疾病有助于更顺利地进行 CAR-T 过程,并且当疾病负担较低时进行 CAR-T 治疗预后通常较好。这些讨论应包括 liso-cel 的风险概况,包括细胞因子释放综合征(CRS)(3-4 级:4-8%)和神经毒性(3-4 级:11-19%)。
多项研究表明,在 CAR-T 期间及输注后可以安全地继续使用伊布替尼。还有新兴证据表明,伊布替尼可能对 T 细胞功能产生积极影响,并改善 CAR-T 治疗的安全性和疗效,如 TRANSCEND-CLL 试验所示。虽然目前这些数据仅适用于伊布替尼,但鉴于伊布替尼和匹妥布替尼在 BTK 特异性方面存在机制差异,作者通常会继续使用匹妥布替尼直到单采前,在某些情况下,如果临床需要,甚至会持续到清淋化疗后。该方案考虑到当前数据仅限于伊布替尼,而使用匹妥布替尼或其他 BTKi 是基于匹妥布替尼的预期疗效,以及在复发环境中伊布替尼的疗效和耐受性均有限。
作者会与患者讨论 CAR-T 治疗的临床疗效,以及根据是否同时使用 BTKi,预计约 20%-40% 的病例会出现长期缓解。理想情况下,应在匹妥布替尼失败前转诊进行 CAR-T 治疗,以确保在 CAR-T 后,如果需要未来的 CLL 治疗,匹妥布替尼仍然是一个可行的选择。
对于不适合巩固性 CAR-T 治疗或异基因造血干细胞移植的患者,或者对这些方法不感兴趣的患者,作者会提供密切监测,目标是及早发现临床进展的迹象。如果出现早期进展迹象,作者会重新评估风险-获益比,并讨论重新考虑适合的患者中CAR-T 治疗的潜力,以及对于不适合的患者,参加临床试验至关重要。
临床病例4
N.A. 是一位 61 岁女性 CLL 患者,具有 del(17p)、IGHV 未突变和复杂核型。患者接受伊布替尼和维奈克拉的一线治疗,但在完成治疗七个月后疾病进展。由于这种有效联合治疗后缓解期意外地短,因此进行了影像学检查(PET-CT)和组织活检,以排除 Richter 转化并重新确认 CLL 诊断。随后她始接受匹妥布替尼治疗,但治疗六个月后疾病进展。之后治疗方案改为duvelisib,并同时被转诊接受 CAR-T 治疗。患者接受 liso-cel 治疗,并出现了 2 级细胞因子释放综合征和 1 级神经毒性,在第 14 天都完全缓解。第 30 天的疗效评估符合部分缓解(PR)标准,第 90 天的重复影像学检查仍显示 PR,骨髓流式细胞术检测到 4% 的残留 CLL。患者没有合并症,正在考虑重新工作。患者今天到诊所寻求下一步治疗建议。
CAR-T治疗后疾病持续存在患者的管理
对于 CAR-T 治疗后疾病持续存在的患者,由于治疗选择有限且缺乏临床数据指导实践,处理起来很有挑战性。已知在使用 liso-cel 治疗并取得非CR或非 CR 伴uMRD的患者中,疾病进展率较高。根据 TRANSCEND CLL 试验,这些患者的中位PFS较短,根据是否使用伊布替尼,范围从 18 到 31 个月不等。在 BTKi 和维奈克拉治疗失败的组别(n=50)中,使用 liso-cel 单药治疗的中位 PFS 为 12 个月。因此,决策过程必须是共同决策,但也要成人证据水平有限。在这种情况下,应确保与患者讨论allo-SCT的选项,并让他们了解潜在的获益和风险。对于有意向的患者,作者启动与移植专家的正式会诊流程,评估他们的候选资格,考虑医疗合并症和护理人员的可用性。理想情况下,尽早开始寻找供者。
Allo-SCT 仍然是 CLL 唯一可能治愈的治疗方法。尽管随着新型 CLL 药物的引入,其使用有所减少,但对于双药难治患者,特别是 ncBTKi 和 CAR-T 治疗失败后,它仍是重要的选择。在 CLL 中,数据支持使用非清髓性或减强度预处理方案,不同供者来源(包括单倍型和脐带血移植)的结局相当。移植文献报告 PFS 均约为 40%。然而,非复发死亡率(NRM)仍然是一个重大挑战,突出了谨慎选择患者、及时转诊、共同决策和提前规划的重要性。通过现代移植策略,移植相关死亡率(TRM)报告在 10–20% 的范围内。
在与患者讨论 allo-SCT 时,强调疾病控制良好(CR 或非大包块PR)的必要性很重要,这在经过多线的患者中可能难以实现。评估新型药物时代 allo-SCT 结果的研究报告的结果与历史数据相当。如果患者不考虑 allo-SCT,强烈建议密切监测和早期发现复发,重点是尽可能将患者纳入临床试验。
需要注意的是,在世界许多地区,新型药物——特别是 ncBTKi 和 CAR-T 治疗——的可及性有限或不可用。尽管本文提出的管理方法基于能够获得所有当前可用选项的假设,但也认识到制定资源适应性建议的关键需求。在新型药物(ncBTKi 或 CAR-T)可及性有限或缺失的情况下,allo-SCT 的作用变得更加重要。在这种情况下,建议在疾病进展或对共价 cBTKi 或维奈克拉不耐受时启动讨论和转诊 allo-SCT,并可以在通过另一类药物获得反应后考虑。这包括那些在 cBTKi 失败后接受基于维奈克拉的治疗且疾病得到控制的患者,或在维奈克拉失败后(如基本进展或早期复发)基本得到控制的患者。鉴于在缺乏 ncBTKi 或 CAR-T 的情况下缺乏可靠的后续治疗选择,对于合并症状况可接受且处于部分或完全缓解状态的患者,考虑 allo-SCT 是合理的。
作者的治疗方案
对于曾经接受过cBTKi和BCL2i治疗的 CLL/SLL 患者中,作者首先需要区分双药暴露和双药难治。对一种 cBTKi 不耐受的患者通常能够耐受二代 cBTKi(全量或减量),并仍能获得临床获益。此外,固定疗程的维奈克拉方案治疗后出现进展的患者,如果缓解期至少达 12 个月,则仍可再次接受维奈克拉治疗。对于确认为双药难治或二代 cBTKi 不耐受的患者,尽可能优先推荐其参加临床试验。在本治疗背景下,优先推荐的标准治疗方案为匹妥布替尼(非共价 BTK 抑制剂)和liso-cel(CAR-T);而Idelalisib联合利妥昔单抗及duvelisib(PI3K 抑制剂)虽为可选方案,但非最优选。对于双药难治患者,利用 PET 扫描和活检进行适当的影像学检查,以排除 Richter 转化的可能至关重要。
通常作者会启动匹妥布替尼治疗以迅速控制疾病。作者会告知患者接受匹妥布替尼治疗后的预期缓解时间,并讨论 CAR-T(liso-cel)或allo-SCT作为巩固治疗的可能性。如果条件允许,作者优先选择 CAR-T 而非 allo-SCT,因为前者的安全性更高,且在物流安排上更具可行性。在疾病控制良好的情况下liso-cel的可行性和有效性最佳,凸显了利用匹妥布替尼取得疗效的重要性。在整个 CAR-T 制备期间可持续使用匹妥布替尼作为桥接治疗,并至回输后至少 90 天。在liso-cel治疗后密切监测患者反应。对于影像学检查、血液或骨髓中仍可检测到疾病的患者,可讨论早期复发的高风险。在这些情况下,建议尽早接受allo-SCT咨询,以评估是否符合移植条件。仅在无其他治疗方案可用时,作者使用 PI3K 抑制剂((idelalisib、duvelisib)。同时,接受这些药物治疗的患者需密切监测感染和免疫相关并发症。
未来策略
上述临床情况凸显了持续开展高危 CLL 治疗研究及新药开发的重要性。策略包括设计具有新作用机制的药物,以及优化现有药物类别以增强疗效同时保持可接受的安全性。如本文所述,对于曾接受过 CLL 最有效药物(cBTKi 和 BCL2i)治疗的患者,优先推荐其参加临床试验。随着研究药物名单的快速更新,目前正在研发的药物示例总结见下表。

BTK 降解剂通过破坏 BTK 的支架功能而非其酶活性,以区别于共价和非共价 BTKi 的机制靶向该蛋白。针对 NX-5948 和 BGB-16673 等药物的Ⅰ期研究早期报告显示,在多线经治 CLL 患者中,这些药物展现出了有希望的疗效和可接受的安全性。双特异性抗体等 T 细胞结合剂也正在 CLL 中进行研究,CD3xCD20 双特异性抗体 epcoritamab 在复发环境中早期数据展现了有利的疗效。此外,还在探索包括自体 CAR-T 或 NK 细胞产品、异体 CAR 治疗以及体内工程改造技术等过继性细胞免疫疗法。随着这些实验性药物中的部分在未来几年成为标准治疗的一部分,对标准治疗方案的排序将继续演变和适应。
参考文献
Blood . 2025 Jul 29:blood.2024025482. doi: 10.1182/blood.2024025482.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)