首页 > 医疗资讯/ 正文
动脉粥样硬化性心血管疾病(ASCVD)是全球发病率和死亡率最高的慢性疾病,其治疗和预防的口服药物,包括阿司匹林、他汀等等,常年居全球药物消耗量前列,但仍存在疗效和副作用的个体差异。口服药物与肠道菌群和次生代谢的交互作用(Drug-Microbiome Interaction),逐渐被证实是影响药效和副作用的关键机制。袁祖贻教授团队近期聚焦口服药物与肠道菌群互作介导药效机制研究,取得系列发现:揭示他汀导致肠道菌群和代谢紊乱,增加糖耐量异常风险(Cell Metabolism 2024);阐释阿司匹林影响肠道菌群的分布,从而介导其对肠道稳态的破坏(Cell Host Microbe 2024)等。阿司匹林是ASCVD预防的基石药物。研究团队前期发现,阿司匹林改变肠道菌群组成和次级胆汁酸谱,导致肠道损伤。有趣的是,阿司匹林同时被发现促进乳酸杆菌等益生菌生长。然而,阿司匹林对动脉粥样硬化模型中肠道菌群及其功能性代谢产物的影响尚未充分阐释。
多种肠道微生物代谢物已被证实在动脉粥样硬化的进展中发挥作用,这些代谢物包括短链脂肪酸(SCFAs)、次级胆汁酸、三甲胺N-氧化物(TMAO)等。越来越多的证据表明,在众多动物模型研究中,肠道菌群通过SCFAs影响动脉粥样硬化的发生发展。已有研究表明,SCFAs在动脉粥样硬化进展过程中,在调控巨噬细胞活化、浸润和极化方面发挥着关键作用。然而,SCFAs调控斑块内巨噬细胞的具体信号通路仍不清楚。
2025年7月29日,西安交通大学袁祖贻、李铤、刘军辉共同通讯在Advanced Science 在线发表题为“Ligilactobacillus Murinus and Lactobacillus Johnsonii Suppress Macrophage Pyroptosis in Atherosclerosis through Butyrate-GPR109A-GSDMD Axis”的研究论文。该研究从小鼠模型和人类队列中鉴定出两种阿司匹林影响的肠道益生菌—鼠乳杆菌(L. murinus)和约氏乳杆菌(L. johnsonii),通过促进产SCFAs的益生菌生长,形成了有机共生网络,促进代谢物丁酸生成,后者激活GPR109A受体,抑制GSDMD激活和巨噬细胞焦亡,从而改善高脂饮食造成的动脉粥样硬化进展。这些发现为干预益生菌防治ASCVD提供新思路。

为了探究肠道微生物组对动脉粥样硬化的影响,研究者对正常饮食(CD)和高脂饮食(HFD)喂养的小鼠粪便样本进行了16S rRNA测序分析,α多样性分析表明HFD组的肠道微生物组多样性显著降低,而阿司匹林治疗部分恢复了这种多样性。同时,β多样性分析也表明高脂饮食和阿司匹林治疗显著重塑了肠道微生物组的组成。微生物组分析显示,高脂饮食导致厚壁菌门、乳杆菌目、乳杆菌科和乳酸杆菌属的减少,而阿司匹林治疗逆转了这一现象。另一方面,已报道的人类队列中也验证了这一假设。口服阿司匹林30天的健康志愿者肠道中乳杆菌的丰度有所增加。另外,在一项纳入了275名健康对照和372名缺血性心脏病患者的队列中,同样发现缺血性心脏病患者的肠道乳酸杆菌组成较健康对照组减少,而服用阿司匹林的患者乳酸杆菌丰度较高。综合来看,这些数据表明鼠乳杆菌和约氏乳杆菌丰度的增加与阿司匹林使用呈相关(图1)。
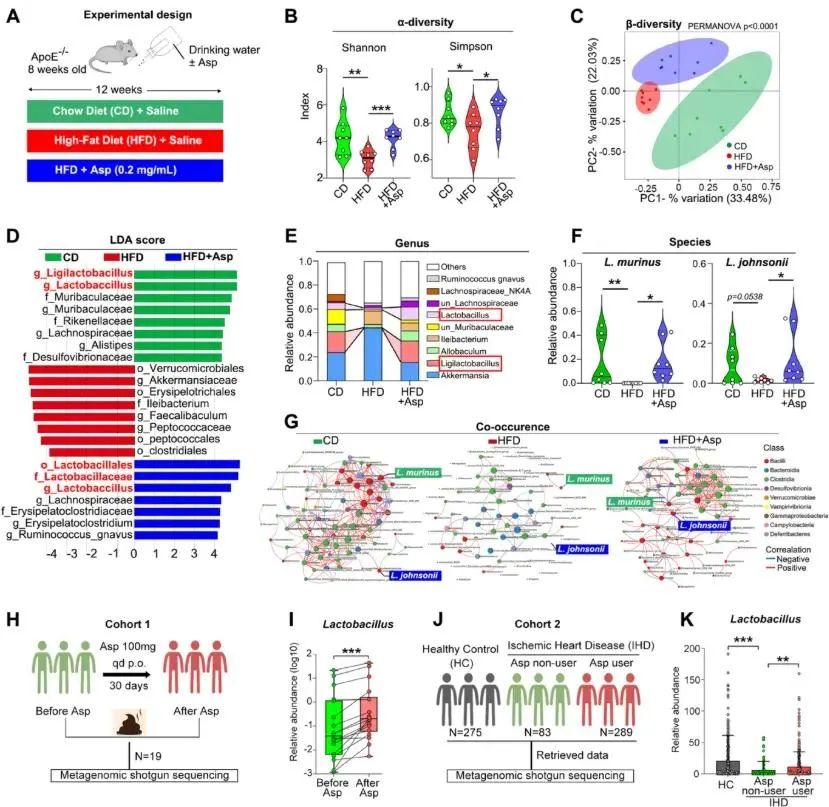
图1. 阿司匹林恢复HFD造成的菌群紊乱,并促进提高乳酸杆菌丰度
通过动物实验验证,鼠乳杆菌和约氏乳杆菌能够抑制高脂饮食诱导的动脉粥样硬化,减轻巨噬细胞浸润及焦亡程度。将这两种菌株的活菌和热灭活菌株分别定植于HFD干预ApoE-/-小鼠模型中,通过16S rRNA测序数据证实了这两种菌株的成功定植。同时,定植鼠乳杆菌和约氏乳杆菌后,异杆菌属(Allobaculum)的相对丰度也随之增加。有趣的是,鼠乳杆菌和约氏乳杆菌活菌灌胃能够显著降低HFD小鼠的动脉粥样硬化斑块负荷、坏死核心大小以及纤维化程度,而热灭活菌株灌胃则未表现出治疗效果(图2)。
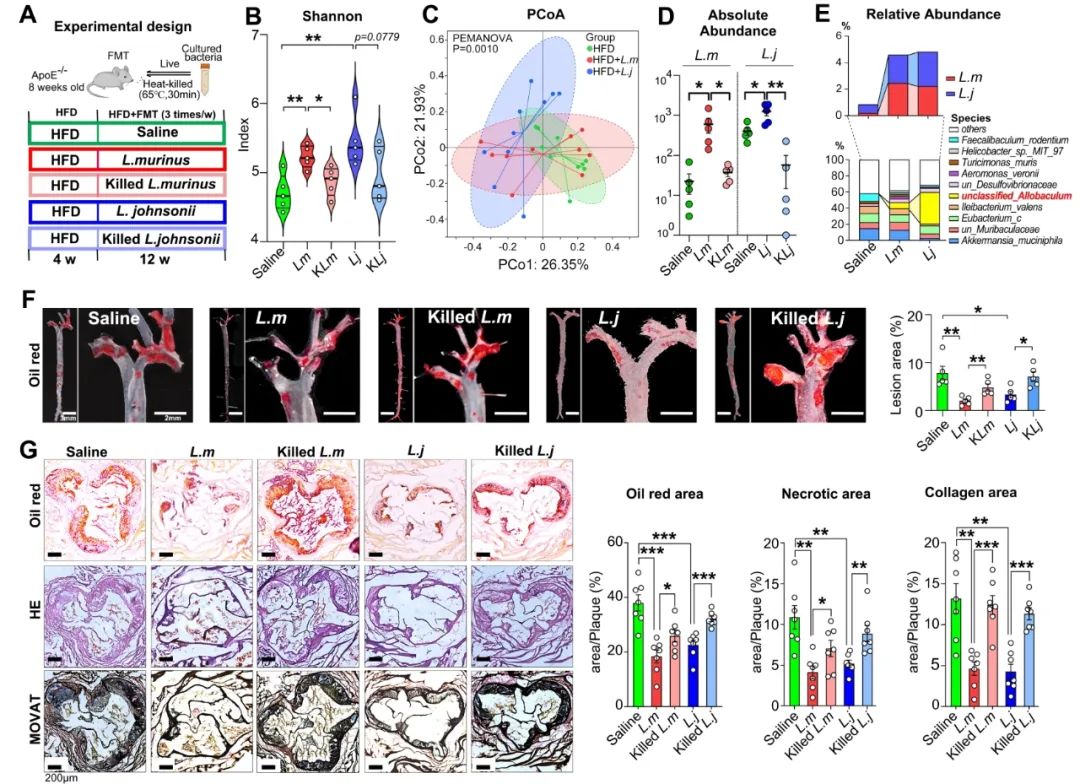
图2. 乳酸菌抑制HFD造成的动脉粥样硬化进展
随后,研究者着手探究鼠乳杆菌和约氏乳杆菌对动脉粥样硬化保护作用的代谢机制。采用液相色谱-串联质谱法(LC-MS/MS)对粪便样本进行了非靶向代谢组学检测,结果表明,鼠乳杆菌和约氏乳杆菌灌胃导致小鼠肠道微生物代谢物发生显著变化,将上调的代谢物与人类代谢物数据库(HMDB)进行匹配后,发现有机酸(包括短链脂肪酸)显著富集。此外,基于非靶向代谢组学和靶向代谢组学检测,研究者发现鼠乳杆菌和约氏乳杆菌灌胃后,粪便中的丁酸以及其他短链脂肪酸均上调。有趣的是,在移植了鼠乳杆菌和约氏乳杆菌后,粪便中乳酸的浓度有所增加。同时,当使用阿司匹林、约氏乳杆菌或鼠乳杆菌时,丁酸浓度似乎与产丁酸菌Allobaculum呈正相关(图3)。
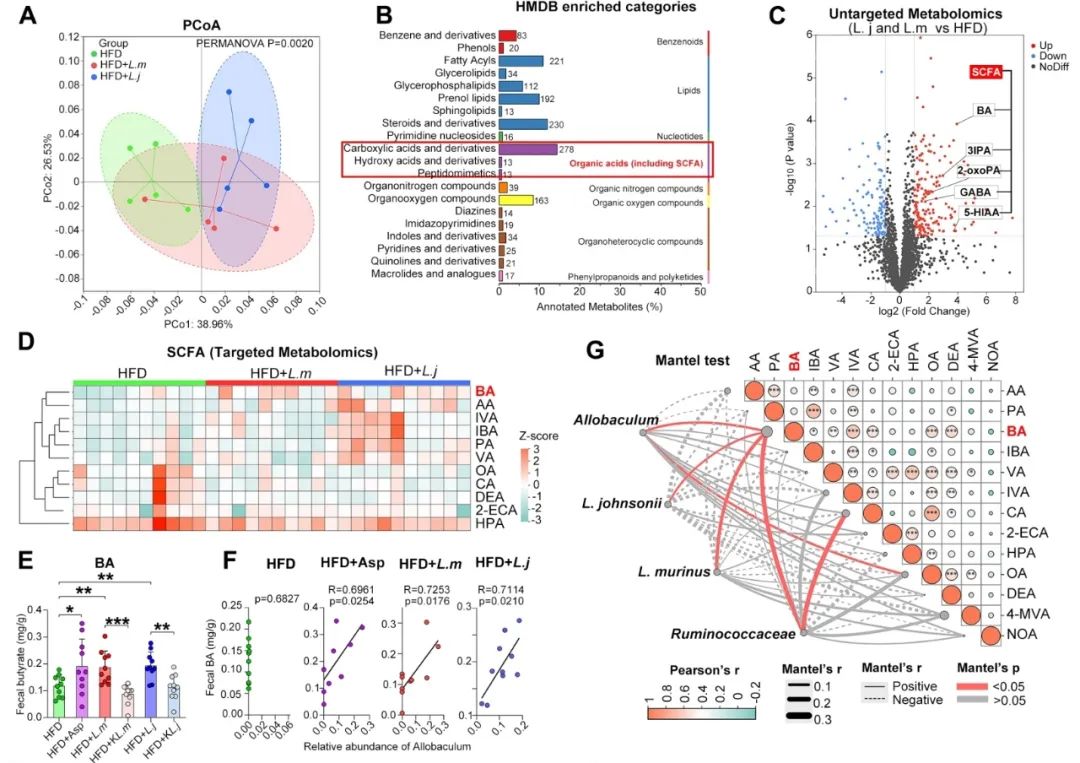
图3. 乳酸菌促进Allobaculum共生网络,并提高丁酸浓度
短链脂肪酸主要通过激活G蛋白偶联受体41、43和109A (GPR41、GPR43和GPR109A),或抑制组蛋白去乙酰化酶(HDAC)活性发挥作用。体外免疫荧光实验表明,丁酸盐和GPR109A激动剂能够抑制巨噬细胞NLRP3和IL-1β的表达,而HDAC抑制剂和GPR41/43激动剂没有引起类似的变化。Western blotting实验发现,巨噬细胞敲除GPR109A能够恢复丁酸盐对GSDMD、NLRP3和IL-1β的抑制。以上结果表明,巨噬细胞中的GPR109A介导了丁酸盐的抗焦亡作用。为了进一步分析这一机制,研究者分析主动脉动脉粥样硬化斑块的单细胞测序数据(GSE159677),在该数据集中发现了8个主要的细胞簇,并且GPR109A在髓细胞中的表达相对高于其他两种受体。有趣的是,与对照组相比,动脉粥样硬化巨噬细胞中GPR109A的表达降低,并且GPR109A的表达与NLRP3、GSDMD等焦亡标志物的表达呈负相关。这一现象提示,GPR109A可能在调节巨噬细胞活化和极化中发挥抗炎作用,从而抑制动脉粥样硬化的进展。这些数据表明,GPR109A可能在介导丁酸对斑块内巨噬细胞焦亡的抑制作用中发挥关键作用(图4)。
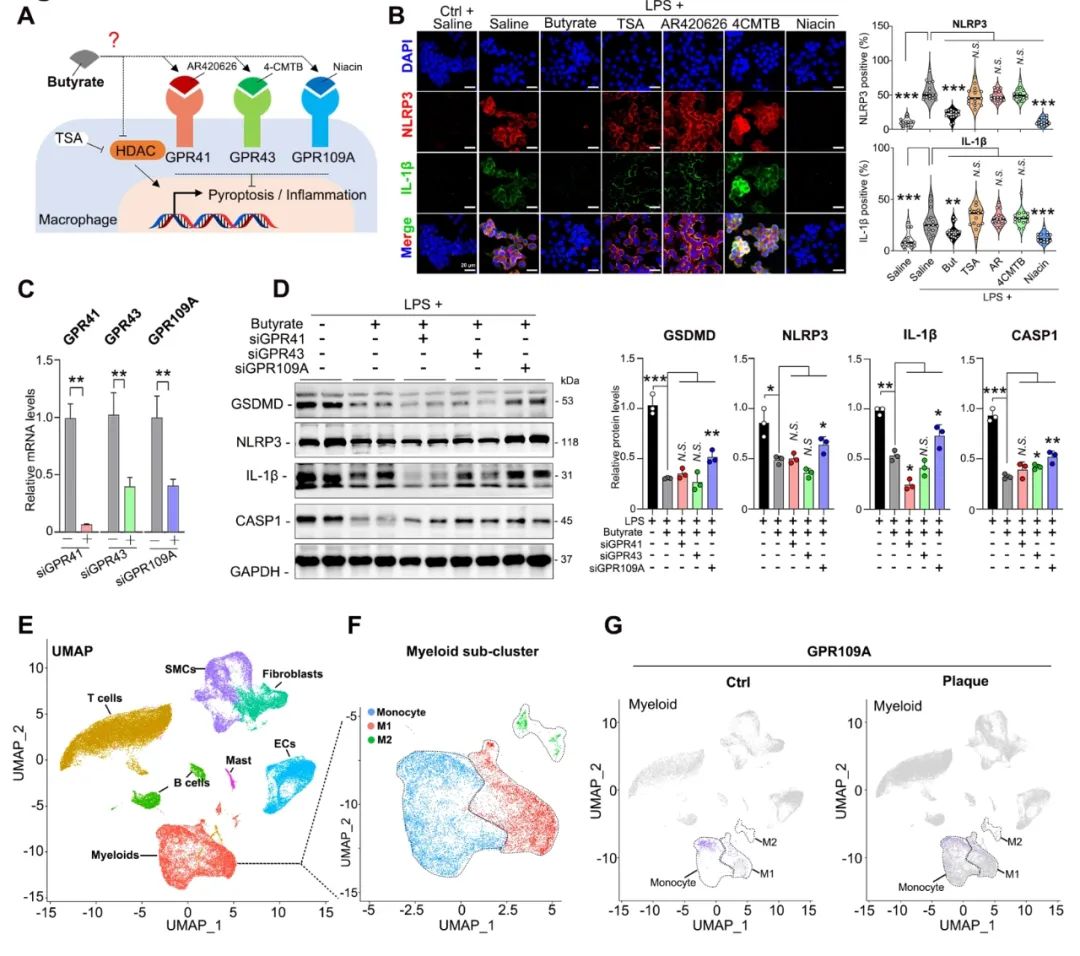
图4. 丁酸通过激活GPR109A抑制巨噬细胞焦亡
综上所述,鼠乳杆菌和约氏乳杆菌在肠道内的富集显著抑制了动脉粥样硬化的进展,它们通过供应乳酸和促进产丁酸菌的生长来促进丁酸盐的产生。一方面,丁酸盐能够维持肠道屏障的完整性,抑制脂多糖进入循环发挥抗炎作用。另一方面,丁酸盐通过激活巨噬细胞受体GPR109A,抑制巨噬细胞GSDMD/NLRP3/IL-1β途径激活,从而发挥抗动脉粥样硬化的作用(图5)。
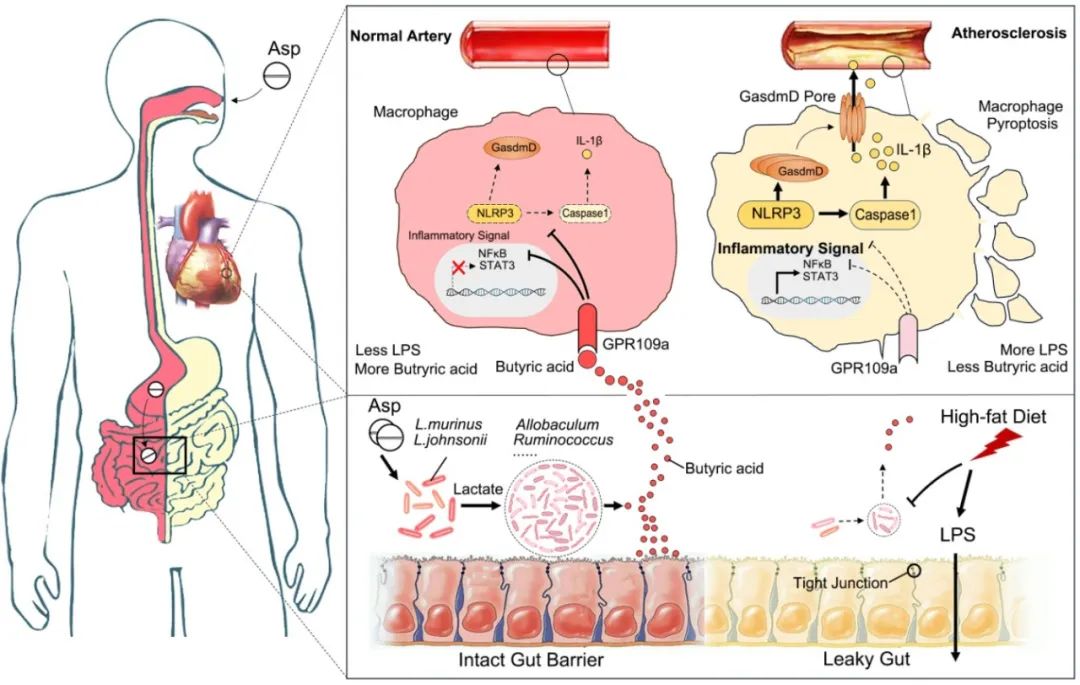
图5. 阿司匹林通过乳酸菌-丁酸-GPR109A轴抑制巨噬细胞焦亡和动脉粥样硬化进展
本研究由西安交通大学第一附属医院袁祖贻团队完成,博士生花蕊、丁宁为本文共同第一作者,西安交通大学第一附属医院袁祖贻、李铤、刘军辉教授为本文共同通讯作者。本研究受到国家重点研发项目、国家自然科学基金面上项目、陕西省自然科学基金、西安交通大学基金的共同资助。
参考文献:
Hua R, Ding N, et al. Advanced Science 2025. DOI: 10.1002/advs.202501707
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)