首页 > 医疗资讯/ 正文
CAR-T
CAR-T细胞疗法在治疗多线耐药的多发性骨髓瘤(MM)患者中显示出相当大的潜力,并且已经获批治疗复发和/或难治性多发性骨髓瘤(RRMM)。B细胞成熟抗原(BCMA)仍是MM中最广泛研究的CAR-T细胞靶点,此外还有几种替代抗原也正在积极研究中。尽管CAR-T细胞疗法在治疗RR MM方面取得了显著的成功,但在提高缓解率、延长缓解的持久性以及减少CAR-T细胞疗法后的复发方面仍面临挑战;此外高危疾病特征也与CAR-T细胞疗法治疗RRMM后的不良预后密切相关。
《Critical Reviews in Oncology / Hematology》近日发表综述,上海交通大学医学院附属瑞金医院糜坚青教授和欧阳皖雁分析了 CAR-T 细胞治疗失败的机制,探索了增强 CAR-T 细胞在 RRMM 中疗效和安全性的策略,还考虑了 CAR-T 细胞治疗在高危患者早期治疗线中的潜在应用,并讨论了改善该人群缓解和预后的方法。现整理主要内容供参考。

CAR-T治疗MM的挑战
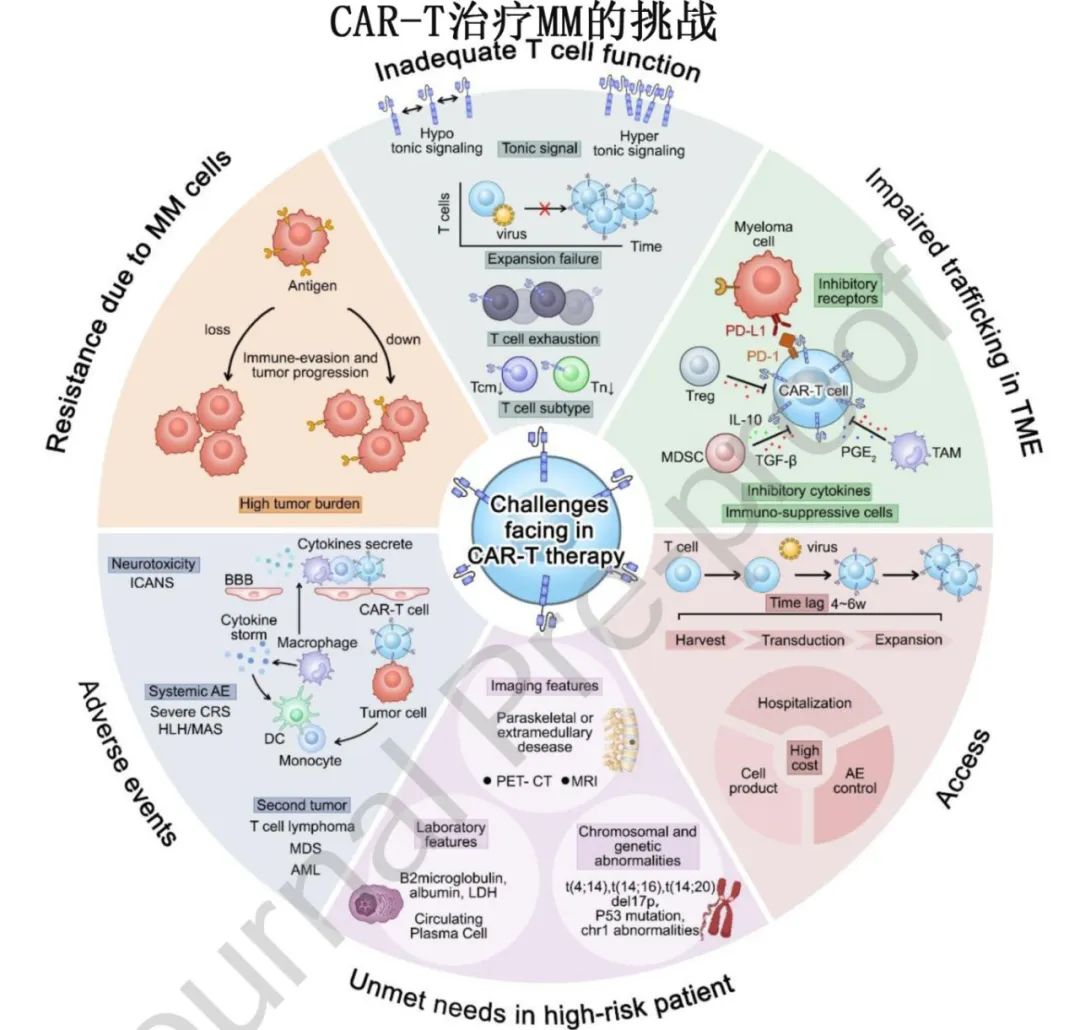
1.耐药机制:
肿瘤抗原调节:BCMA丢失或下调是CAR-T细胞耐药的罕见机制,但在B细胞急性淋巴细胞白血病中,约50%的复发与CD19丢失相关。
肿瘤抗原表达调节:通过多种机制(如基因突变、RNA剪接、细胞谱系转换等)调节肿瘤抗原表达。
基线肿瘤负荷:高肿瘤负荷的患者在治疗开始时更难实现或维持深度缓解。
高危细胞遗传学和髓外疾病:这些因素与疗效不佳和总生存率降低相关。
2.CAR-T细胞功能不足:
T细胞质量:提取的T细胞质量是关键因素之一。含有较高比例的幼稚和记忆T细胞的CAR-T细胞产品具有更好的临床结局和增殖潜力。
T细胞耗竭:慢性肿瘤抗原刺激导致T细胞耗竭,表现为有限的体内持久性。
CAR受体的持续信号(tonic signaling):这种异常信号类似于长期抗原暴露,进一步削弱CAR-T细胞的效力。
3肿瘤微环境中的运输受损:
免疫抑制微环境:肿瘤微环境中的细胞和非细胞成分(基质细胞、异常血管、免疫检查点分子[如PD-L1]及抑制性细胞[如M2巨噬细胞])促进免疫抑制,阻碍CAR-T细胞的疗效。
T细胞浸润障碍:肿瘤相关基质、异常的细胞粘附分子、异常肿瘤血管和趋化因子与其受体的不匹配,进一步阻碍T细胞的浸润。
4.CAR-T细胞疗法的可及性:
高成本:CAR-T细胞生产成本高,限制了患者的可及性。
生产失败:生产失败仍然是临床实践中的一个挑战,受多种因素影响,包括年龄、疾病状态和既往治疗。
5.不良反应:
细胞因子释放综合征(CRS):与CAR-T细胞激活直接相关,与血清铁蛋白、C反应蛋白和促炎细胞因子水平升高相关。
神经毒性:发病机制尚不清楚,可能与细胞因子介导的内皮细胞激活有关,导致凝血病、毛细血管渗漏和血脑屏障破坏。
T细胞恶性肿瘤:FDA建议对接受BCMA或CD19 CAR-T细胞产品的患者发出T细胞恶性肿瘤的警告。
6.高危患者的未满足需求:
高危特征:包括细胞遗传学高危(如del(17p)、t(14;16)或t(4;14))或疾病特异性风险(如髓外疾病或R-ISS III期疾病)。
治疗挑战:改善缓解持续时间是主要挑战,高危细胞遗传学和ISS III期疾病在基线时对CR率影响不大,但对DOR和PFS有负面影响。
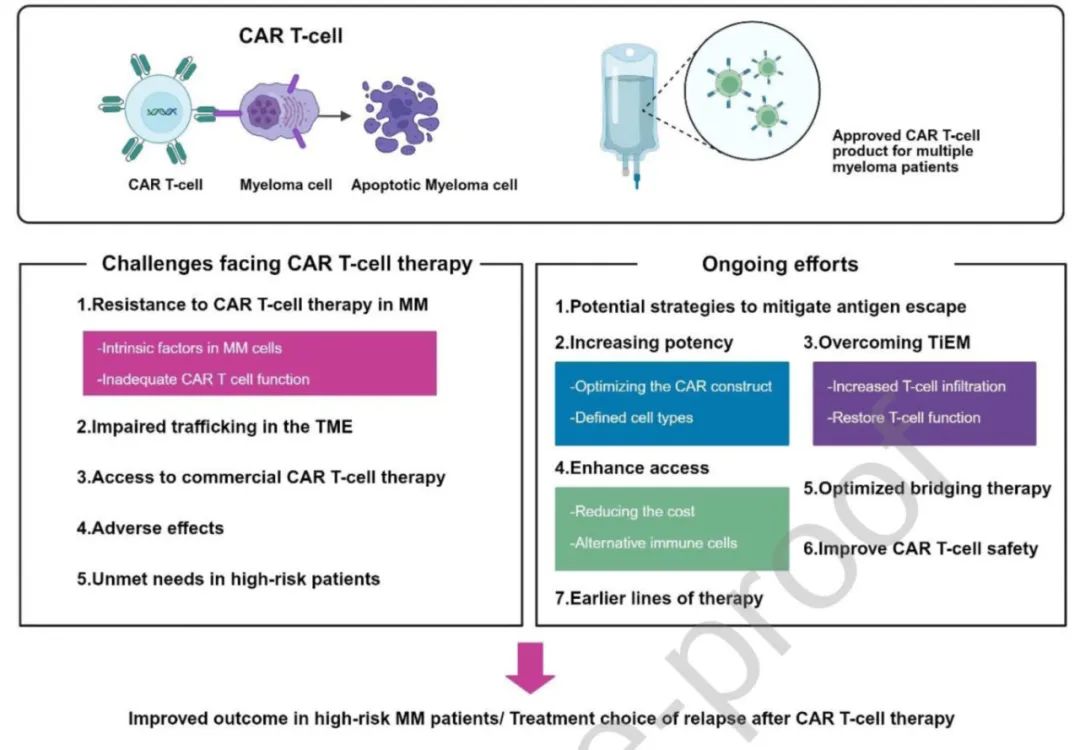
解决策略与未来方向
1.抗原逃逸的潜在策略:
动态抗原监测:通过流式细胞术量化抗原密度,动态监测抗原表达,预测抗原逃逸和患者反应。
多抗原靶向:开发针对多个抗原的策略,减少抗原阴性肿瘤细胞,降低复发风险。
2.增强CAR-T细胞效力:
优化CAR设计:包括抗原结合域、铰链和跨膜域、以及细胞内信号域的优化。
检查点敲低或敲除:通过shRNA或CRISPR技术降低PD-1表达,减少T细胞耗竭。
表观遗传调控:通过删除DNA甲基转移酶3a(DNMT3A)改善CAR-T细胞的抗肿瘤效力。
3.克服免疫抑制肿瘤微环境:
增加T细胞浸润:通过工程化CAR-T细胞以增强其在肿瘤部位的浸润能力。
逆转免疫抑制:使用检查点抑制剂、阻断抑制性细胞因子和信号、增强促炎细胞因子分泌等方法。
4.降低成本和提高可及性:
创新制造方法:如封闭系统制造,减少CAR-T细胞疗法的成本。
自动化供应链:减少污染和人为错误的风险,提高运营效率,降低劳动力成本。
5.替代免疫细胞:通用CAR-T/NK细胞疗法开发来自健康供者的CAR-T细胞或CAR NK细胞,可解决自体CAR-T细胞产品不足或质量不佳的问题。
6.优化桥接治疗:桥接治疗在CAR-T细胞输注前使用桥接治疗控制快速疾病进展。手段包括化疗、放疗、免疫治疗和靶向治疗等,但尚未标准化,需要个体化考虑。
7.提高CAR-T细胞安全性:
自杀基因和消除信号:在CAR构建中加入自杀基因和消除信号,以便在出现毒性时快速移除CAR T细胞。
多CAR设计的组合抗原识别技术:通过多种CAR设计减少靶向肿瘤外的副作用。
降低抗原识别域的亲和力:通过降低CAR-T细胞外抗原识别域的亲和力,减少在肿瘤细胞高表达而在正常组织低表达时的非肿瘤活性。
个性化CAR-T细胞剂量:根据肿瘤负荷和分次给药调整剂量,以进一步降低不良反应的频率和严重程度。
监测和治疗:在CAR T细胞输注后,密切监测患者的临床状况、血液学参数、器官功能、血清铁蛋白和细胞因子水平,以便及时发现和处理新出现的并发症。
8. 早期应用与高危患者管理:在治疗早期(如一线)使用CAR-T疗法可能改善高危患者预后。联合新药、放疗或双特异性抗体可巩固疗效。
9. CAR-T治疗后复发的挽救方案:可换用非BCMA靶点(如GPRC5D或FcRH5靶向疗法)、抗体偶联药物(ADC)、双特异性抗体或传统化疗方案(如DCEP),既往暴露过的药物再治疗也可能有效。
总结
尽管BCMA CAR-T细胞疗法在MM治疗中取得了显著的成果,但仍需进一步改进以充分发挥其潜力。创新的CAR设计、对疾病耐药机制的深入理解以及对肿瘤异质性和抑制性微环境的优化策略将有助于提高CAR-T细胞疗法的疗效和安全性。此外,开发通用CAR-T/NK细胞疗法、降低成本和提高可及性、以及提高CAR-T细胞疗法的安全性是未来研究的重要方向。对于高危患者,早期应用CAR-T细胞疗法可能会改善反应和结果。
参考文献
Wanyan Ouyang and Jian-Qing Mi, Challenges facing CAR T-cell immunotherapy in multiple myeloma, Critical Reviews in Oncology / Hematology, (2025) doi:https://doi.org/10.1016/j.critrevonc.2025.104803
猜你喜欢
- 甘肃兰州:高学历护士成医疗机构的“香饽饽”
- 论著|红细胞分布宽度、系统免疫炎症指数与重性抑郁障碍的相关性研究
- 医防相融托起健康夕阳红
- 【论著】炎性反应相关指标对急性缺血性卒中患者血管内治疗临床预后的影响
- 晚卵泡期孕酮水平对拮抗剂方案妊娠结局的影响!
- 第99届美国神经病理学家协会年会|摘要汇报:阿尔茨海默病和原发性年龄相关性tau病海马亚区的空间蛋白质组学比较
- 减肥期间要控盐,是因为盐的热量很高?
- J Orthop Traumatol:中国学者发文游离带血管骨移植与Masquelet技术治疗开放性前臂骨折节段性骨缺损的疗效比较
- 出汗不等于减脂,盘点哪些必知的5大运动减肥常识
- 全国儿童青少年精神障碍流行率为17.5%!抑郁症该如何治疗?专家解读→
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)