首页 > 医疗资讯/ 正文
肝内胆管癌(ICC)是仅次于肝细胞癌的第二常见肝癌,其特点是恶性程度高、预后差。吉西他滨联合顺铂是转移性或不可切除ICC的标准一线治疗方案。免疫治疗与靶向治疗的联合应用代表了ICC治疗的一个有前景的新方向。ICC中常见的基因突变包括TP53、FGFR2、IDH1/2和KRAS。MET变异(如融合和扩增)在ICC中较为罕见。然而,关于特定MET抑制剂疗效的研究有限。本文报告两例病例:第一例为携带ZKSCAN1-MET融合的难治性ICC,采用免疫治疗联合靶向治疗;第二例为伴有MET扩增的转移性ICC。两名患者均对MET特异性酪氨酸激酶抑制剂克唑替尼表现出显著的临床反应。
背 景
肝内胆管癌(ICC)约占所有原发性肝癌的 10%,是第二常见的原发性肝脏恶性肿瘤。该病起病隐匿、侵袭性强,常导致患者确诊时已处于晚期,从而丧失手术治愈的机会。国际指南推荐,不可切除的晚期ICC的标准一线治疗方案为吉西他滨联合顺铂。标准二线治疗方案包括奥沙利铂、亚叶酸钙和氟尿嘧啶(mFOLFOX)。近年来,免疫治疗和靶向治疗取得了快速进展,已成为ICC探索性治疗的关键领域。尽管化疗和免疫治疗改善了晚期ICC患者的生存结局,但大多数患者的中位总生存期仍约为 12 个月。
随着基因组学和生物信息学的发展,全面的基因组分析研究为胆管癌(CCA)的靶向治疗提供了更深入的见解。在ICC中,已对血管内皮生长因子受体(VEGFR)、异柠檬酸脱氢酶、成纤维细胞生长因子受体(FGFR)和表皮生长因子受体等治疗靶点进行了研究,其中一些显示出潜在的临床应用价值。部分药物在ICC治疗中取得进展并已获批上市。间质-上皮转化因子(c-MET)是一种受体酪氨酸激酶,在ICC中过表达(12-58%),且与不良预后相关。MET靶向治疗在其他恶性肿瘤中已显示出临床疗效,例如在非小细胞肺癌(NSCLC)和食管胃癌中,MET扩增或融合是可作用的驱动因素。例如,c-MET抑制剂克唑替尼在具有MET改变的NSCLC患者中显示出持久的应答,突显了其在MET驱动型癌症中的治疗潜力。这支持了在ICC中探索MET抑制的合理性,特别是在具有MET基因异常的患者中。
Goyal等人评估了卡博替尼在化疗难治性CCA中的疗效,发现在无进展生存期(PFS)或总生存期(OS)方面没有生存获益。然而,进一步分析显示,一名MET高表达(免疫组化分析3+)的患者从治疗中获得了长期获益。在I期临床试验中,另一种c-MET抑制剂tivantinib(ARQ-197)联合吉西他滨用于治疗晚期或转移性实体瘤患者。该试验纳入了 8 例CCA患者,其中仅 1 例显示部分缓解。这些研究中MET抑制剂的疗效有限,可能源于缺乏基于精确分子生物标志物(如MET融合或扩增)的患者选择,而这对于成功的靶向治疗至关重要。
本文报告两例病例:第一例为携带ZKSCAN1-MET融合的难治性ICC患者,采用免疫治疗联合靶向治疗;第二例为伴有MET基因扩增的转移性ICC患者。两名患者均对克唑替尼表现出显著的临床应答。
病例1
患者女,57 岁,无既往病史,于 2021 年 8 月就诊于解放军总医院第五医学中心放射治疗科,被诊断为III期肝内胆管癌(ICC),磁共振成像(MRI)显示出ICC的典型特征(图1)。2021 年 8 月 12 日,患者开始接受替雷利珠单抗(200 mg静脉注射,每 3 周一次)联合甲磺酸仑伐替尼(8 mg口服,每日一次)的一线治疗。2021 年 8 月 24 日,患者入院,多学科会诊建议联合局部治疗,但患者拒绝并继续接受全身治疗。2022 年 3 月,患者因疾病进展复诊。腹部MRI显示疾病进展,最大肝内病灶从 5.3×5.1 cm增大至 7.9×6.5 cm(图1)。
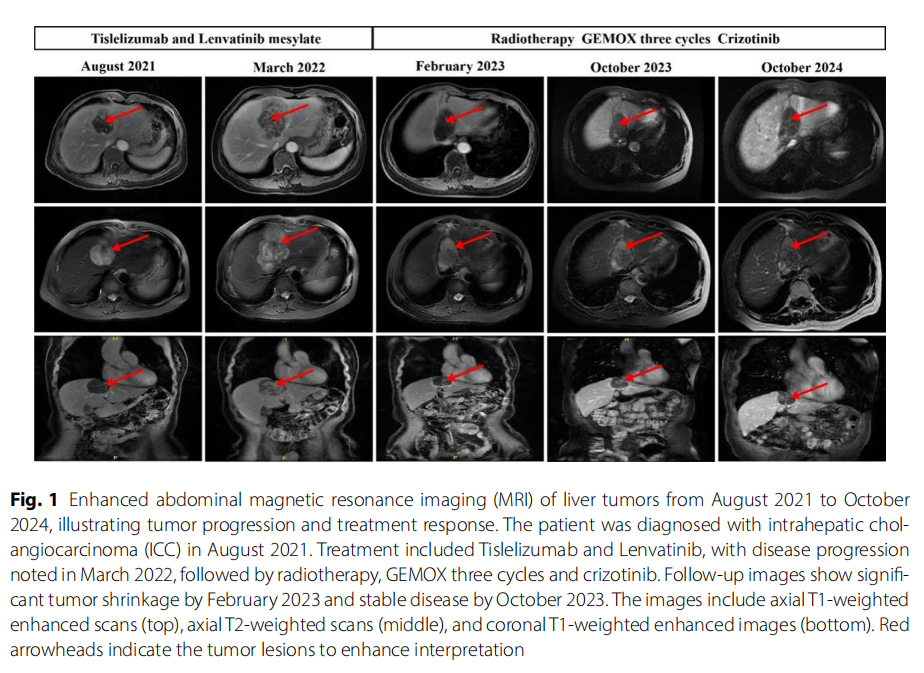
▲图1 病例1治疗时间线及MRI结果
从福尔马林固定石蜡包埋(FFPE)肿瘤组织和匹配的血液样本中提取高质量DNA,下一代测序(NGS)平均测序深度为 1000×。肿瘤基因检测显示ZKSCAN1基因5号外显子与MET基因15号外显子发生融合,变异丰度为 4.4%(图2)。未观察到MET拷贝数扩增。预计ZKSCAN1-MET融合产生保留MET激酶结构域的嵌合蛋白,可能导致MET信号通路激活。此外,NGS结果显示患者肿瘤突变负荷低(TMB-L,0 muts/Mb,0%),且微卫星稳定(MSS)。
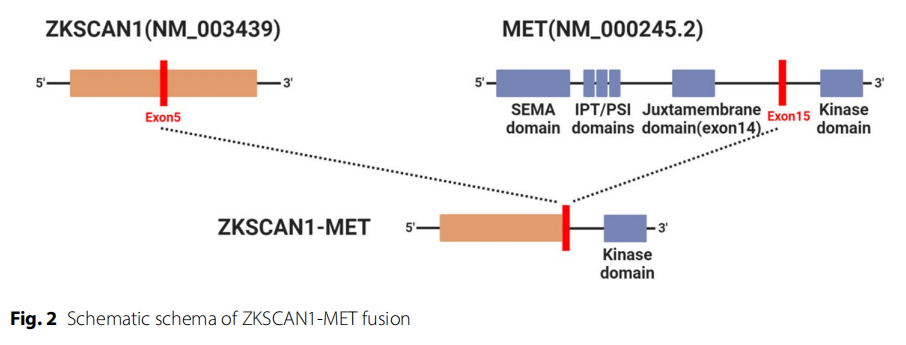
▲图2 ZKSCAN1-MET融合示意图
多学科团队(MDT)讨论后,患者于 2022 年 3 月 29 日接受肝内病灶放疗,剂量为 50 Gy,分 10 次照射(DT:50 Gy/10 fx)。根据基因检测结果,建议患者考虑化疗联合靶向治疗或单用靶向治疗(克唑替尼)。2022 年 4 月 11 日至 2022 年 6 月 9 日,患者接受了 3 个周期的GEMOX方案化疗(吉西他滨 1400 mg/m²d1,奥沙利铂 130 mg/m²d1)。2022 年 6 月 9 日,患者开始接受克唑替尼胶囊靶向治疗(250 mg口服,每日两次)。因出现胃肠道不良反应,随后将克唑替尼剂量调整为 250 mg每日一次。患者的血清肿瘤标志物呈下降趋势,尤其是CA19-9(图3)。此外,2023 年2 月复查腹部MRI显示,与 2022 年 3 月相比,肿瘤体积显著缩小,在T1加权增强图像上尤为明显,提示克唑替尼具有显著疗效,尽管不能排除先前化疗的作用。2023 年 10 月后续腹部MRI复查显示疾病稳定(图1)。
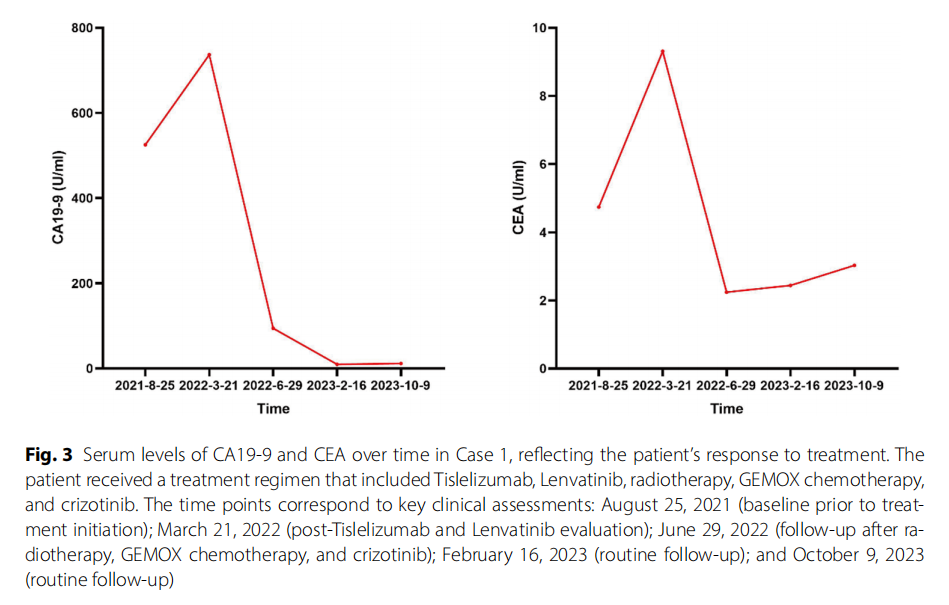
▲图3 病例1血清CA19-9和CEA水平随时间变化,反映患者对治疗的反应
病例2
患者男,43 岁,有乙型肝炎表面抗原阳性病史,于 2021 年 3 月 27 日就诊,被诊断为IV期肝内胆管癌(ICC),伴有双肺及多发淋巴结转移,主诉腹痛。磁共振成像(MRI)显示出ICC的典型特征(图4)。
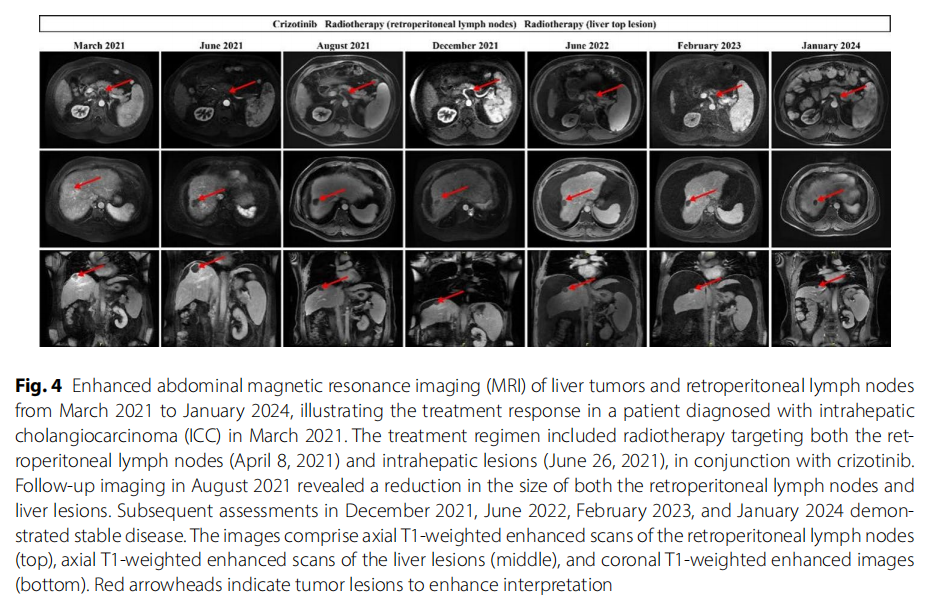
▲图4 病例2治疗时间线及MRI结果
进行了肝脏再次活检以获取组织用于分子检测。采用目标区域捕获联合高通量测序准确识别突变、扩增和融合。肿瘤基因检测结果显示,患者存在TP53突变、PDGFRA18号外显子突变、CDK6扩增、MET扩增(拷贝数为 4),且为微卫星稳定(MSS)。在潜在治疗靶点中,MET被认为是一个有吸引力的选择。现有文献支持使用酪氨酸激酶抑制剂治疗伴有MET扩增的肿瘤。在讨论可用药物后,患者同意接受克唑替尼治疗。
2021 年 3 月 29 日,经多学科团队(MDT)讨论后,患者开始口服克唑替尼胶囊靶向治疗(250 mg,每日两次)。2021 年 4 月 8 日,患者接受肝动脉栓塞术及腹膜后淋巴结局部放疗(DT:45 Gy/9 fx)。2021 年 6 月 26 日至 7 月 2 日,对肝顶部病灶进行放疗(DT:45 Gy/9 fx)。治疗过程顺利。2021 年 8 月MRI显示,开始治疗后肿瘤体积显著缩小。2021 年 12 月、2022 年 6 月、2023 年 2 月及 2024 年 1 月复查腹部MRI均提示疾病稳定,未见明确肿瘤复发或转移征象(图4)。血清肿瘤标志物(CA19-9、CEA)呈下降趋势,并在治疗期间保持稳定(图5)。影像学表现及肿瘤标志物的这些变化表明,克唑替尼在控制患者病情方面具有显著疗效。患者继续口服克唑替尼治疗。因肝硬化并发症,患者多次出现胃肠道出血,经保守治疗无效后,于 2023 年 7 月 5 日接受经颈静脉肝内门体分流术(TIPS)。手术顺利,克唑替尼暂时停用。病情稳定后,患者于 2023 年 9 月恢复口服克唑替尼胶囊靶向治疗(250 mg,每日两次)。2024 年 1 月复查腹部MRI提示疾病稳定(图4)。由资深影像科医师进行影像评估,肿瘤标志物的稳定趋势进一步支持克唑替尼对患者病情的控制效果。
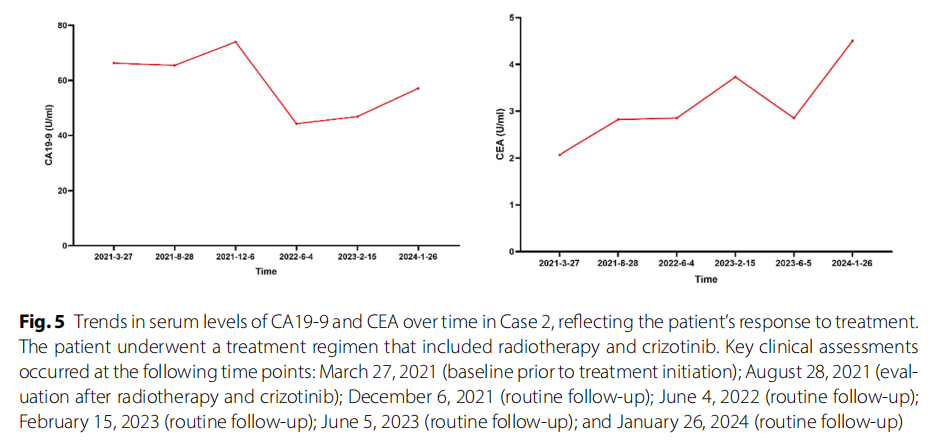
▲图5 病例2中血清CA19-9和CEA水平随时间变化的趋势,反映了患者对治疗的反应
讨 论
本文描述了伴有ZKSCAN1-MET融合和MET基因扩增的ICC患者对MET-TKI治疗的反应。迄今为止,已有数篇病例报告描述了伴有MET融合(包括RBPMS-MET、EHBP1-MET和CAPZA2-MET)的ICC患者对MET抑制剂克唑替尼和卡马替尼表现出敏感性。此外,其他病例报告也描述了伴有MET基因扩增的ICC患者对MET抑制剂卡马替尼和赛沃替尼有反应。本病例报告中描述了 1 例伴有ZKSCAN1-MET融合的ICC患者和另 1 例伴有MET扩增的患者,两者均对克唑替尼表现出显著的治疗反应。这些发现与先前报道的伴有MET融合和扩增的ICC病例共同支持克唑替尼作为伴有MET融合的ICC的潜在有效治疗选择。
基于吉西他滨的化疗是晚期ICC的主要治疗选择,但生存获益有限,导致该人群预后不良。少数具有特定基因突变的患者可能有资格接受靶向治疗。MET变异在ICC中罕见,仅 2% 的病例显示MET扩增。Xu等人的回顾性研究发现,仅 1.1% 的CCA患者存在MET重排。MET融合通常由MET与其他基因之间的重排产生,形成保留完整MET激酶结构域的嵌合蛋白。这种结构导致MET信号通路的持续激活,从而促进肿瘤的发生和进展。例如,在病例1中,发现了ZKSCAN1-MET融合。这种融合保留了MET激酶结构域,激活下游信号通路如MAPK、PI3K和PLCγ1,从而驱动肿瘤进展。与之相对的是,MET扩增的特征是MET基因拷贝数增加,通常导致MET蛋白过表达和信号活性增强。在病例2中,肿瘤分析显示MET扩增(拷贝数 4),为MET抑制剂的使用提供了治疗依据。这进一步支持克唑替尼可能作为伴有MET融合或扩增的ICC患者的有效治疗选择。
目前,MET抑制剂在ICC治疗中的疗效仍存在争议。几项评估MET抑制剂用于晚期CCA的临床试验结果并不理想。这可能是因为入组患者未根据其分子状态进行选择。然而,Lefler等人报道了 1 例转移性ICC伴高水平MET基因扩增的病例,对选择性MET受体抑制剂卡马替尼表现出部分缓解。Zhou等人报道了1例晚期ICC患者对化疗不耐受,NGS检测发现MET扩增(变异丰度 5.2),患者接受MET抑制剂赛沃替尼治疗后达到部分缓解,缓解持续 1 年。此外,Turpin等人的文章描述了 1 例伴有CAPZA2-MET融合的ICC患者在二线治疗后进展,随后接受卡马替尼治疗并达到部分缓解。这些发现表明,MET抑制剂在晚期ICC治疗中具有进一步探索的前景。
克唑替尼是一种小分子酪氨酸激酶抑制剂,主要靶向ALK、ROS1和MET受体。值得注意的是,它已获美国食品药品监督管理局批准用于治疗ALK阳性局部晚期或转移性非小细胞肺癌。在本研究中,克唑替尼在两名患者中均显示出显著疗效,特别是病例2,联合放疗实现了 34 个月的局部控制。相比之下,卡马替尼和赛沃替尼是主要靶向MET受体的选择性MET抑制剂。根据文献报道,卡马替尼在携带MET扩增的转移性ICC患者中实现了部分缓解,生活质量改善近 6 个月。同样,赛沃替尼在 1 例伴有MET扩增的ICC患者中实现了 1 年的部分缓解。尽管这些选择性抑制剂在某些患者中显示出良好的疗效,但其治疗范围可能比克唑替尼更有限。克唑替尼的多靶点特性可能在复杂的分子环境中提供额外的治疗优势。目前,尚无专门针对c-MET阳性CCA的临床试验,由于临床数据有限,难以就这些药物在CCA中的应用得出明确结论。然而,随着这些疗法的日益普及,该领域的证据正在逐渐增加。例如,2021 年AcSé-克唑替尼项目的研究结果表明,克唑替尼抑制c-MET在MET扩增的食管和胃癌中有效。在该研究中,9 例化疗耐药且MET拷贝数 ≥6 的肿瘤患者接受克唑替尼单药治疗,客观缓解率为 33.3%,中位无进展生存期为 3.2 个月,总生存期为 8.1 个月。多项已报道的病例表明,携带CD47-MET、KIF5B-MET、HLA-DRB1-MET、STARD3NL-MET、MET-ATXN7L1和MET-UBE2H等MET融合的肺腺癌患者可能对克唑替尼治疗有反应。研究报道,患者对克唑替尼的反应持续时间为 4-12 个月,中位持续时间为 8 个月。此外,Yu等人描述了 1 例携带EHBP1-MET融合的ICC患者接受克唑替尼治疗后实现了 8 个月的部分缓解。另 1 例伴有RBPMS-MET融合的ICC患者使用克唑替尼治疗显示出显著疗效。此外,1 例转移性CCA患者具有新的基因改变(Ig样III结构域FGFR2改变[W290_P307>C],以及CDKN2A/B改变和钙粘蛋白1[CDH1]改变),在对帕唑帕尼产生耐药后,通过包括克唑替尼在内的个性化联合治疗方案获得了显著的治疗效果。此外,1 例携带PTPRZ1-MET融合的儿童胶质瘤患者在接受克唑替尼治疗 2 个月后肿瘤显著缩小。这些发现表明,克唑替尼是MET融合肿瘤患者的潜在治疗选择。此外,ICC中的MET基因扩增已显示对选择性MET受体抑制剂卡马替尼和赛沃替尼有良好反应。在病例1中,放疗联合克唑替尼实现了约 19 个月的局部控制。在病例2中,放疗联合克唑替尼实现了 34 个月的局部控制。这一结果值得注意,有必要进一步研究探索放疗联合小分子酪氨酸激酶抑制剂在晚期ICC患者中的治疗效果。
本研究报告了两例伴有MET变异的晚期ICC患者对克唑替尼治疗表现出显著反应,进一步探讨了MET抑制剂在ICC治疗中的潜力。尽管MET改变在ICC中相对罕见,但本文研究结果表明,克唑替尼在伴有MET融合或扩增的患者中显示出显著疗效,尤其是在精准分子检测的指导下。然而,本研究存在一些局限性。首先,由于仅纳入两名患者,样本量过小,无法全面评估MET抑制剂在ICC中的整体疗效,因此需要在更大的队列中进一步验证。其次,病例1中检测到的ZKSCAN1-MET融合是否代表仑伐替尼治疗后的获得性耐药机制仍不确定,因为缺乏治疗前的分子检测数据。该ZKSCAN1-MET融合是在患者接受仑伐替尼治疗后疾病进展时发现的,提示其可能是一种获得性耐药机制,且可能与长期VEGFR/FGFR抑制的选择压力有关。这种现象与其他癌症中MET激活作为耐药途径的报道一致。此外,两名患者均接受了放疗与克唑替尼的联合治疗,因此难以将肿瘤反应单独归因于放疗、克唑替尼或两者的联合作用。另外,病例1中GEMOX化疗方案也可能对肿瘤负荷的减少和肿瘤标志物的改善有贡献。因此,观察到的治疗效果不能完全归因于克唑替尼单药。多种治疗的联合效应是本研究的另一个局限性,未来需要进一步研究以明确每种治疗方式的作用。尽管如此,临床经验表明,局部放疗联合全身靶向治疗可能提高局部控制率,减少复发和转移。本研究中观察到的肿瘤标志物稳定性可能反映了这两种治疗的协同效应。未来需要进行大规模前瞻性研究和随机对照试验,以进一步验证MET抑制剂在ICC患者中的疗效,并探索MET融合或扩增的潜在机制。此类研究将有助于阐明这些治疗方法的单独和联合效应,并优化治疗策略。
ICC是一种高度侵袭性和异质性的恶性肿瘤,对化疗反应不佳,使其治疗具有挑战性。因此,细化基因图谱并靶向精准治疗以延长晚期ICC患者的生存期至关重要。这两例病例证明了克唑替尼在治疗伴有MET改变的晚期ICC中的疗效,为这些患者提供了一种替代治疗方案,并强调了分子检测在晚期ICC病例中的重要性。需要进一步研究证实放疗与靶向治疗的联合是否能为晚期ICC患者带来更大的生存获益。
实体瘤1299基因检测、实体瘤272基因检测PLUS、消化系统肿瘤199基因检测、胆管癌115基因检测(NGS方法学)均覆盖MET基因全编码区(CDS)及融合基因内含子部分区域,助力临床精准管理。实体瘤1560基因融合RNA检测(NGS方法学)可检测MET相关融合在内超过1560种已知和未知融合变异,能够满足患者的基因融合变异检测需求,辅助临床精准诊疗。
参考文献:
Wu, JH., Fan, Yz., Sun, J. et al. Response to crizotinib in advanced intrahepatic cholangiocarcinoma with ZKSCAN1-MET fusion and MET amplification: case reports and literature review. Discov Onc 16, 1107 (2025). https://doi.org/10.1007/s12672-025-02930-4

- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)