首页 > 医疗资讯/ 正文
TP53突变在髓系肿瘤中发生率为10%至15%,是最重要的预后因素之一。数据显示,TP53突变等位基因状态是决定临床结局的关键因素,具有多打击TP53突变的髓系肿瘤预后极差。
在临床和研究环境中用于评估TP53突变状态的方法存在显著差异,导致报告的患者特征、治疗反应和生存率存在差异。事实上,专业学会和具有里程碑意义的研究中用于定义TP53突变状态的标准也存在差异,导致了混淆、次优的临床检测以及治疗建议的差异。
《Blood》近日发表综述,回顾了用于评估TP53突变等位基因状态的方法,并根据临床可用的检测,提出了准确评估髓系肿瘤中TP53基因突变的建议。在髓系肿瘤中,热点突变约占所有TP53错义突变的35%,这些热点突变可能具有显著的负面或gain-of function属性。文章还讨论了TP53突变类型对患者结局和临床管理的潜在影响。

髓系肿瘤中的TP53突变
约10%的de novo急性髓系白血病(AML)或骨髓增生异常综合征(MDS)以及35%的治疗相关髓系肿瘤存在TP53突变,其发生率随着患者年龄的增长而增加。TP53突变与复杂的细胞遗传学异常和极差的预后相关。在正常情况下,p53蛋白通过其快速降解维持在相对较低的细胞水平,但在细胞应激反应中,p53会稳定下来,并激活一个触发DNA修复、细胞周期阻滞或凋亡的转录程序(具体取决于损伤的程度)。该反应通过一个负反馈环路紧密调控,因为p53还诱导MDM2的表达,MDM2是一种E3泛素连接酶,可靶向p53并使其降解。
TP53是一个经典的抑癌基因,通过二次打击机制发挥作用。现有证据表明,第一次打击通常为体细胞核苷酸变异(SNV)。第二等位基因的丢失可以通过多种机制发生(图1A),最常见的机制是染色体17p上第二个TP53拷贝的缺失,可发生在大约60%的AML病例和22%的MDS病例中。此外,第二个TP53等位基因可以通过获得额外的点突变而丢失。最后,突变细胞可以发生等位基因杂合性丢失(cnLOH),在这种情况下,剩余的野生型TP53等位基因被其突变对应物取代,导致后者有两个拷贝。关于TP53 SNV,错义突变占69%,其次为无义突变(7.8%)、移码插入/缺失(7.5%)和剪接位点突变(4.8%)。图1B显示了最常发生突变的十个氨基酸残基,其中大多数错义突变定位于DNA结合域。涉及残基R175、Y220、G245、R248、R273或R282的热点突变占所有TP53错义突变的30%。
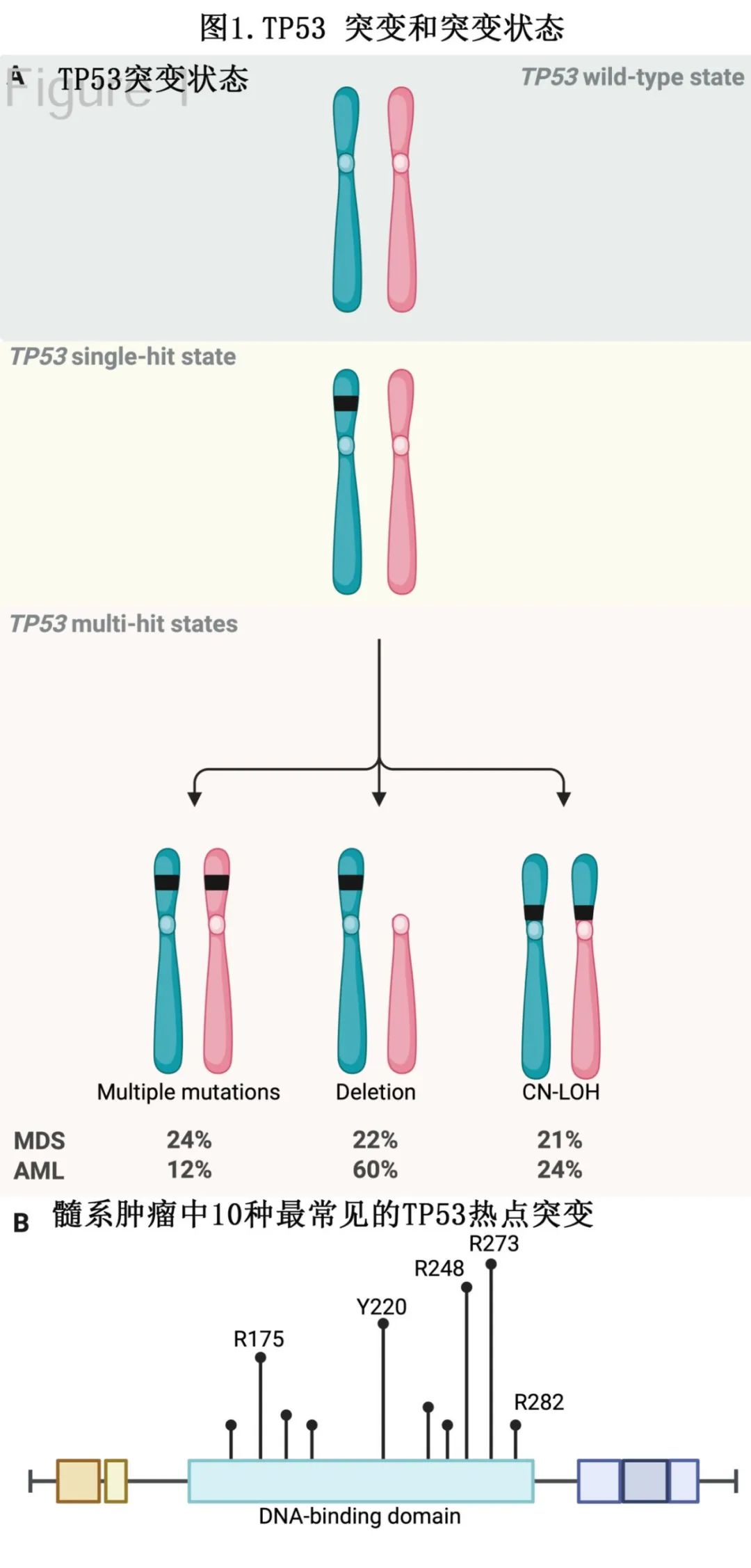
在研究中观察到,与细胞遗传学正常的单一TP53突变AML/MDS相比,具有染色体17缺失或复杂细胞遗传学的TP53突变AML/MDS与更差的预后相关,表明双等位基因TP53丢失的髓系恶性肿瘤构成一个独特的不良预后亚型。因此,根据TP53等位基因丢失的程度,已描述了两种TP53突变状态(图1A)。在MDS中提出了一个命名法,其中TP53单打击定义为携带一个TP53突变的患者,而TP53多打击定义为携带多个TP53突变或TP53突变伴随缺失的患者。同时,单等位基因和双等位基因TP53突变状态的术语与单打击和多打击互换使用,还提出了诸如低危和高危TP53突变状态等其他术语。世界卫生组织(WHO)2022版和国际癌症联盟(ICC)提出了根据TP53突变状态定义疾病亚型的不同定义,导致了进一步的诊断差异。
除了专业学会对TP53突变状态的定义不一致以及在分类上的分歧外,用于确定TP53突变状态的基因组检测的异质性也导致了混乱、次优的临床检测以及治疗和移植建议在治疗髓系肿瘤的各中心之间的异质性。本综述将探讨学术和商业TP53分子检测的参数,解读已发表研究中TP53突变状态的定义,并为全面和精准的TP53位点检测的未来发展提供路径。
TP53突变状态及cnLOH的作用
等位基因杂合性丢失(cnLOH)导致双等位基因遗传丢失,在髓系恶性肿瘤中是一个常见事件(图1A)。在TP53突变AML/MDS中尤其常见,大约21%的MDS病例和24%的AML病例存在TP53的cnLOH。然而,目前的临床检测通常不使用能够可靠解析cnLOH的技术。在这些技术缺失的情况下,通常通过TP53突变的变异等位基因频率(VAF)来推断cnLOH的存在,较高的VAF可提供双等位基因突变的证据。然而,这些估计容易出错,使得基于TP53突变状态的预后判断不准确。
在MDS中,多打击TP53丢失的恶性肿瘤的预后一直被报告为不良,中位生存期从6-12个月不等。相比之下,携带单一TP53突变的MDS病例的预后更为多变,报告的中位生存期从7-30个月不等。然而,这些研究在如何识别cnLOH方面存在差异(表1),许多研究使用不同水平的VAF cutoff值(40%、55%、60%)来推断cnLOH。例如,Bernard等人使用单核苷酸多态性(SNP)阵列来识别cnLOH,得出单打击疾病的中位总生存期为30个月。相比之下,使用VAF cutoff值来推断cnLOH的研究倾向于将单打击疾病的中位总生存期定得更低(例如7-15个月)。因此,在TP53突变MDS中,突变状态决定预后,多打击疾病普遍预后极差。然而,定义或推断cnLOH方面的差异可能导致TP53突变MDS被分类为单打击或多打击的差异,从而导致估计结局的差异。
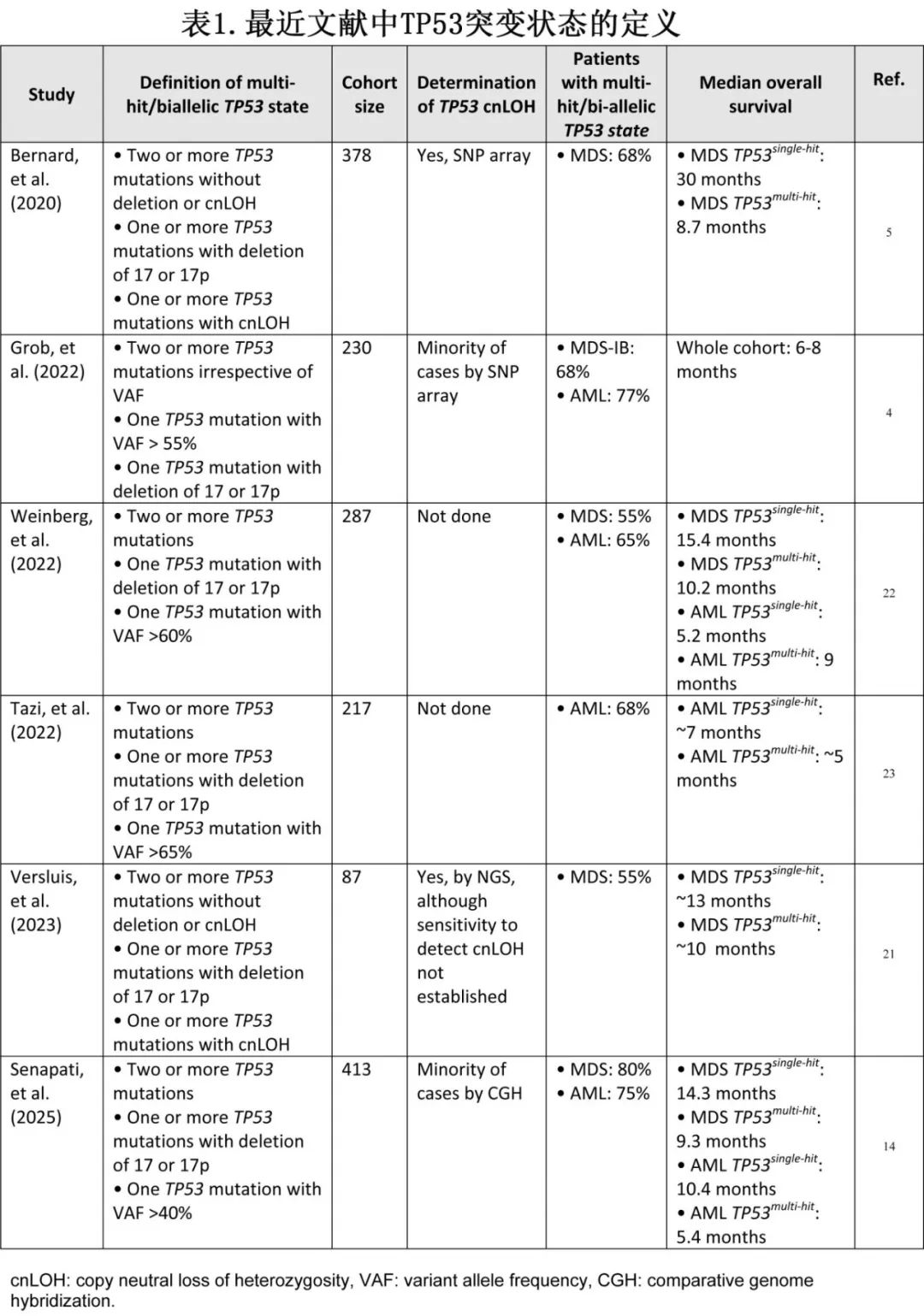
在AML中,TP53单打击与TP53多打击疾病之间的差异不甚明显,有几项研究表明多打击与单打击状态相比没有额外的预后影响。然而,在这些研究中,只有少数患者进行了精确的cnLOH测定,可能错误地将TP53多打击患者归类为单打击,使得后者的预后看起来更糟。此外,在成人中,TP53突变AML患者中,单打击疾病仅占TP53突变病例的约10%。在大多数分析中,这些患者被与多打击疾病患者归为一组,导致关于治疗、反应、移植的影响以及生存估计的建议不够明确。
在临床环境中,缺乏精确的cnLOH检测也可能导致诊断和预后判断的不准确。例如,在没有染色体异常的情况下,TP53 cnLOH状态的变化可以显著影响患者的改良国际预后评分系统(IPSS-M)风险分类,TP53 cnLOH的存在使IPSS-M预期生存期减少7个月,并使AML转化的预测风险从14%增加到28%。事实上,高危TP53单打击MDS患者对去甲基化药物的总反应率高达50-52%,反应持续时间接近TP53野生型状态,中位生存期约为21个月。因此,须在研究和临床环境中统一诊断流程,以确认TP53突变状态。
除了cnLOH之外,确定多打击状态最安全的方法是识别一个TP53突变并伴随染色体17或17p的缺失,另一种方法是观察到两个独立的TP53突变。然而,存在多个TP53突变有两种潜在的替代情况,它可能仍然代表单打击状态:1)两个或更多突变发生在同一个TP53等位基因上,或2)独立的低VAF TP53突变克隆(即克隆性造血)与TP53突变恶性肿瘤共存。前者虽然在其他癌基因中被识别,但从未与TP53一起报告过,因此是一个不太可能的事件。后者可能发生在细胞毒治疗的选择性压力下,多个独立的TP53突变克隆经常平行扩增。尽管目前在临床环境中还无法获得用于排除独立TP53突变克隆的单细胞基因分型技术,但如果两个TP53突变(1)具有较高的VAF(表明克隆性),以及(2)在相似的VAF下存在(特别是在两个VAF在多个时间点相关的情况下),则这种可能性较低。
TP53突变伴随复杂核型也被建议作为TP53多打击状态的替代指标。由于p53功能对于维持基因组稳定性非常必要,具有复杂核型的患者与具有双等位基因TP53丢失的患者有显著的重叠。事实上,Esteve等人显示,在没有复杂核型的TP53突变AML患者中,移植后两年的总生存率为40%,而在有复杂核型的患者中为20%。然而,大约16-20%的TP53突变AML/MDS患者存在复杂核型,但没有染色体17缺失或cnLOH,而10%的TP53 cnLOH患者存在非复杂核型。如果使用复杂核型作为TP53多打击状态的替代指标,这些患者可能会被错误分类。
总体而言,上述结果表明,在临床和研究环境中,关于TP53突变状态的诊断不确定性仍然存在,需要一个统一的诊断流程来确认TP53突变AML/MDS中的这种状态。
如何检测TP53改变
美国国家综合癌症网络(NCCN)、欧洲白血病网(ELN)及美国病理学家学会/美国血液学会(CAP/ASH)关于MDS和AML的指南均推荐采用常规细胞遗传学、覆盖17p13.1带的荧光原位杂交(FISH)以及利用多重基因panel进行TP53突变评估来进行细胞分子检测。
常规细胞遗传学在髓系恶性肿瘤的预后中仍发挥着基础性作用,并且是指导治疗的风险分类的基础。但在远离样本采集地进行分析时,常规细胞遗传学在10%至27%的髓系肿瘤病例中会失败。在MDS和AML的晚期临床试验中,细胞遗传学失败的发生率分别为5%至12%和2%至5%。在MDS中,多达15%的患者分析的中期分裂相少于推荐的20个,导致假阴性结果,尤其是在被评估为核型正常的患者中。这一点尤其重要,因为17号染色体的病变可能为亚克隆,并且保留其预后影响。
有一种重要的筛查技术用于推断TP53基因病变的存在,即p53抗体免疫组化(IHC),其检测TP53突变的敏感性为65%至75%,特异性为100%。一项研究建议,7%的强染色p53+细胞的cutoff值具有100%的特异性和67%的敏感性。p53 IHC存在显著局限性,因为它不提供关于TP53突变等位基因状态的信息,并且在p53蛋白缺失的病例中存在假阴性结果(例如截短突变),占TP53突变髓系肿瘤病例的15%至25%。它还可能受到观察者间变异性的限制,但可以通过数字图像辅助分析来改善。尽管单独使用p53 IHC不足以确定TP53突变状态,但在资源有限的环境中,作为初步诊断步骤以进行确认性基因检测是合理的。
关于TP53突变鉴定,目前还没有关于基因覆盖范围、最低检测限或特定测序方法的具体指导。大多数学术研究中心使用与研究环境中使用的参数非常相似的本地开发的panel。然而在商业实验室中,外显子覆盖范围和检测限存在差异,这些参数也通常与landmark报告不同(表2)。某些预后模型,例如改良国际预后评分系统(IPSS-M)或分子预后风险签名(mPRS),严重依赖精确的TP53突变信息,可能会受到低深度或可变覆盖范围的影响。
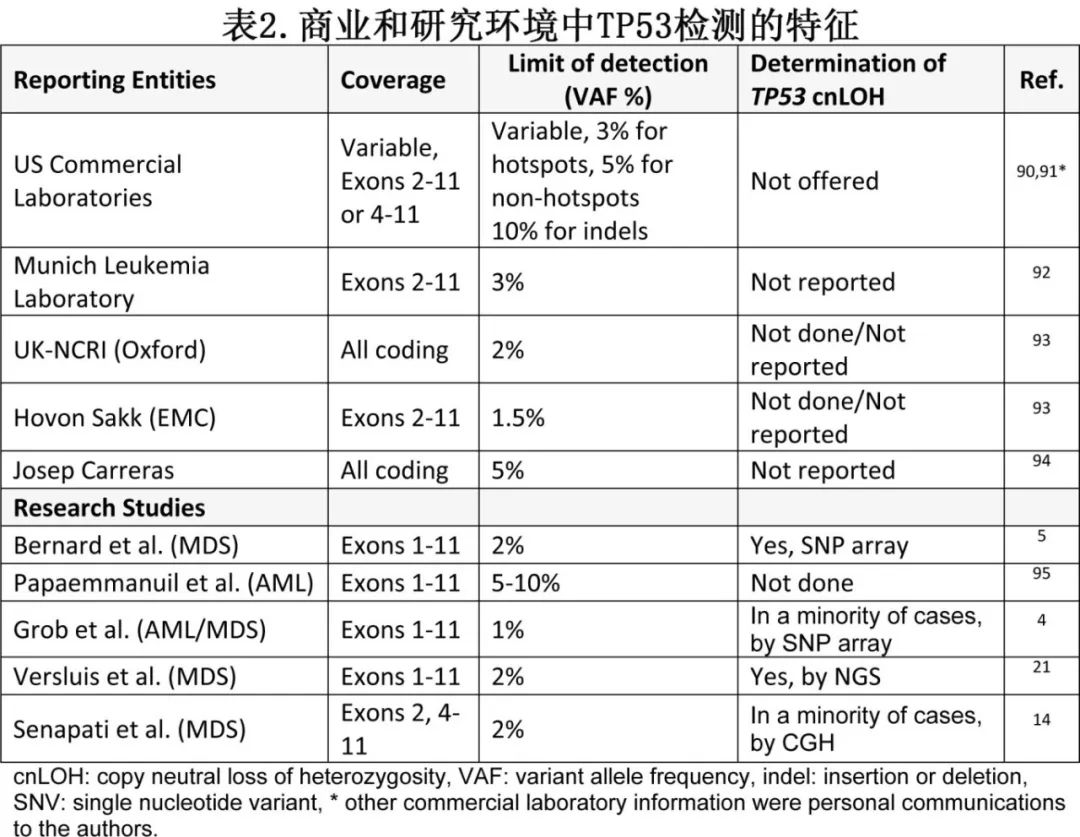
由于常规细胞遗传学和基因panel检测可能会因野生型等位基因的拷贝数丢失(cnLOH)而遗漏一部分TP53多突变患者,学术中心已采取方法来精确识别cnLOH,包括全基因组测序(WGS)、光学基因组作图(OGM)和染色体或SNP芯片,使用这些方法通常会导致突变状态的重新分类。事实上,国际临床细胞遗传学协会(ICC)推荐对TP53进行cnLOH测定,建议使用WGS、全外显子测序(WES)或染色体微阵列等方法。然而该建议尚未广泛实施,目前也没有临床商业实验室建立用于检测髓系恶性肿瘤患者TP53 cnLOH的既定工作流程。表3为每种方法及其在cnLOH检测中的局限性。
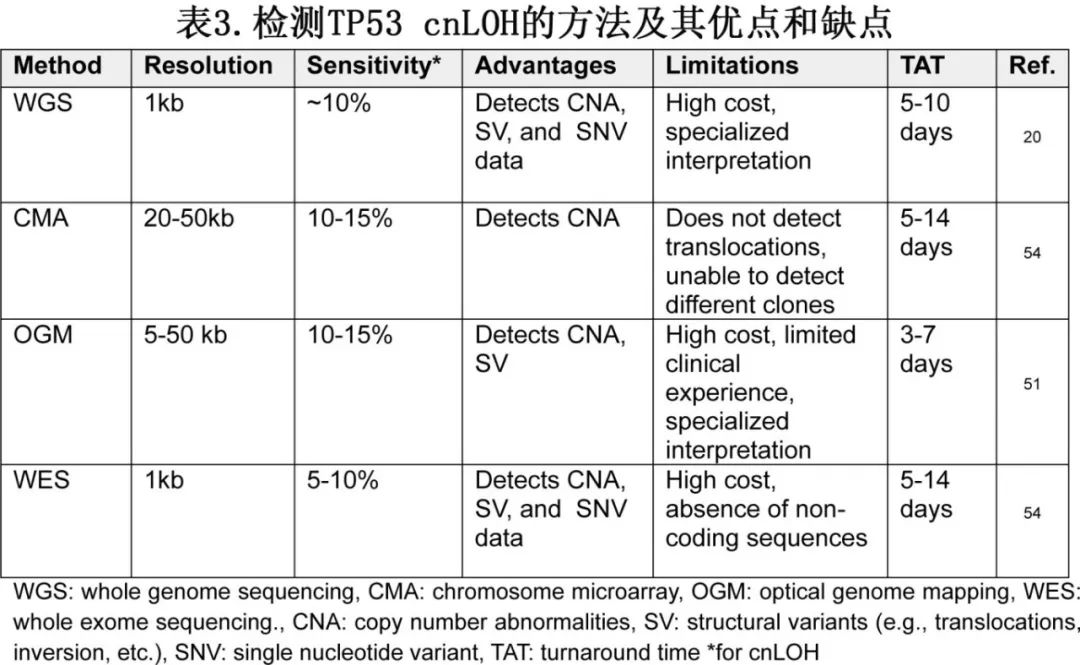
在缺乏确认性cnLOH检测方法的情况下,有时会根据TP53突变VAF>50%(或其他VAF cutoff值)来推断TP53突变的双等位基因状态。然而,相当比例(6%至12%)的TP53多突变AML患者可能会被误分类为TP53单突变。在MDS中该问题更为严重,一项研究表明,21%的多突变TP53突变病例被误分类为单突变。为了解决这一问题,研究人员使用SNP芯片来可视化常规细胞遗传学遗漏的17号染色体的拷贝数改变,从而提高了TP53突变状态定义的精确性。重要的是要认识到,临床上使用的预后模型(如IPSS-M)是在理想条件下构思的,使用TP53全外显子覆盖、高深度测序和SNP芯片cnLOH推断。尽管有先进的细胞遗传学检测,但缺乏常规TP53 cnLOH检测来定义患者的TP53突变状态是一个关键的信息缺口,阻碍了临床医生提供精确的治疗和移植建议以及应用预后模型。
TP53突变的髓系肿瘤的分类
髓系肿瘤的共识分类方案现在纳入独特的、基于生物学信息的基因驱动因素。WHO和ICC对TP53突变髓系肿瘤的分类总结于图2。
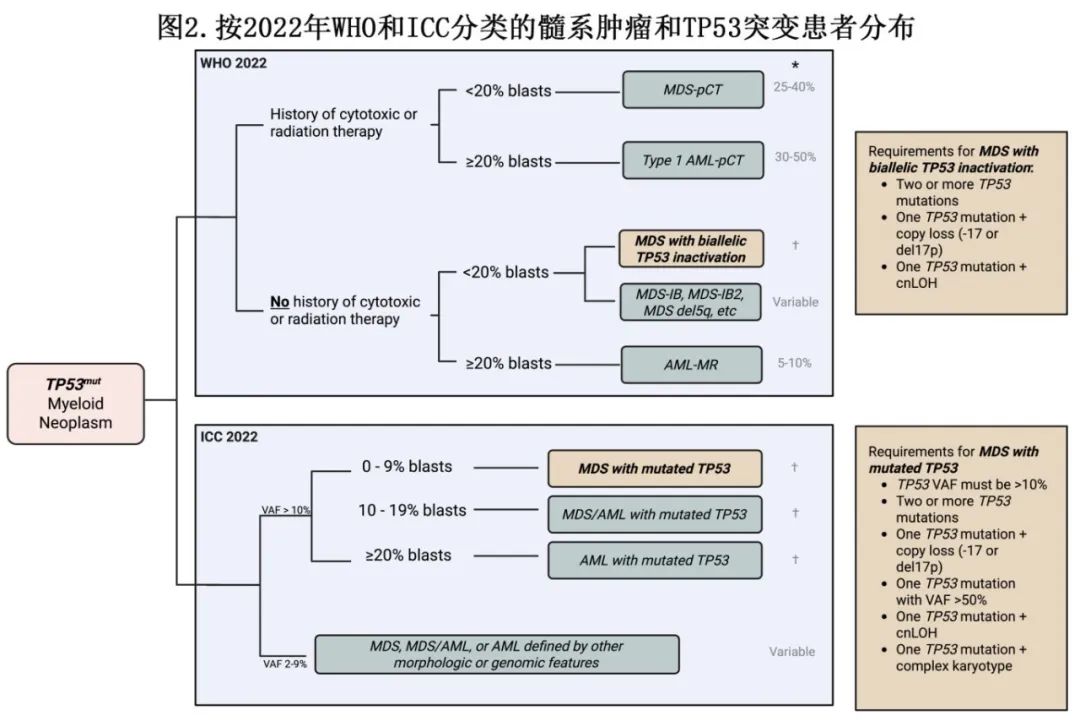
这两种分类都是分层划分的。WHO 2022对TP53突变恶性肿瘤的分类是根据历史上的细胞毒性治疗先例和原始细胞百分比来划分的,ICC 2022则是根据TP53突变VAF和原始细胞百分比来对这类恶性肿瘤进行分类的。尽管缺乏协调一致,但两个分类存在两个问题:1)在TP53突变AML和MDS中,原始细胞百分比是否有意义?2)定义TP53突变髓系肿瘤的适当VAF cutoff值是多少?
针对第一个问题的分析可以强有力地得出结论,在TP53多突变患者中,原始细胞百分比是无关紧要的,因为它们除了突变状态之外没有提供额外的预后能力。同样,这些研究也没有采用cnLOH检测。第二个问题更为复杂。通常来说,患者会出现VAF为20%至50%的TP53突变,这些被认为存在于创始克隆(founding clone)中,因为TP53突变已被观察到在白血病发生早期出现,推动疾病演变和表型变化。然而,由于目前临床上可用的技术无法解决克隆性问题,因此很难知道VAF小于20%的TP53突变是否存在于优势克隆中、出现于较晚的亚克隆群体,还是代表共存的克隆性造血。关于VAF低于20%的TP53突变AML/MDS的数据存在冲突,一项AML的研究表明这些低VAF突变保留其预后影响,而另一项MDS的研究则显示,与VAF较高的病例相比,VAF小于20%的病例生存率有所提高。此外,即使在诊断时VAF小于10%的病例,也与未来的复发有关。因此,VAF小于20%的TP53突变的临床和生物学意义存在关键的研究空白,因为这是一个常见的临床情况,也许会随着单细胞技术在研究环境中的增加使用而得到解决。另一个当前研究领域是TP53野生型p53功能障碍。从预后角度来看,这些患者表现得像TP53突变患者,但没有基因突变或缺失的证据。正在研究能够解析基因甲基化和表达的新兴技术。然而,目前仍然没有临床方法可以检测非遗传性病变引起的p53功能障碍。
毫无疑问,将基因病变纳入分类系统显著提高了诊断精度。然而,基于临床病史的类别(如既往暴露于细胞毒治疗)具有异质性结局,不足以定义 TP53 髓系肿瘤,其中预后因素是存在突变本身。未来的协调工作应强调不同基因组驱动因素在结局中的首要地位,并作为疾病行为的决定性因素。
TP53突变特性(identity)是否重要?
大规模的NGS驱动的研究也增加了我们对髓系恶性肿瘤中出现的TP53突变类型的了解。TP53中的大多数体细胞单核苷酸变异是错义突变,最近对1117例TP53突变髓系恶性肿瘤的研究显示,这类突变占所有TP53突变的69%。这些错义突变大多位于TP53的DNA结合域,其中约30%位于七个热点残基:R175、Y220、G245、R248、R273或R282(图1B)。由于其他白血病相关基因中的突变身份已被强烈地与造血干细胞(HSC)克隆扩张或进化为白血病克隆的倾向联系在一起,这就提出了一个问题:TP53突变的身份是否会影响白血病的发展、临床预后或对治疗的反应。
认为TP53中的错义突变并不简单地导致等位基因功能丧失的证据大多来自临床前模型,携带胚系Trp53热点突变(例如R172H、R270H、R248W或R248Q)的小鼠与失去Trp53的小鼠相比,发展出不同的肿瘤谱系。几项研究随后系统地评估了不同的TP53点突变如何影响p53功能,既影响它们所在的等位基因,也影响相应的野生型等位基因。他们发现,许多TP53错义突变(特别是在热点残基中的突变)不仅可以废除它们所在的等位基因中的TP53功能,还可以以一种显著负面的方式部分抑制野生型等位基因中的TP53活性。有趣的是,这些研究还表明,TP53突变减少全局TP53活性的倾向与它们在人类癌症中的流行率以及它们在小鼠模型中增强HSC健康度(fitness)的能力相关。这些数据表明,TP53错义突变在其生物学影响上存在差异,至少部分原因是它们能够以显著负面的方式抑制TP53活性。因此,与携带截短突变的HSC相比,携带热点错义突变的HSC中的p53活性受到更大程度的抑制,而在两种情况下,失去剩余的野生型等位基因都会进一步降低p53活性。
与特定TP53突变的多变生物学效应相比,TP53突变特性的临床影响则更为模糊。TP53突变经常在CH中被识别,特别是在细胞毒治疗之后,从而提出了TP53突变HSC的克隆扩张有助于治疗相关AML/MDS的发展。然而在风险预测算法中,CH相关TP53突变的特性并未与髓系恶性肿瘤的未来风险联系起来。有趣的是,Fabre等人表明,CH相关的TP53错义突变比TP53截短突变更有可能扩张(而截短突变更有可能保持不变甚至收缩),表明TP53突变特性在HSC克隆动态中发挥作用,其对白血病发生的影响可能被其他因素掩盖,包括暴露于细胞毒应激或患者年龄。另外,与其他CH相关基因一样,TP53突变CH最近也被与动脉粥样硬化疾病联系在一起。携带特定TP53热点突变的CH患者是否处于特别高的风险中还有待确定。
还有相当大的研究兴趣在于,TP53突变特性是否会影响髓系恶性肿瘤发展后的患者预后。在AML中,几项研究未能将总体预后与TP53突变类型(错义与截短)联系起来。其他研究试图根据它们破坏p53功能的能力对不同的TP53错义突变进行分类,Neskey等人使用进化追踪方法分配了一个进化行动(Eap53)评分,Kottler等人使用饱和突变来得出一个相对适应性评分(RFS)。Dutta等人评估了这些评分是否与98例TP53突变AML患者的临床结局相关,尽管前者与总生存率没有相关性,但RFS评分高危患者总生存率和无事件生存率都有所降低。需要进一步的研究来验证这些结果,并确定它们在多大程度上依赖于患者的TP53等位基因状态。目前不建议在髓系恶性肿瘤中使用TP53突变的特性来预测结局或选择治疗。但由于携带错义突变的TP53蛋白往往高表达,因此业内对靶向它的研究兴趣很大。这些方法主要由以下两种组成:(1)使用小分子使突变的TP53蛋白恢复到其天然构象,恢复其野生型活性;(2)确定是否可以将突变的TP53蛋白用作免疫治疗中的新抗原。是否可以通过靶向特定的TP53突变来改善这种预后不良的疾病的结果还有待观察。
TP53突变髓系肿瘤检测和命名的建议
作者提出对TP53突变髓系肿瘤患者的诊断评估,详见图3。
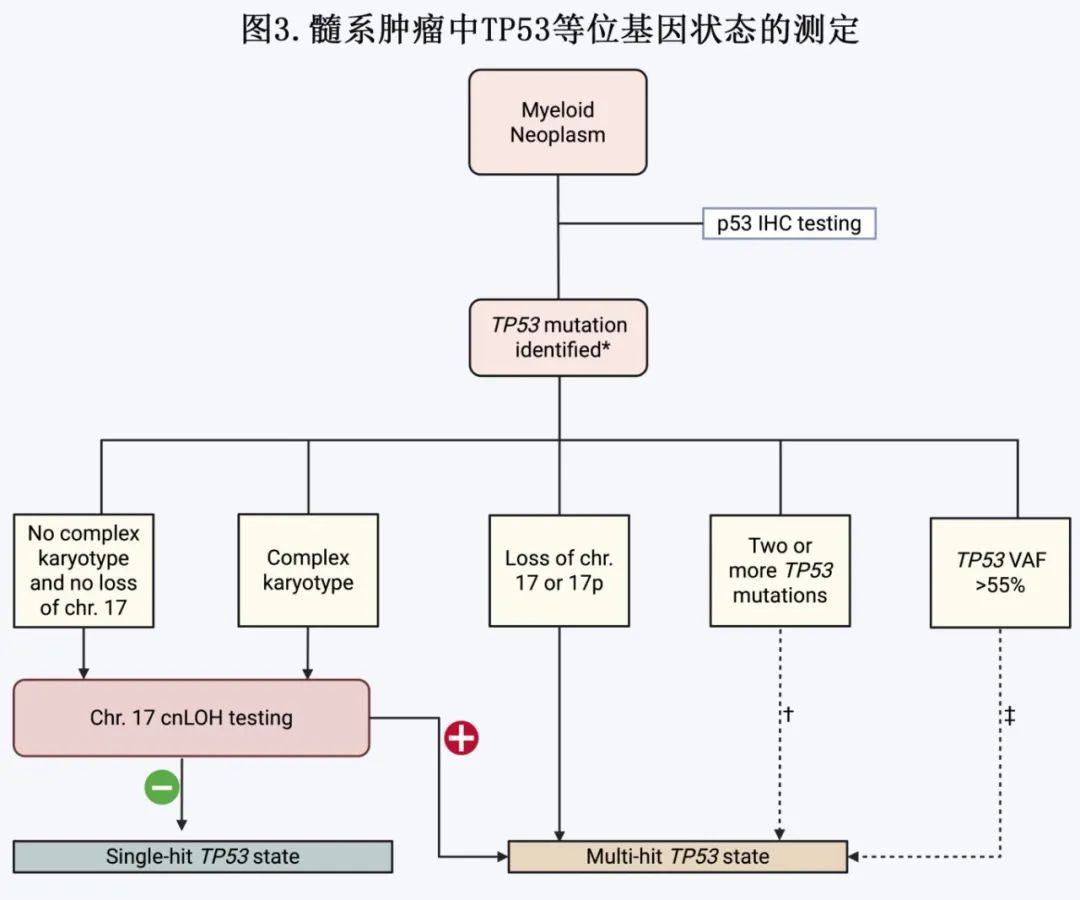
与当前实践一致,初步遗传学检查应包括评估至少20个中期分裂相的常规细胞遗传学、17号染色体FISH以及包含TP53外显子2至11的靶向NGS panel(最低检测限为2% VAF)。这是大多数高资源环境中的当前实践。该检查的关键补充为针对TP53位点的cnLOH检测。具体来说,在缺乏17号染色体异常的TP53突变AML/MDS中,临床医生和实验室应要求能够解析cnLOH的技术,如染色体微阵列、全外显子测序(WES)、光学基因组作图(OGM)或全基因组测序(WGS)。
WGS作为一种快速、全面且日益具有成本效益的替代方案,正在成为髓系肿瘤的初始诊断检查。它取代了劳动和资源密集型的细胞遗传学,后者存在相当大的失败风险,而WGS具有快速的周转时间,并可提供基因发现和回顾性数据挖掘的可能性。它能够识别小至1千碱基对的cnLOH区域。60-80X覆盖度的WGS能够可靠地检测到存在于20%或更多细胞中的cnLOH(对应于>20%的VAF)。这项技术需要由经验丰富的分子病理学家进行解读,因为许多临床上无关的变异也可识别出来。此外,还报道了与其他基因(如TET2)的多打击丢失相关的不同治疗反应和多样的表型,使得WGS数据库在未来研究中具有价值。
关于基于研究的命名法,在缺乏17号染色体或17p13缺失的TP53突变AML/MDS患者中,应将“TP53单打击”和“TP53多打击”这些术语限制在使用cnLOH检测技术来验证突变状态的病例中。对于TP53中存在多个突变的患者,作者也推荐使用“TP53多打击”这一术语,因为这些患者与同时存在17号染色体缺失的患者观察到的结果相似。采用这种做法将统一命名法,从而得出经过验证的突变状态,并与临床变量(如治疗反应和生存率)建立精确的下游关联。此外,在基因组技术正在兴起的资源有限的国家,WGS可用作常规细胞遗传学、FISH和SNV鉴定的单一检测诊断替代方案。
在研究环境中,最好不要使用特定的VAF cutoff值来推断cnLOH和TP53多打击状态,因为这可能导致混淆和语义上的崩溃。在使用VAF推断时突变状态可变性的一个清晰例子可以在Grob等人的分析中找到,其中33%的MDS/AML患者具有<55%的TP53突变VAF,实际上在进行cnLOH检测时具有TP53多击状态。另一个例子是在开发IPPS-M模型中观察到的,其中55%的VAF被认为是单打击,但56%的VAF被认为是多打击。通过在具有高TP53突变VAF且可能代表cnLOH的病例中进行常规cnLOH检测,可以解决这一难题。然而,在临床环境中,特别是在由于成本或时间限制而无法进行精确cnLOH检测的情况下,那么VAF>55%且覆盖度大于200x的TP53突变几乎肯定是由TP53的双等位基因丢失导致的。
我们正处于基础性、经受时间考验的细胞遗传学和高灵敏度精准基因组学之间的过渡时期。髓系肿瘤的诊断目前包括一种过时的组合,即20世纪中期的方法和最先进的基因测序。随着成本的持续下降,NGS在新诊断、治疗后和复发髓系肿瘤中的持续使用将使我们能够定义驱动它们的基因病变。同时使用能够检测cnLOH区域的检测方法通过检测隐匿性驱动因素以及将某些驱动因素归类为单等位基因或双等位基因来补充这一点。最终,使用髓系疾病的基因驱动因素来定义临床实体将为个性化治疗和精准临床试验开发铺平道路,实现改善预后的承诺。
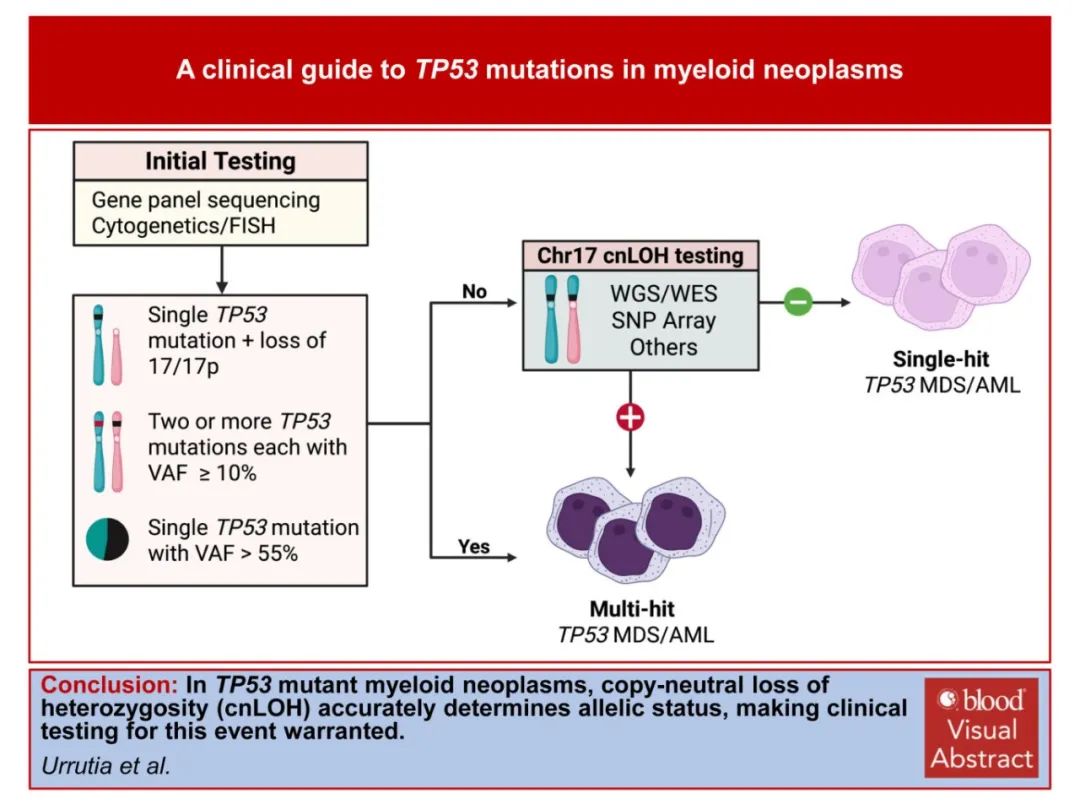
对于TP53突变髓系恶性肿瘤,准确确定TP53突变等位基因状态至关重要,因其既影响预后也影响治疗。作者建议,对于专注于TP53突变髓系恶性肿瘤的研究,cnLOH的基因检测是强制性的。在临床环境中,作者建立了一个诊断工作流程,其中标准的基因panel测序和细胞遗传学将识别大多数多打击TP53突变髓系恶性肿瘤病例。对于被识别为可能的单打击病例,建议与学术中心合作进行cnLOH检测。
参考文献
Urrutia, S., Wong, T. N., & Link, D. C. (2025). A clinical guide to TP53 mutations in myeloid neoplasms. Blood, blood.2025029691. https://doi.org/10.1182/blood.2025029691
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)