首页 > 医疗资讯/ 正文
研究背景
乳腺癌是全世界女性最主要的死亡原因之一,亟需有效的治疗策略。近年来,成像引导的光动力疗法(PDT)因其对乳腺癌的选择性和敏感性而备受关注。然而,关键的挑战依然存在,特别是肿瘤部位低质量成像导致光动力疗法效率低下。为解决这一问题,近日由西安交通大学王福教授联合西安电子科技大学沈颖莉副教授和西班牙马德里自治大学Daniel Jaque教授在美国化学学会旗下期刊《ACS Nano》上发表题为“Ce6-DNAzyme-Loaded Metal–Organic Framework Theranostic Agents for Boosting miRNA Imaging-Guided Photodynamic Therapy in Breast Cancer”的研究论文。该研究开发了一种Ce6-DNAzyme@ZIF-8@PEG的纳米粒子(CDZP NPs),该纳米粒子基于十二面体金属有机框架(MOF)ZIF-8,具有优异的生物相容性、酸响应释放行为和高负载能力。CDZP NPs纳米粒子通过一锅合成封装了miR-21双循环成像系统和Ce6-DNAzyme治疗系统,并进一步通过GPX4-DNAzyme介导的基因编辑来抑制活性氧(ROS)清除,从而增强PDT效率。这些特性使 Zn2+、Ce6 和双循环信号放大系统得以控制释放,从而同时实现 miR-21成像检测和增强 PDT治疗。这一创新性的诊疗策略有望推动肿瘤的诊疗一体化研究。
主要内容
如图1所示,通过一锅溶剂法将miR-21双循环信号放大系统和增强型PDT系统包载入ZIF-8 NPs,构建了乳腺癌纳米诊疗剂。合成的Ce6-DNAzyme@ZIF-8(CDZ)NPs经PEG修饰后,可提高体内稳定性和生物相容性(图1A)。如图1B-C所示,Ce6-DNAzyme@ZIF-8@PEG(CDZP)NPs经静脉注射后,能通过EPR效应实现肿瘤靶向聚集,从而促进纳米粒子被细胞摄取且避免其被降解。当CDZP NPs被递送至乳腺癌细胞后,肿瘤部位的酸性pH值有利于Zn2+、Ce6、DNAzyme的释放,通过肿瘤部位高表达的miR-21特异性的启动miRNA双循环检测信号放大系统。另一方面释放的Zn2+可激活GPX4-DNAzyme的靶向酶切活性,抑制GPX4蛋白的表达,进而抑制细胞活性氧(ROS)的清除;Ce6在660 nm 光照引发PDT治疗,进而实现增强型PDT的乳腺癌治疗效果。
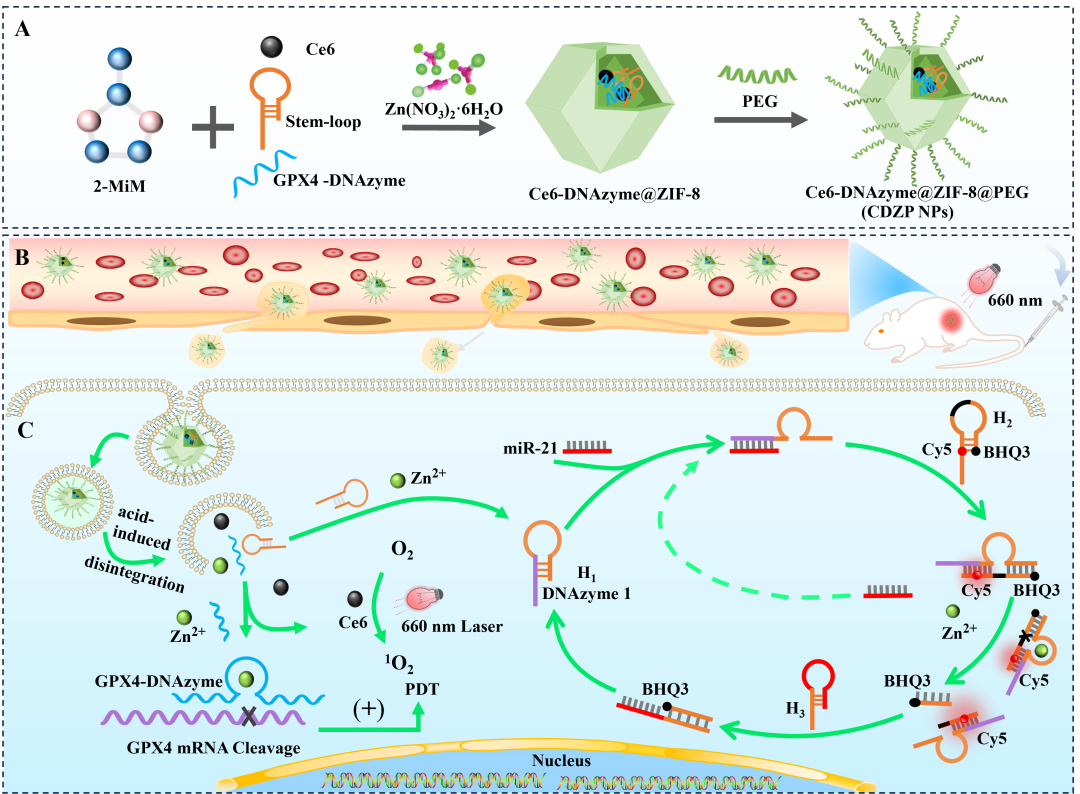
图1:(A)CDZP NPs的制备过程;(B)通过静脉注射将 CDZP NPs注入荷瘤小鼠体内后,借助高通透性和EPR 效应在肿瘤部位富集;(C)利用 CDZP NPs实现乳腺癌中 miR-21 的双循环信号放大检测及增强型PDT。
作者通过一步法构建了CDZP NPs系统(图2),为均一的十二面体结构,粒径约50 nm,Zn、O元素分布均匀;多项检测证实PEG修饰成功,且有效负载了Ce6和GPX4-DNAzyme。CDZP NPs结构稳定,粒径适合细胞吸收。这些特征为其后续用于乳腺癌诊疗奠定了基础。
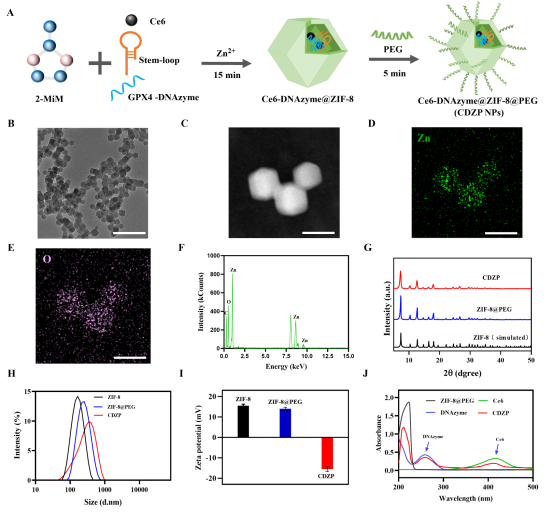
图2.(A)CDZP NPs的合成路线示意图,(B)TEM图像,(C)STEM图像,CDZP NPs的元素分布图谱(D)Zn、(E)O,(F)合成的CDZP NPs的EDX图,(G)ZIF-8@PEG和CDZP NPs的XRD图谱,(H)ZIF-8(黑色)、ZIF-8@PEG(蓝色)和CDZP NPs(红色)的DLS结果,(I)ZIF-8、ZIF-8@PEG和CDZP NPs的Zeta电位,(J)DNAzyme,(蓝色)、Ce6(绿色)、ZIF-8@PEG(黑色)和CDZP NPs(红色)的紫外-可见吸收光谱,DNAzyme和Ce6的特征吸收峰分别由箭头指示。(B)中的比例尺为200 nm,(C)-(E)中的比例尺为50 nm。
图3展示了CDZP NPs在肿瘤诊疗中的核心机制,该系统能在肿瘤酸性微环境(pH 5.5)中高效释放Ce6和GPX4-DNAzyme(释放率超80%),而在正常环境(pH 7.4)中释放极少,提升了肿瘤治疗的特异性;同时呈现了miR-21双循环信号放大检测原理:miR-21打开探针H1,结合Zn²+激活的酶切作用完成首轮循环,切割后的H2片段再打开H3启动二次循环。经实验验证,该系统仅对miR-21特异性响应,荧光信号随miR-21浓度递增,检测限低至3.4 pM,为乳腺癌早期精准检测提供有力支持。
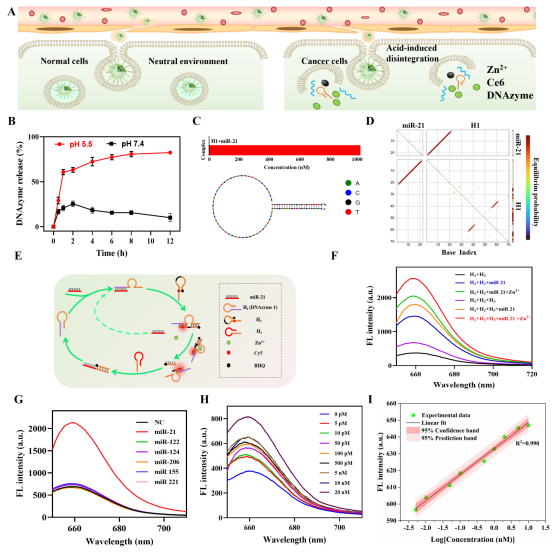
图3.(A)酸性响应型CDZP NPs在正常细胞(左)和肿瘤细胞(右)中的作用示意图,(B)CDZP NPs在不同pH刺激下的酸性响应性DNAzyme释放情况,(C)miR-21打开H1茎环结构的预测结果(miR-21与H1的比例为1:1),(D)miR-21与探针H1之间碱基配对概率的热图,(E)miR-21检测的双循环信号放大示意图,(F)不同组别中Cy5染料产生的荧光光谱:H1+H2组、H1+H2+miR-21组、H1+H2+miR-21+Zn2+组、H1+H2+H3组、H1+H2+H3+miR-21组以及H1+H2+H3+miR-21+Zn2+组,(G)CDZP NPs对不同miRNA的荧光发射响应(miRNA浓度均为1μM,NC:无miRNA),(H)CDZP NPs与不同浓度miR-21孵育后的荧光光谱,(I)miR-21浓度与检测到的荧光强度之间的线性拟合(图中包含置信带和预测带)。
图4展示了CDZP NPs检测细胞内miR-21表达变化的实验结果:通过向MCF-7细胞转入miR-21抑制剂、向MCF-10A细胞转入miR-21模拟物来调控细胞内miR-21水平。荧光共聚焦图像显示,miR-21抑制剂处理的MCF-7细胞荧光显著减弱,而miR-21模拟物处理的MCF-10A细胞荧光明显增强,流式细胞术结果也证实了这一变化。这表明CDZP NPs能灵敏、特异地检测细胞内miR-21的表达波动,为乳腺癌相关的miRNA动态监测提供了有力工具。
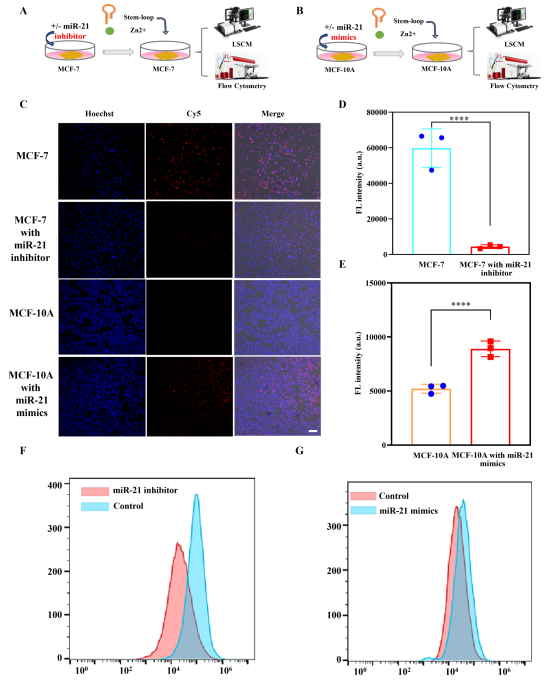
图4. (A)经miR-21抑制剂预处理的MCF-7细胞示意图;(B)经miR-21模拟物预处理的MCF-10A细胞示意图;(C)不同处理后MCF-7和MCF-10A细胞的共聚焦荧光图像;(D)图C中MCF-7细胞荧光强度的定量分析;(E)图C中MCF-10A细胞荧光强度的定量分析;(F)miR-21抑制剂处理前后MCF-7细胞的流式细胞术分析;(G)miR-21模拟物处理前后MCF-10A细胞的流式细胞术分析。
此外,通过对4T1荷瘤小鼠静脉注射给药后(图5),CDZP NPs借助EPR效应0.5 h内即可聚集到肿瘤部位,4 h荧光强度达峰值,随后自然下降。4 h时的生物分布显示,CDZP NPs主要聚集在肿瘤和肝脏,且肿瘤部位荧光强度高于肝脏。这些结果验证了CDZP NPs靶向检测肿瘤miR-21的能力,也证实了其双循环信号放大系统在体内的有效性。
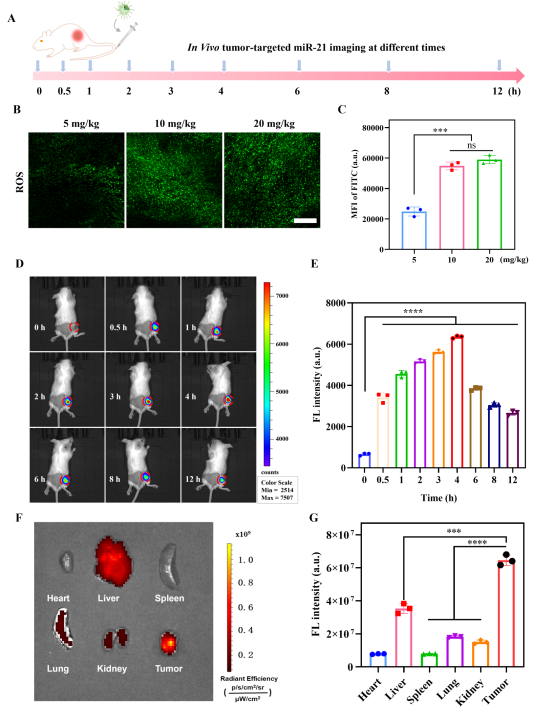
图5 (A)荷瘤BALB/c小鼠的给药及成像策略,(B)不同剂量CDZP NPs给药3天后肿瘤组织中ROS水平的共聚焦荧光图像(比例尺为200 μm),(C)图B中的荧光强度数值的量化,(D)静脉注射CDZP NPs后不同时间点(0、0.5、1、2、3、4、6、8、12 h)的小鼠荧光图像,(E)(B)的荧光强度量化结果,(F)注射后4 h主要器官及肿瘤的离体荧光图像,(G)(D)的荧光强度量化结果。
接着,作者在细胞水平阐述了CDZP NPs增强PDT的分子机制(图6),其结果显示,CDZP NPs在肿瘤酸性环境中解体释放的Ce6在660nm激光照射下产生大量ROS,而GPX4-DNAzyme经Zn²⁺激活后可抑制GPX4蛋白表达(mRNA抑制率72%、蛋白抑制率95%),阻止ROS被清除,从而增强PDT效果,4T1死细胞比例达71.3%(显著高于单纯Ce6组的53.4%),凋亡率达90.3%(接近单纯Ce6组的2倍),且载体本身无细胞毒性。这些结果证实CDZP NPs能高效增强PDT对乳腺癌细胞的杀伤作用,为后续体内治疗奠定基础。
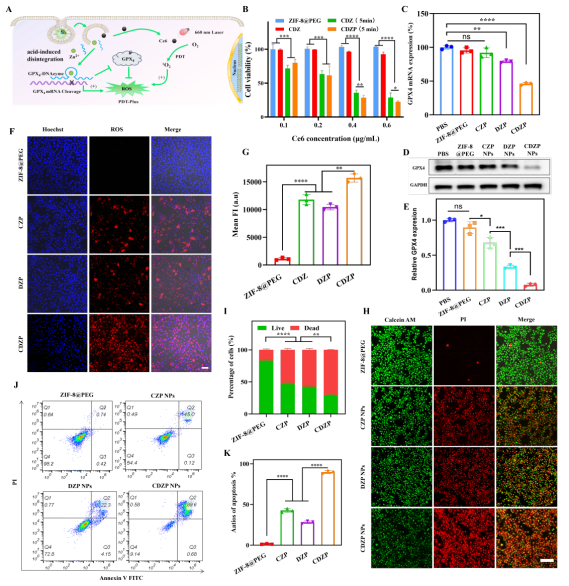
图6. (A)CDZP NPs增强PDT的作用机制示意图;(B)在660 nm波长、功率密度为0.4 W/cm²的光照条件下照射5分钟后,不同浓度Ce6(0.1、0.2、0.4、0.6 μg/mL)处理的4T1细胞存活率;(C)不同组4T1细胞中GPX4 mRNA相对表达水平的q-PCR检测结果;(D)不同处理组4T1细胞中GPX4蛋白的Western blot分析及相应的定量结果(E);(F)不同组中ROS蓄积的共聚焦荧光图像及相应的定量结果(G);(H)不同组的活死细胞染色结果及相应的定量结果(I);(J)不同处理后4T1细胞凋亡率的流式细胞术分析及相应的凋亡率数据。
最后,作者研究了CDZP NPs在体内诊疗效果(图7)。结果显示,CDZP组肿瘤生长被显著抑制——肿瘤体积明显小于其他组,肿瘤抑制率达72.3%(CZP组29.6%、DZP组36.4%)。肿瘤组织检测发现,CDZP NPs组ROS积累最多,肿瘤细胞凋亡最显著,细胞增殖抑制最强,印证了其通过Zn²⁺激活GPX4-DNAzyme增强型PDT的机制。同时,各组小鼠主要器官无明显病理变化,体重稳定,表明该纳米诊疗剂生物安全性良好。这些结果直观证明CDZP NPs在乳腺癌体内诊疗中兼具高效性与安全性。
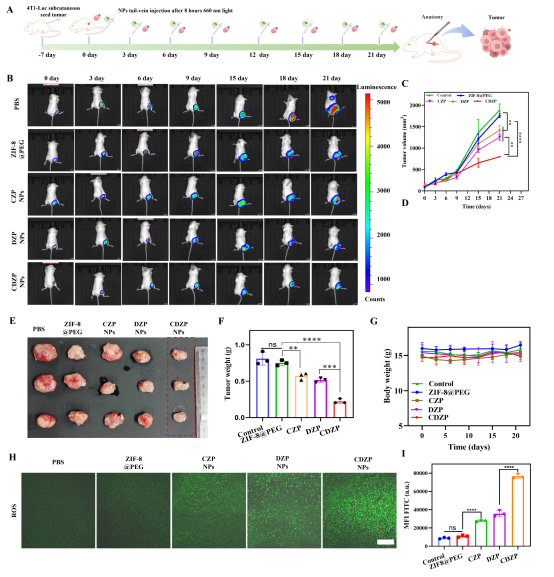
图7. (A)BALB/C小鼠的治疗方案示意图,(B)不同治疗组(包括PBS组、ZIF-8@PEG组、CZP NPs组、DZP NPs组和CDZP NPs组)小鼠的IVIS成像结果;(C)不同治疗组通过人工测量得到的肿瘤体积随时间的变化;(D)治疗21天后肿瘤部位的荧光强度值;(E)治疗21天后从小鼠体内取出的肿瘤光学照片(n = 3);(F)不同治疗组的肿瘤重量直方图;(G)治疗期间不同组小鼠的体重监测结果;(H)治疗后肿瘤组织中ROS水平的共聚焦荧光图像;(I)图H中的荧光强度值。
小结
该研究成功开发出用于乳腺癌的双循环miR-21成像引导增强型PDT治疗策略。通过一锅法合成CDZP NPs,将双循环miR-21成像系统与治疗成分包载于MOF结构中。该纳米颗粒能响应肿瘤酸性微环境释放Zn²⁺、Ce6和DNAzyme,通过双信号放大实现低丰度miR-21检测(检测限3.4 pM),同时抑制GPX4蛋白以减少ROS清除,增强PDT效果,肿瘤抑制率约72.3%,该研究为肿瘤的miRNA成像引导的光动力治疗提供了新思路。
该研究论文第一作者为课题组博士生杨泽平,通讯作者为西安交通大学王福教授、西安电子科技大学沈颖莉副教授和马德里自治大学Daniel Jaque教授。本研究得到了国家自然科学基金、陕西省杰出青年基金、陕西省三秦英才计划、陕西省自然科学基金重点项目、陕西省化学与生物学基础研究项目等项目的资助。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.5c09287
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)