首页 > 医疗资讯/ 正文
[摘要]背景与目的:复发、转移及初治晚期宫颈癌的治疗仍面临挑战,免疫治疗联合化疗及靶向治疗初步显示出临床获益,但现有证据有限。本研究旨在评估卡瑞利珠联合化疗及靶向治疗对复发、转移及初治晚期宫颈癌患者预后的影响。方法:回顾性分析2019—2025年复旦大学附属肿瘤医院闵行院区收治的符合纳入和排除标准的复发、转移及初治晚期宫颈癌患者的临床资料,使用对数秩检验进行生存分析,并通过单因素和多因素Cox比例风险回归模型分析探讨预后的相关因素。本研究获得了复旦大学附属肿瘤医院闵行院区伦理委员会的审批[伦理批号:(2024)伦审第(015)号]并豁免患者知情同意。结果:本研究共纳入130例患者。根据是否接受卡瑞利珠单抗分为观察组70例(卡瑞利珠单抗,可联合化疗与靶向治疗)和对照组60例(化疗联合靶向治疗)。观察组的客观缓解率(objective response rate,ORR)为72.9%,疾病控制率(disease control rate,DCR)为80.0%,显著优于未接受免疫治疗的对照组(ORR=20.0%,χ2=36.1,P<0.001;DCR=40.0%,χ2=21.8,P<0.001)。观察组未达到中位无进展生存期(progression-free survival,PFS),优于对照组(中位PFS=7.0个月,P<0.001),Cox比例风险回归模型分析显示卡瑞利珠单抗治疗是PFS的独立保护因素(P<0.001),而患者的年龄、复发转移部位、初始治疗方式和病理学类型对PFS无显著影响。观察组有29例患者(41.4%)发生≥3级不良反应,主要包括血管增生、甲减、过敏和腹泻等。结论:在复发、转移及初治晚期宫颈癌的治疗中,卡瑞利珠单抗治疗显著改善了患者的治疗效果和预后,延长了患者的PFS。尽管存在一定比例的≥3级不良反应,但整体上患者可接受。在实际临床中,免疫治疗联合化疗及靶向治疗为患者提供了更为有效的治疗选择。
[关键词] 宫颈癌;免疫治疗;化疗;靶向治疗;复发;转移;初治晚期; 预后
[Abstract] Background and purpose: The treatment of recurrent, metastatic, and treatment-naïve advanced cervical cancer remains challenging. Immunotherapy in combination with chemotherapy and targeted therapy has shown preliminary clinical benefits, however, current evidence remains limited. This study aimed to evaluate the impact of camrelizumab combined with chemotherapy and targeted therapy on the prognosis of patients with recurrent, metastatic, and treatment-naïve advanced cervical cancer. Methods: In this study, we conducted a retrospective analysis of the clinical data from 130 patients with recurrent, metastatic, and treatment-naïve advanced cervical cancer admitted to Minhang Branch of Fudan University Shanghai Cancer Center from 2019 to 2025. The patients were categorized into the observation group (n=70), which included those who received camrelizumab with or without chemotherapy and targeted therapy, and the control group (n=60), including those who received chemotherapy and targeted therapy. Survival analysis was performed using the log-rank test, and univariate and multivariate Cox regression analyses were conducted to explore prognostic factors. This study was approved by the Ethics Committee of the Minhang Branch of Fudan University Shanghai Cancer Center[Approval number: (2024) Review No. (015)] and all informed consents were exempted. Results: The objective response rate (ORR) in the observation group was 72.9%, and the disease control rate (DCR) was 80.0%, which were significantly higher than those in the control group with an ORR of 20.0% (χ2=36.1, P<0.001) and a DCR of 40.0% (χ2=21.8, P<0.001). The median progression-free survival (PFS) in the observation group was not reached, significantly longer than that in the control group of 7.0 months (P<0.001). Multivariate Cox regression analysis identified camrelizumab treatment as an independent protective factor for PFS (P<0.001). Age, site of recurrence/metastasis, initial treatment approach, and histopathological type were not significantly associated with PFS. In the observation group, adverse events of grade 3 or higher were reported in 29 patients (41.4%), which primarily included vasculitis, hypothyroidism, hypersensitivity reactions, and diarrhea. Conclusion: The use of camrelizumab significantly improved treatment outcomes and prognosis for patients with recurrent, metastatic, and treatment-naïve advanced cervical cancer, with significantly improved progression-free survival. Although a certain proportion of patients experienced adverse events of grade 3 or higher, the overall safety profile was acceptable. In clinical practice, immunotherapy offers a more effective treatment option for patients.
[Key words] Cervical cancer; Immunotherapy; Chemotherapy; Targeted therapy; Recurrence; Metastasis; Treatment-naive; Prognosis
宫颈癌是女性常见的恶性肿瘤之一,仅次于乳腺癌、结直肠癌和肺癌[1]。在发展中国家,宫颈癌已成为第二大常见癌症[2-3]。由于宫颈癌的高发病率和死亡率,宫颈癌防治面临着巨大挑战。对于局部晚期宫颈癌患者,即使接受了根治性手术、放化疗或高剂量近距离放疗后,5年无病生存率仅为40%~83%,总生存(overall survival,OS)率仅为41%~83%[4-5]。近年来,免疫检查点抑制剂的应用已在宫颈癌治疗领域带来了革命性突破。2018年,美国食品药品监督管理局(Food and Drug Administration,FDA)批准帕博利珠单抗用于治疗程序性死亡配体(programmed death-ligand 1,PD-L1)阳性转移性或复发性宫颈癌[6]。关键性临床试验EMPOWER-Cervical 1和KEYNOTE-826的结果表明,在铂类药物治疗失败和一线持续性治疗复发性或转移性宫颈癌中,西米普利单抗和帕博利珠单抗能够显著延长患者的OS[7-9]。此外,最新数据显示,卡瑞利珠单抗联合化疗应用于局部晚期宫颈癌的新辅助治疗,能显著提高患者的客观缓解率(objective response rate,ORR)和病理学完全缓解率(pathologic complete response,pCR)[10-12]。
这些研究初步显示免疫治疗联合放化疗能进一步提高宫颈癌的治疗效果,目前也有在临床实践中应用卡瑞利珠单抗的小样本量研究报道[13-14],但疗效和安全性证据仍极为有限。本研究拟通过回顾性分析临床数据,探讨卡瑞利珠单抗联合化疗及靶向治疗在复发、转移及初治晚期宫颈癌患者中的应用价值,进一步评估其疗效,并为相关治疗策略的优化提供临床依据。
1 资料和方法
1.1 一般资料
本研究回顾性连续纳入2019年1月—2025年3月在复旦大学附属肿瘤医院闵行院区就诊的复发、转移及初治晚期宫颈癌患者。纳入标准为:① 年龄≥18岁;② 患者为初治晚期宫颈癌(ⅣB期,且无法行根治性手术或根治性放疗),或术后、放化疗后复发或伴远处转移的宫颈癌;③ 所有病例均经临床及病理学检查确诊;④ 接受化疗(紫杉醇+卡铂)联合靶向治疗,可联合或不联合卡瑞利珠单抗治疗;⑤ 对于使用卡瑞利珠单抗治疗者,卡瑞利珠单抗至少持续2个周期;⑥ 所有患者在治疗前均接受全面的基线评估,包括血常规、血生化、甲状腺功能、免疫功能、血清肿瘤标志物检测及影像学检查。排除标准:① 年龄<18岁;② 治疗周期少于2个;③ 合并严重的心肺功能、肝肾功能障碍性疾病,合并急性脑血管疾病,合并严重的自身免疫性疾病等全身性疾病不能耐受治疗;④ 随访资料不完整/失访。本研究获得了复旦大学附属肿瘤医院闵行院区伦理委员会的审批[伦理批号:(2024)伦审第(015)号]并豁免患者知情同意。
根据患者是否接受卡瑞利珠单抗治疗,将其分为两组。① 观察组为接受卡瑞利珠单抗治疗的患者,卡瑞利珠单抗在使用时经过多学科团队充分评估并与患者沟通后决定使用,均按医院管理规定流程,并经过伦理审查和超说明书用药备案。卡瑞利珠单抗的用法及用量为静脉输注,200 mg/ 次,每3周1次,直至疾病进展或出现不可耐受的毒性反应终止治疗。在治疗过程中,卡瑞利珠单抗可作为单药治疗,或与化疗(包括紫杉醇类药物、铂类药物、伊立替康、依托泊苷)及靶向治疗(如贝伐珠单抗)联合应用。② 对照组为接受化疗(包括紫杉醇类药物、铂类药物、伊立替康、依托泊苷)±靶向治疗(如贝伐珠单抗)患者。
1.2 观察指标
临床治疗过程中,每2~3个治疗周期通过影像学检查评估疗效,并记录不良事件的发生情况。本研究统计的临床资料包括患者的年龄、病理学类型、组织学分级、初始治疗方式、复发转移部位、复发或转移后的治疗方案,以及随访期间患者的生存状况。本研究疗效评价依据实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST 1.1)进行。观察指标即肿瘤应答分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。同时,计算ORR和疾病控制率(disease control rate,DCR)。具体公式为:ORR=(CR+PR例数)/总例数×100%;DCR=(CR+PR+SD患者的例数)/总例数×100%。此外,无进展生存(progression-free survival,PFS)也作为评估指标,定义为患者从开始治疗到疾病进展或死亡的时间。根据美国国家癌症研究所不良事件通用术语标准(Common Terminology Criteria for Adverse Events version,CTCAE,4.0版)对程序性死亡受体1 (programmed death-1,PD-1)抑制剂治疗过程中不良事件(adverse event,AE)进行分类和记录。
1.3 随访
本研究通过电话与门诊复查相结合的方式进行患者随访,以了解患者的生存状态。对于复发或转移患者,随访以复发或转移之后的首次治疗为起点;对于初治患者,则以一线治疗为起点。随访截至2025年3月,所有患者的中位随访时间为11.5个月(范围为2~46个月)。
1.4 统计学处理
对于连续性定量资料(以x±s表示)的组间对比,根据正态性检验结果,如符合正态分布则采用独立样本t检验,若不符合则采用Wilcoxon秩和检验。分类变量的组间比较采用卡方检验或Fisher精确概率法检验。中位生存时间的计算使用Kaplan-Meier法,组间的生存率比较采用对数秩检验(log-rank test),使用Cox比例风险回归模型进行单因素和多因素分析以探究预后因素并计算风险比(hazard ratio,HR)。P<0.05为差异有统计学意义。所有统计学分析均采用R语言4.0版软件进行。
2 结 果
2.1 患者的基本信息
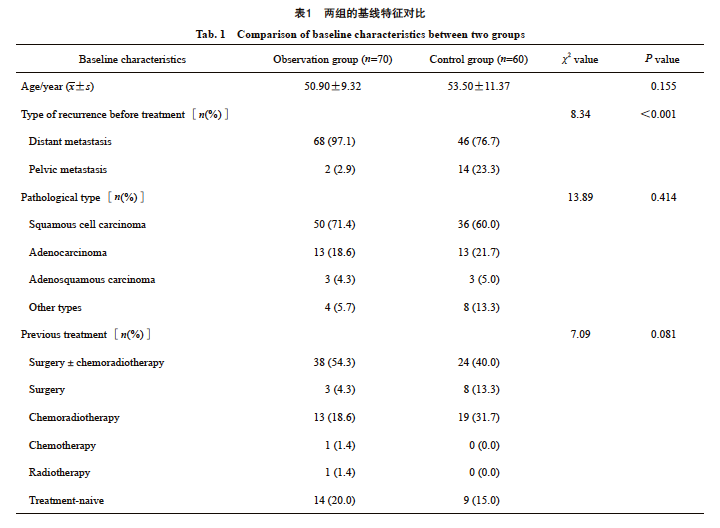
本研究共纳入符合入组标准的130例患者,分为观察组70例,对照组60例。入组患者的纳入标准及排除流程图见图1。两组患者平均年龄接近,分别为50.9岁和54.5岁。病理学类型方面,都是以鳞状细胞癌为主。除既往转移部位外,观察组和对照组的基线特征基本一致(表1),而既往的转移部位分布不同:观察组有68例(97.1%)患者存在远处转移,2例(2.9%)患者存在盆腔复发,对照组则分别为46例(76.7%)和14例(23.3%)。

图1 入组患者的纳入标准及排除流程图
Fig. 1 Patient inclusion and exclusion workflow
2.2 疗效和预后分析
2.2.1 肿瘤缓解情况
在130例患者中,共有8例(6.2%)达到CR,55例(42.3%)为PR,17例(13.1%)为SD,50例(38.5%)出现PD。总体ORR为48.5%,DCR为61.5%(表2)。在观察组(70例患者)中,5例(7.1%)达到了CR,46例(65.7%)达到了PR,5例(7.1%)为SD,14例(20%)出现了PD。观察组的ORR为72.9%,DCR为80.0%,显示出较好的疗效。相比之下,对照组(60例患者)中,CR、PR、SD和PD分别为3例(5.0%)、9例(15.0%)、12例(20.0%)和36例(60.0%)。对照组的ORR为20.0%,DCR为40.0%,显著低于观察组(P<0.001)。
2.2.2 两组患者的PFS情况
观察组和对照组的PFS生存曲线见图2。观察组的生存曲线显示出较好的PFS预后,而对照组患者的PFS预后较差。观察组未达到中位PFS,相比非对照组(中位PFS=7.0个月)具有显著的优势(P<0.001)。
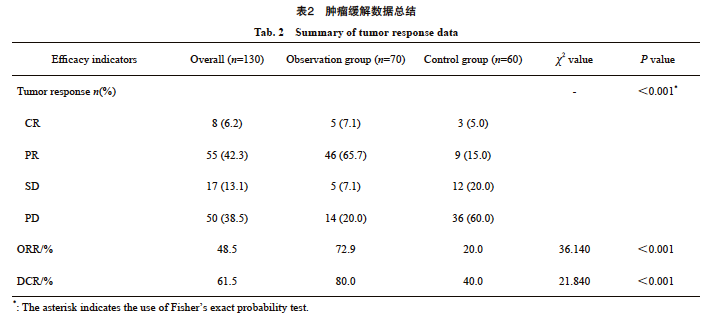
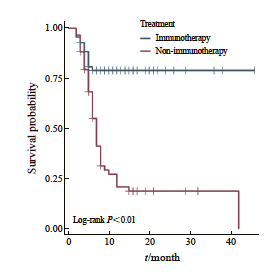
图2 观察组和对照组的PFS生存曲线
Fig. 2 PFS curves of observation group and control group
2.3 卡瑞利珠单抗治疗的安全性
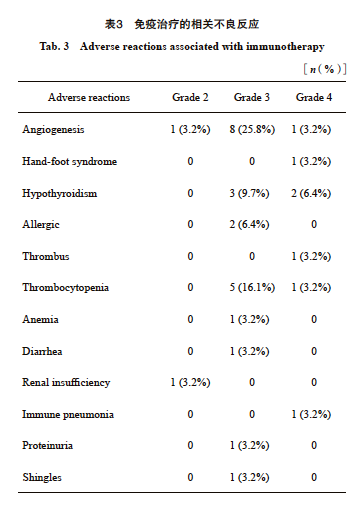
观察组中有31例(31/70,44.3%)患者出现至少1种不良反应,其中血管增生10例(14.3%),血小板减少6例(8.6%),甲状腺功能减退5例(7.1%),过敏2例(2.9%),腹泻2例(2.9%),贫血1例(1.4%),手足综合征1例(1.4%),血栓1例(1.4%)。有29例(41.4%)患者发生≥3级的不良反应,包括血液系统毒性、内分泌系统毒性、过敏、腹泻(表3)。
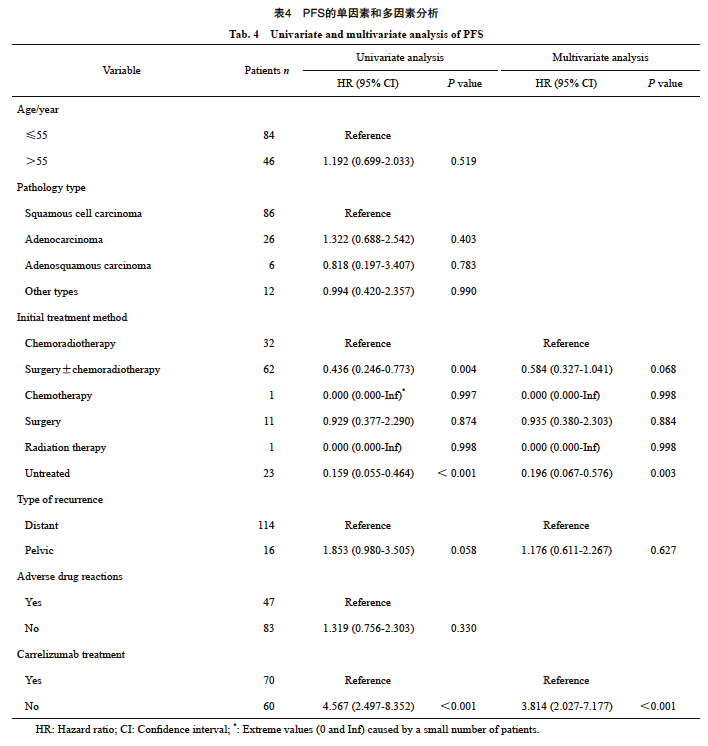
2.4 单因素和多因素分析结果
使用Cox比例风险回归模型分析进行单因素和多因素分析探究预后因素,结果显示患者的年龄与PFS无显著关联(P=0.519)。此外,尽管两组的转移部位基线不均衡,但在单因素分析和多因素分析中均未对PFS产生显著影响。不同病理学类型对PFS的影响不显著,未显示出明显差异。单因素分析(对照组 vs 观察组:HR=4.567,P<0.001)和多因素分析(HR=3.814,P <0.001)的结果显示观察组(使用卡瑞利珠单抗)与更差的PFS显著有关,卡瑞利珠单抗治疗是PFS的独立保护因素(表4)。
3 讨 论
晚期宫颈癌患者的预后仍然较差,近年来治疗方案并未发生实质性改变。然而,随着对疾病与宿主免疫系统相互作用机制的深入研究,免疫疗法的应用成为一种具有前景的新策略[15]。目前,免疫疗法被认为是治疗宫颈癌颇具潜力的干预手段之一,其中以免疫检查点抑制剂为代表的治疗方法备受关注。通过阻断PD-1及其PD-L1的信号转导通路,聚腺苷二磷酸核糖聚合酶抑制剂能够有效地抑制宫颈癌细胞的免疫逃逸,从而实现显著的抗肿瘤效应[16]。本研究显示,免疫治疗显著改善了复发/转移宫颈癌及初治晚期宫颈癌患者的预后,延缓了疾病的进展。通过与化疗、放疗及靶向治疗等传统疗法的协同作用,免疫治疗在短期内即可取得更优的治疗效果。我们对130例患者的治疗情况进行分析,其中部分患者接受了免疫治疗联合化疗与靶向治疗,部分患者接受了化疗联合靶向治疗。此外,对于4例既往因重度骨髓抑制及其他原因导致全身状况较差、不耐受化疗的患者,单用免疫疗法亦取得了良好的疗效。以上结果表明,免疫疗法无论是单独使用还是联合应用均具有显著的临床价值,特别是在复杂病例中,为患者提供了更多的治疗选择和希望。
宫颈癌的发生很大程度上归因于高危型人乳头状瘤病毒(human papillomavirus,HPV)的感染,HPV感染能够触发宿主的细胞介导免疫反应,并有研究[17]表明辅助性T淋巴细胞在HPV感染相关病变的消退中发挥重要作用。然而,在HPV驱动的致癌过程中,HPV阳性细胞通过抑制急性炎症反应及削弱免疫识别能力,成功规避了机体的免疫监视机制。在宫颈癌患者中,PD-L1的高表达已被广泛报道,其范围为35%~ 96%[18-19],这为免疫治疗的应用提供了良好的基础。这一表达水平在正常宫颈组织中几乎不存在,但在宫颈癌患者的肿瘤细胞及肿瘤浸润性T淋巴细胞中均可检测到显著升高[15]。目前,帕博利珠单抗是FDA唯一批准用于宫颈癌的免疫检查点抑制剂,适用于化疗期间或化疗后疾病进展的复发性或转移性PD-L1阳性宫颈癌患者。帕博利珠单抗是一种高选择性、完全人源化的单克隆抗体,通过阻断T淋巴细胞上PD-1受体的活性,抑制PD-L1信号转导通路,增强免疫系统对肿瘤的杀伤作用[20]。帕博利珠单抗的关键临床试验(如KEYNOTE-A18和KEYNOTE-158)纳入的患者并未严格依赖于PD-L1检测[21-22],而阿替利珠单抗在BEATcc临床试验中同样选择了不限定PD-L1表达水平的患者群体[22]。这些研究结果表明,即使不依赖于PD-L1检测,免疫检查点抑制剂在宫颈癌患者中的疗效依然显著,这一发现为临床实践提供了更多的依据。
卡瑞利珠单抗联合阿帕替尼治疗晚期宫颈癌的开放、单臂、Ⅱ期临床研究结果显示PD-L1阳性/PD-L1阴性患者均可从卡瑞利珠单抗联合阿帕替尼方案治疗中获益[23-24]。妇科肿瘤免疫检查点抑制剂临床应用指南也推荐卡瑞利珠单抗联合阿帕替尼治疗既往治疗失败的转移/复发性子宫颈癌患者。本研究在70例患者中,9例进行了免疫治疗相关基因检测[PD-L1、微卫星不稳定(microsatellite instability,MSI)、肿瘤突变负荷(tumor mutation burden,TMB)],其中5例阳性[PD-L1阳性1例;高肿瘤突变负荷(tumor mutational burden high,TMB-H)4例]的患者达到了3例PR,和2例SD;阴性患者4例,阴性患者的3例PR、出现1例PD。尽管有非常明显的疗效,但因为例数太少,无法进行有效的统计学分析。
在本研究中,我们探讨了卡瑞利珠单抗的临床应用价值。卡瑞利珠单抗是中国自主研发的PD-1抑制剂,其作用机制与帕博利珠单抗相似。尽管目前尚未被全面用于宫颈癌治疗,但该药已在晚期肺癌、肝癌、食管癌及霍奇金淋巴瘤等多种恶性肿瘤的治疗中显示出显著的效果。本回顾性分析结果显示,该药在复发、转移及初治晚期宫颈癌患者治疗中的效果显著,采用卡瑞利珠单抗免疫治疗是晚期宫颈癌患者预后的重要保护因素。卡瑞利珠单抗的临床拓展应用为国内恶性肿瘤患者提供了新的治疗选择。此外,由于中国宫颈癌患者数量庞大,疾病负担严重,推广该治疗策略尤为必要。卡瑞利珠单抗的初步疗效数据提示其在晚期宫颈癌中的潜在应用价值,有望成为一种契合临床实际情况的有效治疗手段。本研究的不足之处在于作为回顾性研究、样本量较小,且随访时间较短以至于无法准确评估PFS,因此我们已启动延长随访计划,并将在后续研究中纳入多中心前瞻性队列,以进一步验证其临床疗效。
综上所述,本研究结果表明,卡瑞利珠单抗在复发、转移或初治晚期宫颈癌的治疗中具有一定的临床价值。卡瑞利珠单抗改善有望成为改善复发、转移及初治晚期宫颈癌患者预后、延缓疾病进展、延长患者生存时间的重要治疗措施。
第一作者:
范素梅,学士,主治医师。
通信作者:
程玺,博士,主任医师,教授。
作者贡献声明:
范素梅:调查、实施研究、数据分析、写作和校对。信聪伶:实施研究,采集数据和分析。朱来芳、刘畅:采集数据。徐蕊、周正荣:数据分析。程玺:实施研究、数据分析、论文审校。
[参考文献]
[1] BUSKWOFIE A, DAVID-WEST G, CLARE C A. A review of cervical cancer: incidence and disparities[J]. J Natl Med Assoc, 2020, 112(2): 229-232.
[2] BRAY F, LAVERSANNE M, SUNG H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2024, 74(3): 229-263.
[3] QI J L, LI M L, WANG L J, et al. National and subnational trends in cancer burden in China, 2005-20: an analysis of national mortality surveillance data[J]. Lancet Public Health, 2023, 8(12): e943-e955.
[4] MCCORMACK M, EMINOWICZ G, GALLARDO D, et al. Induction chemotherapy followed by standard chemoradiotherapy versus standard chemoradiotherapy alone in patients with locally advanced cervical cancer (GCIG INTERLACE): an international, multicentre, randomised phase 3 trial[J]. Obstet Gynecol Surv, 2025, 80(3): 162-164.
[5] TANGKANANAN A, THONGKHAO P, JANMUNEE N, et al. Impact of chemotherapy cycles on oncological outcomes in elders with locally advanced cervical cancer treated with concurrent chemoradiotherapy[J]. J Med Imaging Radiat Oncol, 2022, 66(7): 1014-1021.
[6] FERRALL L, LIN K Y, RODEN R B S, et al. Cervical cancer immunotherapy: facts and hopes[J]. Clin Cancer Res, 2021, 27(18): 4953-4973.
[7] GRAU-BEJAR J F, GARCIA-DURAN C, GARCIA-ILLESCAS D, et al. Advances in immunotherapy for cervical cancer[J]. Ther Adv Med Oncol, 2023, 15: 17588359231163836.
[8] COLOMBO N, DUBOT C, LORUSSO D, et al. Pembrolizumab for persistent, recurrent, or metastatic cervical cancer[J]. N Engl J Med, 2021, 385(20): 1856-1867.
[9] TEWARI K S, MONK B J, VERGOTE I, et al. Survival with cemiplimab in recurrent cervical cancer[J]. N Engl J Med, 2022, 386(6): 544-555.
[10] CHEN J, LI K, HAN Y, et al. Neoadjuvant camrelizumab plus chemotherapy in patients with locally advanced cervical cancer (NACI): a prospective, single-arm, phase Ⅱ trial[J]. Ann Oncol, 2022, 33: S804.
[11] CHEN J, HAN Y Y, HU Y J, et al. Neoadjuvant camrelizumab plus chemotherapy for locally advanced cervical cancer (NACI Study): a study protocol of a prospective, single-arm, phase Ⅱ trial[J]. BMJ Open, 2023, 13(5): e067767.
[12] LI K Z, CHEN J, HU Y J, et al. Neoadjuvant chemotherapy plus camrelizumab for locally advanced cervical cancer (NACI study): a multicentre, single-arm, phase 2 trial[J]. Lancet Oncol, 2024, 25(1): 76-85.
[13] LIU Z P, LIU S H, ZHAO H, et al. Pathologically complete response to camrelizumab and apatinib in advanced cervical cancer with PTEN, PIK3CA, MTOR, and ARID1A mutations: a case report[J]. Case Rep Oncol, 2025, 18(1): 480-492.
[14] JIAN X L, ZHANG J J, HUANG Y, et al. Early salvage therapy with anti-PD-1 antibody camrelizumab in patients with advanced cervical cancer: a retrospective study[J]. Clin Transl Oncol, 2025, 27(2): 693-698.
[15] TURINETTO M, VALSECCHI A A, TUNINETTI V, et al. Immunotherapy for cervical cancer: are we ready for prime time?[J]. Int J Mol Sci, 2022, 23(7): 3559.
[16] YADAV A, YADAV S, ALAM M A. Immunotherapies landscape and associated inhibitors for the treatment of cervical cancer[J]. Med Oncol, 2023, 40(11): 328.
[17] GUO L P, HUA K Q. Cervical cancer: emerging immune landscape and treatment[J]. Onco Targets Ther, 2020, 13: 8037-8047.
[18] MEZACHE L, PANICCIA B, NYINAWABERA A, et al. Enhanced expression of PD-L1 in cervical intraepithelial neoplasia and cervical cancers[J]. Mod Pathol, 2015, 28(12): 1594-1602.
[19] ENWERE E K, KORNAGA E N, DEAN M, et al. Expression of PD-L1 and presence of CD8-positive T cells in pre-treatment specimens of locally advanced cervical cancer[J]. Mod Pathol, 2017, 30(4): 577-586.
[20] MAURICIO D, ZEYBEK B, TYMON-ROSARIO J, et al. Immunotherapy in cervical cancer[J]. Curr Oncol Rep, 2021, 23(6): 61.
[21] CHUNG H C, ROS W, DELORD J P, et al. Efficacy and safety of pembrolizumab in previously treated advanced cervical cancer: results from the phase Ⅱ KEYNOTE-158 study[J]. J Clin Oncol, 2019, 37(17): 1470-1478.
[22] LORUSSO D, XIANG Y, HASEGAWA K, et al. Pembrolizumab or placebo with chemoradiotherapy followed by pembrolizumab or placebo for newly diagnosed, high-risk, locally advanced cervical cancer (ENGOT-cx11/GOG 3047/KEYNOTE-A18): overall survival results from a randomised, double-blind, placebo-controlled, phase 3 trial[J]. Lancet, 2024, 404(10460): 1321-1332.
[23] LAN C Y, SHEN J X, WANG Y, et al. Camrelizumab plus apatinib in patients with advanced cervical cancer (CLAP): a multicenter, open-label, single-arm, phase Ⅱ trial[J]. J Clin Oncol, 2020, 38(34): 4095-4106.
[24] LAN C Y, LU H W, ZHOU L, et al. Long-term survival outcomes and immune checkpoint inhibitor retreatment in patients with advanced cervical cancer treated with camrelizumab plus apatinib in the phase Ⅱ CLAP study[J]. Cancer Commun (Lond), 2024, 44(6): 654-669.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)