首页 > 医疗资讯/ 正文
急性髓系白血病(AML)是一种侵袭性强的血液癌症,以未成熟髓系细胞的不受控增殖为特征,导致造血功能受损和骨髓功能障碍。AML恶性细胞上的抗原表达变化多端,给CAR-T疗法的选择带来了挑战;此外抗原在白血病和非白血病造血细胞上均有表达,从而引发了对潜在骨髓抑制的担忧。
已有多项临床试验探索了靶向多种抗原的CAR-T疗法在AML中的应用,初步结果表明,靶向广泛表达的抗原(如CD123、CD38、CLL-1、NKG2D-L或CD33)或较不常见的抗原(如CD7和CD19)可能会使这一难以治疗的人群产生临床反应。但由于AML的复杂性,目前还没有找到最佳的抗原组合,以确保疗效同时最小化造血毒性,也没有找到预测反应的生物标志物。且患者的治疗反应具有异质性,如果不通过异体造血干细胞移植(allo-HSCT)进行巩固治疗,缓解往往较为短暂。
总的来说,AML的CAR-T疗法仍处于发展的早期阶段,面临着显著的疗效和安全性挑战,未来的研究需要解决这些挑战,以便将这种有前景的治疗方法推广到那些医疗需求尚未得到满足的人群中。
CAR-T疗法在AML治疗中面临的主要挑战(包括生产阶段以及不同临床阶段)及可能的解决方案如下:
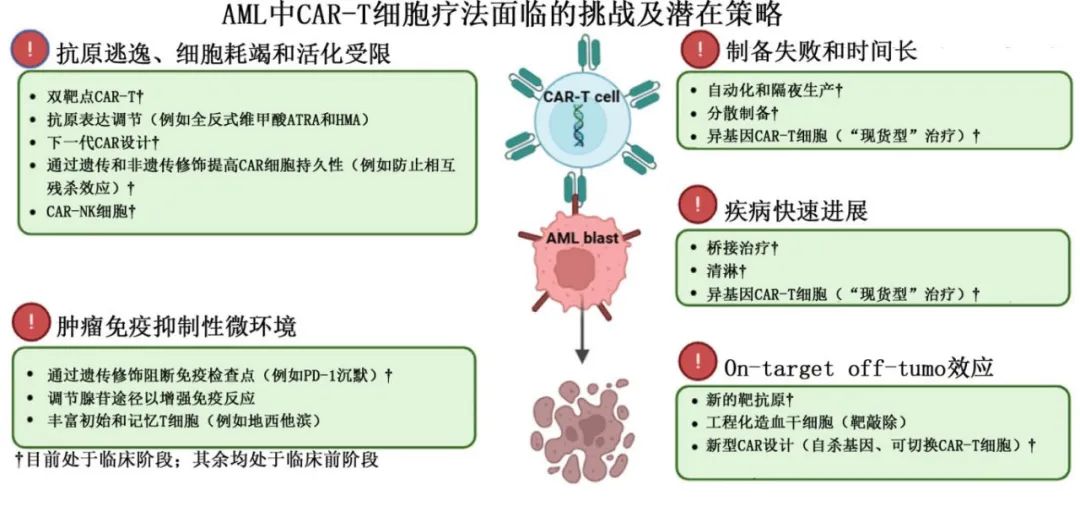
CAR-T细胞构建设计和应用在AML中的挑战
抗原逃逸:患者在接受多周期化疗后,靶抗原表达可能减少,降低CAR-T的有效性。为解决这一问题而开发了多种策略,包括双靶点CAR-T细胞,这些细胞能同时识别两种不同的抗原,减少肿瘤逃避的风险。
CAR-T细胞的持久性和功能性有限:新一代CAR-T构建旨在优化细胞内信号传导,增强抗肿瘤效果。第三代CAR-T细胞包含两个共刺激域,可增强活化,第四代CAR-T细胞(也称为“装甲CAR”)包含额外的转录因子,可增强免疫反应,第五代CAR-T细胞整合了IL-2Rβ域,激活JAK/STAT通路,改善T细胞增殖和持久性。
CAR-NK细胞:作为一种有前景的CAR-T细胞替代品,CAR-NK细胞具有天然的细胞毒性和高分泌白介素的能力,特别是干扰素γ(IFN-γ)。与CAR-T细胞不同,CAR-NK细胞可以异体使用而不引起GvHD,因为它们针对的是下调人类白细胞抗原I(HLA-I)表达的AML细胞。然而,CAR-NK细胞的半衰期短和制造复杂性是需要解决的挑战。
肿瘤微环境:AML中的肿瘤微环境对CAR-T细胞的疗效构成挑战,主要是由于髓系来源的抑制细胞和调节性T淋巴细胞(Tregs)的积累,这些细胞阻碍T细胞的激活。为克服这一挑战,正在探索将CAR-T疗法与免疫检查点阻断剂(如PD-L1或CTLA-4抑制剂)联合使用,以提高CAR-T的持久性和疗效。
制备失败和延误
AML主要影响老年患者,这些患者通常接受过多种治疗方案,这可能损害T细胞功能和CAR-T制造。此外,外周血中原始细胞的存在会影响T细胞质量,导致CAR-T生产延迟和失败。
有的临床试验采用了先进的非病毒基因传递系统和快速的分散制造过程,实现了在医疗中心的隔夜CAR-T细胞生产,使用患者的自体T细胞。这种方法不仅减少了等待时间,还简化了物流,特别适合紧急AML治疗。
使用健康供者或先前移植供者的异基因CAR-T细胞也是一种有前景的方法,可消除了修改患者自身T细胞的需要,简化制造过程,并将CAR-T疗法作为一种“现货型”的治疗方法。然而,这种方法与自体CAR-T疗法相比有显著限制,特别是需要进行基因修饰以防止GvHD和异基因排斥。
桥接治疗
AML的快速进展和高感染风险与当前2至6周的制造间隔形成对比,强调了在CAR-T治疗前控制疾病的有效桥接策略的迫切需要。
尽管大多数试验没有详细说明桥接化疗,但有数据表明,桥接化疗可能在减少肿瘤负荷方面有益。然而与ALL不同,R/R AML对低剂量细胞毒方案的反应较低,限制了这种方法的潜力。
清淋化疗
清淋在促进CAR-T细胞扩增和植入中起着关键作用,通过减少内源性T细胞和免疫抑制细胞(如Tregs)来实现。
尽管一些试验探索了省略清淋的可能性,但AML的初步证据支持使用清淋。例如,在一项比较有和没有清淋(使用环磷酰胺+氟达拉滨)的两个队列的试验中,接受清淋的患者显示出更高的CAR-T扩增和完全缓解率。
CAR-T相关毒性
与CAR-T疗法相关的最常见不良事件是细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)。尽管报告了高CRS发生率,但通过使用托珠单抗和皮质类固醇可以控制。ICANS也经常发生,但通常等级较低。
另一个令人担忧的毒性是骨髓毒性,由于许多CAR-T目标抗原在造血干细胞(HSC)上的表达,增加感染和出血并发症的风险。基因编辑策略,如CD33去除或CD45基因敲除,理论上可以通过从HSC中消除目标抗原来预防这种毒性,但尚未在人类试验中进行测试。
正在开发一些安全机制,如自杀基因和可切换CAR-T细胞,以控制CAR-T活性。例如,UniCAR-T-CD123是一种在临床试验中测试的可切换CAR-T。这种产品采用了一个模块化系统,包含一个针对CD123的靶向模块(TM123),允许可逆的CAR-T激活。只有在CAR-T细胞和TM同时存在的情况下才会有抗肿瘤活性,而TM由于其短半衰期可以迅速清除。在1期试验中,UniCAR-T-CD123显示出良好的安全性,所有3级CRS和2级ICANS在中断TM给药后24小时内得到解决。重要的是,没有观察到长期骨髓抑制或需要后续allo-HSCT的情况。
异基因CAR-T细胞是现货型产品,可避免自体T细胞问题,但存在GvHD风险。解决手段包括基因编辑敲除T细胞受体、敲除CD52以及配合alemtuzumab清淋,临床经验仍在积累。
有限的疗效和allo-HSCT的作用
在R/R AML中,CAR-T疗法显示出中等的初步疗效,不同研究之间的反应率存在显著差异。尽管存在显著的试验异质性和有限的样本量,早期研究表明,针对CD123、CLL-1和CD7的治疗可能诱导更高的完全缓解率,而针对NKG2D-L的疗法显示出适度的疗效。然而,反应通常较为端在,多数患者最终会经历进展或复发。
由于反应的短暂性和潜在的骨髓抑制,CAR-T疗法通常作为allo-HSCT的桥接策略在许多临床试验中使用。报道显示,单独使用CAR-T疗法只能实现短暂的MRD阴性缓解(3.3-4.5个月),而接受后续allo-HSCT或局部放疗的患者显示出延长的生存期,范围为10至26个月,表明在CAR-T疗法后进行移植或其他形式的巩固可能是维持长期缓解的必要条件。
参考文献
Lloret-Madrid P, Chorão P, Guerreiro M, Montesinos P. CAR-T Cell Therapy for Acute Myeloid Leukemia: Where Do We Stand Now? Current Oncology. 2025; 32(6):322. https://doi.org/10.3390/curroncol32060322
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)