首页 > 医疗资讯/ 正文
原发性胆汁性胆管炎(PBC)是一种以肝脏小胆管为主要靶器官的慢性进展性自身免疫性胆汁淤积性疾病[1]。首都医科大学附属北京友谊医院贾继东教授作“原发性胆汁性胆管炎的诊断与治疗——有时容易,有时难”学术分享,肝胆相照平台特将精华内容整理成文,供临床医生参考。
一、PBC的流行病学与发病机制
自身免疫性肝脏疾病(AILD)主要包括以肝细胞损害为主的自身免疫性肝炎(AIH)、以肝内小叶间胆管损害为主的原发性胆汁性胆管炎(PBC)、以大胆管损害为主的原发性硬化性胆管炎(PSC)和IgG4相关胆管炎[2]。
其中,PBC作为少见疾病,呈全球性分布,可发生于所有种族和民族。荟萃分析显示,PBC发病率和患病率在全球均呈上升趋势,年发病率为0.23/10万~5.31/10万,患病率为1.91/10万~40.2/10万,以北美和北欧国家最高[3]。我国尚缺乏基于人群的PBC流行病学数据[4]。一项荟萃分析估算出中国的PBC患病率为20.5/10万,在亚太地区位居第二位,仅次于日本[5]。
与此同时,PBC又属于少见病中的“常见病”。
近期,马雄教授作为共同第一者与日本及美国学者联合在国际顶级医学期刊《柳叶刀》(Lancet)发表综述文章《原发性胆汁性胆管炎》(Primary biliary cholangitis)。日本京都大学医学院的Atsushi Tanaka教授为本文的第一作者兼通讯作者,日本福岛医科大学的Atsushi Takahashi和美国贝勒医科大学的John M Vierling教授也参与了该文的撰写。该综述[6]涵盖了PBC的流行病学、发病机制、临床诊断、症状与并发症、治疗方案和预后等诸多方面,更新了该疾病的最新临床处理和发病机制进展。其中,在发病机制层面,文章深入探讨了遗传学、性别、环境、免疫以及胆管上皮细胞在疾病发病机制中的关键作用及临床转化价值。
二、PBC的临床特点与诊断标准
在血生物化学检查方面,PBC以碱性磷酸酶(ALP)和/或γ-谷氨酰转移酶(GGT)明显升高为主要特征,可同时伴有丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)的轻度至中度升高[4]。在免疫学检查方面,血清抗线粒体抗体(AMAs)是诊断PBC的特异性标志物,尤其是AMA-M2亚型,诊断PBC的敏感度和特异度高达90%~95%。在 AMAs阴性时,抗-gp210和抗-sp100对PBC具有高度特异性[4]。在病理特征方面,PBC的病理学特点是累及小叶间胆管的慢性非化脓性破坏性胆管炎[4]。
PBC的诊断需依据生物化学、免疫学、影像学及组织学检查进行综合评估。满足以下3条标准中的2条即可诊断[4]:(1)存在胆汁淤积的生物化学证据(主要是ALP和GGT升高),且影像学检查排除了肝外或肝内大胆管梗阻;(2)AMAs/AMA-M2阳性,或其他PBC特异性自身抗体(抗gp210抗体、抗sp100抗体)阳性;(3)组织学上有非化脓性破坏性胆管炎和小胆管破坏的证据。
根据上述标准,PBC的诊断并不复杂,但难就难在,AMA、抗-gp210或-sp100阴性并不不能完全排除PBC;因此,推荐对其他原因不明的胆汁淤积性肝生化检查且AMA、抗gp210或抗sp100阴性的患者进行肝活检,以明确PBC的诊断[7]。
▼ 临床实战
• 一位67岁女性,发现脾大伴血小板减少3年,ALT/AST:19/23,ALP/GGT:82/29U/L,AMA 1:160,AMA-M2:3.19U/ml,gp210:26.33 U/ml,lgM:178 mg/dl。
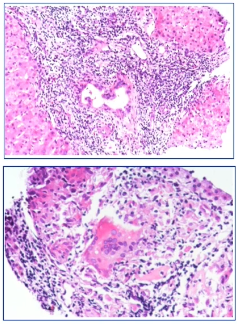
• 病理检查:汇管区可见明显炎性细胞浸润,旺炽性胆管炎。
• 食管胃底静脉曲张;HVPG 14mmHg。
• 诊断:PBC。
• 启示:AMA阴性、ALP正常也不能完全除外PBC。
事实上,AMA在PBC诊断中的地位奠定于1996年发表于柳叶刀的一项研究[8]。在这一研究中,从首次发现AMA阳性到最后一次随访复查,存活患者的中位随访时间为17年,研究中83%AMA阳性患者经过随访后进展为PBC,故而认为AMA是PBC极早期的标志物。后续包括以色列、中国、瑞典在内的研究也进一步证实了AMA在PBC中的诊断价值,约60%-80%的AMA阳性、ALP正常者经病理检查可确诊为PBC[9-11]。
然而,进一步的研究发现,病理符合PBC者,AMA滴度更高,ALP在正常高限更高,AMA阳性但低水平升高的指导意义有限[10-11]。但是,这几个抗体阳性者也不一定都是PBC。
▼ 临床实战
• 病例1:患者女,37岁,体检AMA/AMA-M2阳性,AMA 1:160,AMA-M2:134U/ml,ALP、GGT正常,2020年友谊医院肝活检,未见PBC。
• 病例2:患者女,36岁,2019年因流产发现AMA-M2阳性,2020年1月外院AMA-M2+++,ALP、GGT正常,2021年友谊医院肝活检,未见PBC。
• 启示:单纯AMA阳性不一定是PBC。
一项奥地利单中心研究[12]对AMA阳性者随访平均5.8年,发现PBC发生率仅为10.2%,换言之,大多数AMA阳性者并未发生PBC。
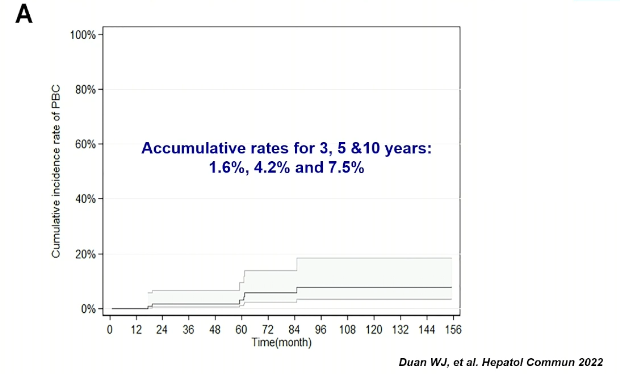
另一项法国多中心研究[13]中,66例AMA阳性、ALP正常且无肝硬化迹象者,PBC的5年累积发病率为16%。北京友谊医院数据[14]显示,139例单纯AMA阳性者,PBC年发生率<1%。单纯AMA阳性者3年、5年、10年的PBC发生率为1.6%、4.2%和7.5%。
此外,一项欧洲研究观察了有PBC家族史的人群PBC的发生率。在这一研究[15]中,对476名PBC一级亲属随访8年,PBC发生率在AMA阳性者中为4%、阴性者中为0.4%。换言之,即使患者有PBC家族史,即使AMA阳性,如果ALP、γ-GGT正常,也不一定是PBC。
在临床上,AMA除了可见于PBC患者,还可见于其他疾病患者。有研究[16]发现,AIH患者中AMA阳性率约5%~34%,故而临床不能轻易诊断AIH-PBC重叠综合征。而且,AMA在急性肝衰竭时阳性率也会升高,但AMA滴度会随时间而逐渐下降[17]。故而对于此类患者,需要动态观察。还有研究[18]发现,在结缔组织病患者中,AMA阳性率为8%~30%。有研究纳入287例系统性红斑狼疮(SLE)患者,在这些患者中,如根据PBC诊断标准来判断,有6例患者可诊断为PBC,但最后经肝活检证实,仅有1例患者可确诊为PBC。此外,AMA阳性还可见于健康人群(约0.1-0.8%)[19]。
▼ 临床实战
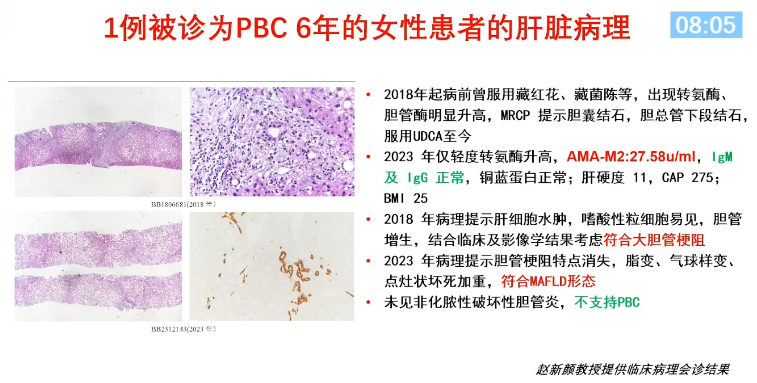
基于此,2022年APASL PBC指南明确指出:仅AMA阳性不足以诊断为PBC。血清肝脏检查正常的AMA阳性患者应每年进行一次生化再评估,以确定是否存在肝病。对特定患者(如IgM升高、AMA高滴度或ALP接近ULN)可考虑进行肝活检,以识别临床前PBC[7]。
三、PBC的治疗
▼ PBC的治疗主要是“三板斧”:
第一板斧:熊去氧胆酸(UDCA)。13~15 mg/kg UDCA是治疗PBC的一线药物[1]。UDCA剂量选择非常重要,13~15 mg/kg优于5~7 mg/kg小剂量,也优于23~ 25 mg/kg 大剂量。如患者同时还服用消胆胺等胆汁酸螯合剂,需提前1h或延后4h服用,以免影响UDCA药效。对肝功能异常和肾功能不全的PBC患者,无需调整UDCA的剂量[1]。
第二板斧:奥贝胆酸。对UDCA治疗应答欠佳的PBC患者,FDA批准的二线治疗药物为6-乙基鹅去氧胆酸——奥贝胆酸[1],目前国内正在开展相关临床试验,可能在明年于我国获批上市。
第三板斧:贝特类药物。近年来国内外研究发现,贝特类降脂药如非诺贝特、苯扎贝特等,有改善UDCA治疗反应不佳的PBC患者生化指标的疗效[1]。
此外,PBC领域的新药研发也取得了一定的进展,其中以PPAR激动剂、IBAT抑制剂进展较快。
进展1:2024年6月10日FAD、9月EMA相继批准埃拉菲布拉诺(Elafibranor)治疗PBC。埃拉菲布拉诺是一种PPAR α/δ激动剂,相比于安慰剂,可显著改善胆汁淤积的相关生化指标[20]。
进展2:2024年8月24日,FDA批准PPAR δ激动剂司拉德帕(seladelpar)治疗PBC[21]。在3期试验[21]中,使用司拉德帕的PBC患者生化反应和ALT复常的百分比显著高于安慰剂人群。司拉德帕还显著减少了基线时患有中度至重度瘙痒的患者的瘙痒。两组不良事件的发生率和严重程度相似。
进展3:Linerixibat是一种IBAT小分子抑制剂,以口服片剂形式给药。它通过阻断小肠中胆汁酸的吸收,减少循环中瘙痒性胆汁酸,从而达到缓解瘙痒的目的。针对PBC胆汁淤积性瘙痒患者进行的双盲、随机、安慰剂对照2b期研究[22],评估了linerixibat的剂量反应和耐受性。结果显示,linerixibat可显著改善患者的瘙痒程度,尤其是在每日两次40 mg的中度至重度瘙痒症患者亚组中。这表明使用linerixibat靶向胆汁酸再摄取,可以减轻PBC胆汁淤积性瘙痒患者的病情。
总结


【参考文献】
[1]张奉春,王立,帅宗文,等. 原发性胆汁性胆管炎诊疗规范(2021). 中华内科杂志,2021,60(08):709-715.
[2]Hirschfield G M, Heathcote E J, Gershwin M E. Pathogenesis of cholestatic liver disease and therapeutic approaches[J]. Gastroenterology, 2010, 139(5): 1481-1496.
[3] Lv T, Chen S, Li M, et al. Regional variation and temporal trend of primary biliary cholangitis epidemiology: a systematic review and metaanalysis[J]. J Gastroenterol Hepatol, 2021, 36(6): 14231434.
[4]中华医学会肝病学分会. 原发性胆汁性胆管炎的诊断和治疗指南(2021). 中华肝脏病杂志,2022,30(03):264-275.
[5] Zeng N, Duan W, Chen S, et al. Epidemiology and clinical course of primary biliary cholangitis in the AsiaPacific region: a systematic review and metaanalysis[J]. Hepatol Int, 2019, 13(6): 788799.
[6]Tanaka A, Ma X, Takahashi A, et al. Primary biliary cholangitis[J]. The Lancet, 2024, 404(10457): 1053-1066.
[7] You H, Ma X, Efe C, et al. APASL clinical practice guidance:the diagnosis and management of patients with primary biliary cholangitis[J]. Hepatol Int, 2022, in press.
[8]Metcalf J V, Mitchison H C, Palmer J M, et al. Natural history of early primary biliary cirrhosis[J]. The Lancet, 1996, 348(9039): 1399-1402.
[9]Berdichevski T, Cohen‐Ezra O, Pappo O, et al. Positive antimitochondrial antibody but normal serum alkaline phosphatase levels: Could it be primary biliary cholangitis?[J]. Hepatology Research, 2017, 47(8): 742-746.
[10]Sun C, Xiao X, Yan L I, et al. Histologically proven AMA positive primary biliary cholangitis but normal serum alkaline phosphatase: Is alkaline phosphatase truly a surrogate marker?[J]. Journal of autoimmunity, 2019, 99: 33-38.
[11]Beretta-Piccoli B T, Stirnimann G, Mertens J, et al. Primary biliary cholangitis with normal alkaline phosphatase: a neglected clinical entity challenging current guidelines[J]. Journal of autoimmunity, 2021, 116: 102578.
[12]Zandanell S, Strasser M, Feldman A, et al. Low rate of new‐onset primary biliary cholangitis in a cohort of anti‐mitochondrial antibody‐positive subjects over six years of follow‐up[J]. Journal of Internal Medicine, 2020, 287(4): 395-404.
[13]Dahlqvist G, Gaouar F, Carrat F, et al. Large‐scale characterization study of patients with antimitochondrial antibodies but nonestablished primary biliary cholangitis[J]. Hepatology, 2017, 65(1): 152-163.
[14]Duan WJ,et al.Hepatol Commun 2022
[15]Gulamhusein A F, Juran B D, Atkinson E J, et al. Low incidence of primary biliary cirrhosis (PBC) in the first‐degree relatives of PBC probands after 8 years of follow‐up[J]. Liver International, 2016, 36(9): 1378-1382.
[16]Muratori P, Efe C, Muratori L, et al. Clinical implications of antimitochondrial antibody seropositivity in autoimmune hepatitis: a multicentre study[J]. European Journal of Gastroenterology & Hepatology, 2017, 29(7): 777-780.
[17]Leung P S C, Rossaro L, Davis P A, et al. Antimitochondrial antibodies in acute liver failure: implications for primary biliary cirrhosis[J]. Hepatology, 2007, 46(5): 1436-1442.
[18]Zurgil N, Bakimer R, Moutsopoulos H M, et al. Antimitochondrial (pyruvate dehydrogenase) autoantibodies in autoimmune rheumatic diseases[J]. Journal of clinical immunology, 1992, 12: 201-209.
[19]Chen B H, ZHANG W, ZHAO L Y, et al. Screening of anti-mitochondrial antibody subtype M2 in residents at least 18 years of age in an urban district of Shanghai, China[J]. European Review for Medical & Pharmacological Sciences, 2016, 20(10).
[20]Kowdley K V, Bowlus C L, Levy C, et al. Efficacy and safety of elafibranor in primary biliary cholangitis[J]. New England Journal of Medicine, 2024, 390(9): 795-805.
[21]Hirschfield G M, Bowlus C L, Mayo M J, et al. A phase 3 trial of seladelpar in primary biliary cholangitis[J]. New England Journal of Medicine, 2024, 390(9): 783-794.
[22]Levy C, Kendrick S, Bowlus C L, et al. GLIMMER: a randomized phase 2b dose-ranging trial of linerixibat in primary biliary cholangitis patients with pruritus[J]. Clinical gastroenterology and hepatology, 2023, 21(7): 1902-1912. e13.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)