首页 > 医疗资讯/ 正文
研究亮点
- 首次在中国RAS/BRAF野生型转移性结直肠癌(mCRC)患者中,通过3期随机临床试验验证了抗EGFR单克隆抗体cetuximab β(CMAB009)联合FOLFIRI方案的疗效与安全性。
- Cetuximab β加FOLFIRI显著延长了患者的无进展生存期(PFS)和总体生存期(OS),且客观缓解率(ORR)大幅提升,安全性良好且未出现新的安全信号。
- 研究证实,经基因型严格筛选的中国mCRC患者群体,cetuximab β联合化疗是优化一线治疗的新选择,尤其对左侧肿瘤患者效果更显著。
结直肠癌(CRC)作为中国第二大常见恶性肿瘤,转移性结直肠癌(mCRC)患者的长期生存率依赖于有效的系统治疗。抗EGFR治疗联合化疗已被确立为RAS/BRAF野生型mCRC的一线标准。本文报道了在《Signal Transduction and Targeted Therapy》期刊发表的一项多中心、随机、对照的3期临床试验(注册号:NCT03206151),旨在评估新型抗EGFR单抗——cetuximab β(CMAB009)联合FOLFIRI方案与FOLFIRI单药方案的疗效与安全性。该研究纳入505例中国RAS/BRAF野生型mCRC患者,结果显示cetuximab β联合FOLFIRI相比FOLFIRI单药显著改善患者预后,数据充分支持该方案作为中国mCRC患者的一线治疗。

近年来,转移性结直肠癌的治疗凭借精准医学理念获得长足进展。RAS、BRAF基因突变及微卫星不稳定性(MSI)成为重要预测及预后生物标志物。EGFR单克隆抗体联合化疗是RAS/BRAF野生型mCRC患者推荐的一线治疗方案。国外多项临床试验,如CRYSTAL研究,证实cetuximab加FOLFIRI方案能改善PFS和OS。
然而,国产的cetuximab β作为一种基于CHO细胞表达系统的优化型抗EGFR抗体,因其降低了过敏反应相关的糖基化结构(galactose-α-1,3-galactose)的表达,理论上能改善安全性,尚缺乏国内大规模一线疗效和安全性的数据支持。本研究填补了中国境内这一空白,帮助明确cetuximab β联合FOLFIRI对中国mCRC患者的临床价值。
本研究为开放标签、多中心、随机、平行对照3期临床试验,纳入经中央实验室确认为RAS/BRAF野生型、不可切除转移性结直肠癌患者。患者按照1:1比例随机分配至cetuximab β联合FOLFIRI组与FOLFIRI单药组。治疗方案周期为14天/周期,cetuximab β按负荷剂量400 mg/m²,后续每周250 mg/m²静脉给药。所有患者均接受标准FOLFIRI方案。
主要终点为无进展生存期(PFS),通过独立盲评委员会(BIRC)评估;次要终点涉及总体生存期(OS)、客观缓解率(ORR)、疾病控制率(DCR)、转移灶手术率及R0切除率,以及安全性评估。采用Kaplan-Meier方法估计生存数据,Cox比例风险模型计算风险比,ORR和DCR通过Cochran-Mantel-Haenszel检验比较,显著性水平为双侧α=0.05。
主要研究结果
1,患者基本特征
研究共筛查1440例患者,最终纳入505例RAS/BRAF野生型mCRC患者(cetuximab β + FOLFIRI组257例,FOLFIRI组248例)。两组基线特征匹配良好,男性占约70%,中位年龄为57-58岁。约86%的患者肿瘤位于结肠左侧,12%右侧。
2,治疗暴露情况
cetuximab β联合组中,57.2%患者用药时间超过6个月,19.8%超过12个月。两组化疗药物(伊立替康和5-FU)剂量强度相近,保证了治疗暴露的一致性。
3,疗效分析

注:PFS及ORR均经独立盲评委员会评估
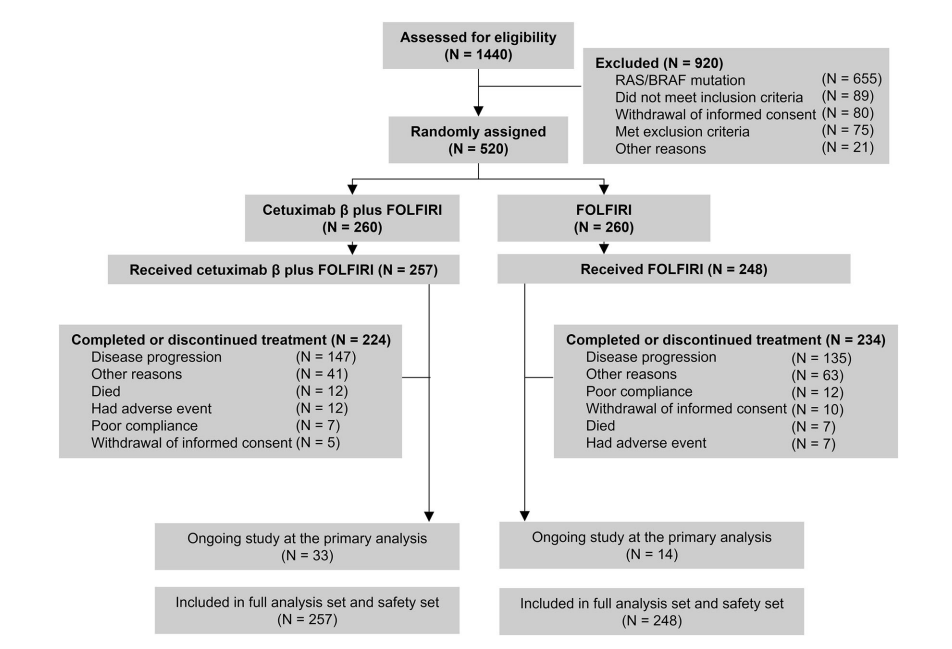
图1 患者处置流程图
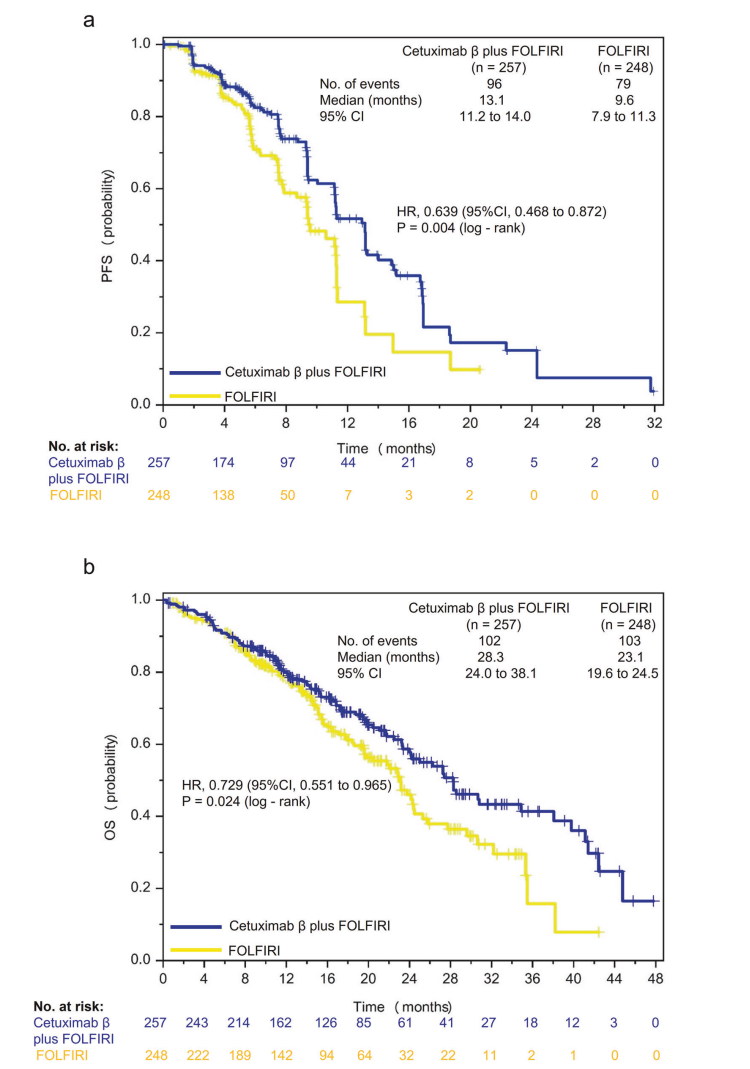
图2 Kaplan-Meier生存曲线图:a. BIRC评估的PFS;b. OS
4,亚组分析
对肿瘤原发部位进行亚组分析显示,左侧肿瘤患者中cetuximab β联合组的PFS优势更明显(13.2 vs. 9.6个月,HR=0.546,P < 0.01),而右侧肿瘤患者则无显著差异。
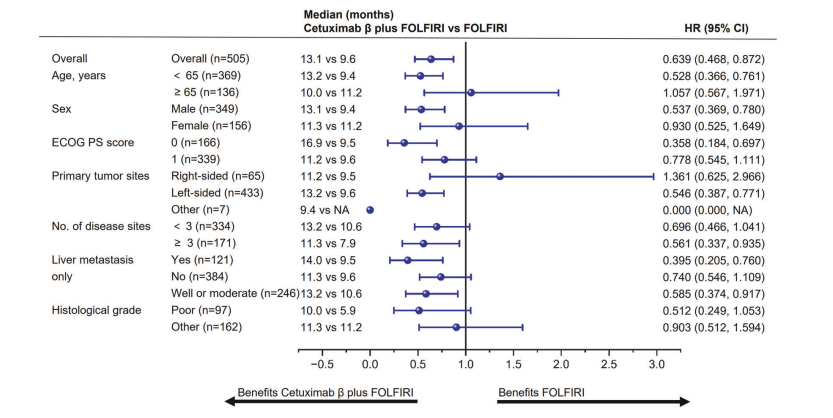
图3 BIRC评估的PFS亚组分析森林图
5,安全性评价
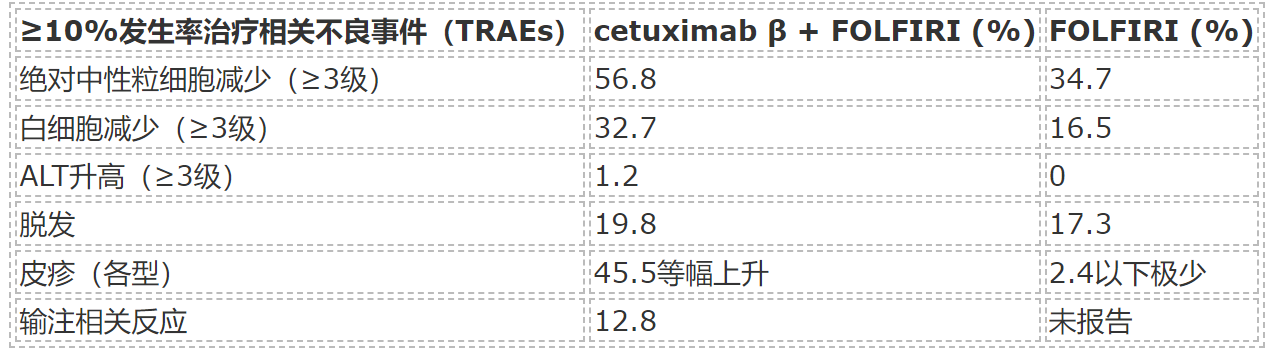
cetuximab β联合组≥3级治疗相关不良事件发病率为78.6%,FOLFIRI组为57.3%。主要≥3级不良反应包括:
- 骨髓抑制相关:绝对中性粒细胞减少(56.8% vs. 34.7%)
- 皮肤相关反应:cetuximab β组高发皮疹、痤疮样皮炎及掌跖脓疱症,但无4级皮肤毒性报告
- 肝功能异常、低镁血症、体重减轻等更多见于联合组
输注相关反应发生率为12.8%,无严重过敏反应。抗药性抗体(ADA)检测显示5.4%的患者出现ADA阳性,NAb阳性率为0%,对安全性无明显影响。
研究价值与意义
本研究是首个针对中国RAS/BRAF野生型mCRC患者使用cetuximab β联合FOLFIRI的一线治疗3期随机对照试验,系统验证该方案较单纯化疗在改善无进展生存期与整体生存期方面的优势。更重要的是,cetuximab β通过CHO细胞生产工艺降低了Gal(α-1,3)Gal结构,显著减少了治疗中严重过敏反应的风险,提升患者用药的安全耐受性。
此外,转移灶的手术切除率也明显提升,提示该方案有望提高某些患者的转治为可手术状态,进一步延长生存获益。亚组分析明确了治疗优势主要集中在左侧肿瘤患者,对于制定临床个体化治疗方案提供依据。
当前mCRC治疗正处于生物标志物驱动和靶向治疗快速发展阶段,在精准分型指导下,引入更多优化的抗EGFR抗体如cetuximab β,为中国患者提供更安全、有效的一线治疗新选项,改善患者的长期生存与生活质量具有重要意义。
未来,结合KRAS G12C等特定突变的新型靶向药物联合EGFR抗体的研究也将进一步拓展cetuximab β的适应症和应用范围。
梅斯小编点评
本项研究顺应了精准医学发展趋势,不仅填补了中国mCRC患者使用国产抗EGFR单抗cetuximab β的临床证据空白,还为优化一线治疗方案提供了强有力的循证支持。研究设计严谨,样本量充足,随访时间合理,主要终点达成显著性统计学差异,数据可靠。
尤其值得关注的是cetuximab β的改良工艺有效降低了过敏风险,这对于提升患者治疗依从性和安全性至关重要。未来,如何进一步比较cetuximab β与国际上其他EGFR抗体如cetuximab原研药、panitumumab的疗效差异,以及与抗VEGF药物联合治疗的比较研究,将为临床实践提供更全面的指导。
同时,随着免疫检查点抑制剂(如pembrolizumab)在部分mCRC患者中的应用日益广泛,本研究也提示需要探索与免疫治疗的联合或序贯策略,力图实现最大疗效和患者获益。
原始出处
Shi Y, Ba Y, Wang J, et al. First-line treatment of anti-EGFR monoclonal antibody cetuximab β plus FOLFIRI versus FOLFIRI alone in Chinese patients with RAS/BRAF wild-type metastatic colorectal cancer: a randomized, phase 3 trial. Signal Transduct Target Ther. 2025;10(147). https://doi.org/10.1038/s41392-025-02229-4
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)