首页 > 医疗资讯/ 正文
亚盛医药(纳斯达克代码:AAPG;香港联交所代码:6855)宣布,公司自主研发的新型Bcl-2选择性抑制剂利生妥®(通用名:利沙托克拉;研发代码:APG-2575)获中国国家药品监督管理局(NMPA)附条件批准上市,用于既往经过至少包含布鲁顿酪氨酸激酶(BTK)抑制剂在内的一种系统治疗的成人慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)患者。
这意味着国产原创利生妥®成为中国首个上市用于治疗CLL/SLL的Bcl-2抑制剂,也是全球第二个上市的Bcl-2抑制剂。
利生妥®是亚盛医药自主研发的新型口服Bcl-2选择性抑制剂,通过选择性抑制Bcl-2蛋白,恢复肿瘤细胞的正常凋亡过程,从而达到治疗肿瘤的目的。该产品在多种血液肿瘤和实体瘤治疗领域具备广阔的治疗前景,特别在CLL/SLL患者中具有单药和联合治疗潜力。利生妥®是继耐立克®之后亚盛医药第二个获批上市、进入商业化阶段的原创新药,该产品的获批不仅彰显了亚盛医药全球创新研发的领先实力,更是中国药企跻身全球创新舞台的又一标志性里程碑。
利生妥®此次获批上市,是基于一项治疗复发或难治性CLL/SLL的关键注册II期临床研究(APG2575CC201)结果,其主要终点指标为总缓解率(ORR)。对于BTK抑制剂和/或免疫化疗治疗失败的病人,利生妥®展现出优异疗效,ORR达到预设的研究终点。同时,利生妥®安全性表现突出,研究中未发生肿瘤溶解综合征(TLS)副作用,血液学毒性发生率低且程度可控,非血液学毒性发生率低且多为1-2级。
CLL/SLL是一种成熟B淋巴细胞克隆增殖性肿瘤,多发于老年患者,全球每年新增病例超过10万例1。中国CLL/SLL的发病率相对欧美国家较低,但呈明显上升趋势,且具有发病年龄低、侵袭度高等特点2。BTK抑制剂作为目前CLL/SLL一线治疗的首选和基石,显著提升了疾病疗效,但存在反应深度有限、中长期进展复发风险、以及长期持续治疗伴随的毒副作用和不耐受等问题。CLL/SLL治疗仍需要更多安全有效的治疗选择。
Bcl-2抑制剂的出现为CLL/SLL的治疗带来了重要革新。Bcl-2是一种凋亡抑制因子,在许多恶性血液肿瘤特别是CLL/SLL中过度表达,是肿瘤细胞逃避凋亡的重要机制之一。然而Bcl-2靶点成药性难度很高,其作用机制为蛋白-蛋白相互作用 (Protein-protein Interaction, PPI),靶点结合界面较大,很难设计小分子去抑制并发挥阻断作用。此外,Bcl-2靶点位于线粒体上,药物需要先通过细胞膜, 进入细胞后再通过线粒体双膜,才能作用于该靶点,这无疑加大了成药难度。此前,中国尚未有Bcl-2抑制剂获批用于治疗CLL/SLL,此次利生妥®的获批上市填补了这一领域的治疗空白,为国内患者带来新的治疗希望。
此次NDA是基于一项在中国开展的关键注册II期临床研究(APG2575CC201)结果。该研究旨在评估APG-2575单药治疗R/R CLL/SLL患者的有效性和安全性,主要终点指标为总缓解率(ORR),详细研究结果暂时还未公布。 2024年12月,亚盛医药在第66届美国血液学会(ASH)年会上,公布了APG-2575(Lisaftoclax)联合阿可替尼或利妥昔单抗治疗初治 (TN)、复发/难治性(R/R)或既往接受过维奈克拉(ven-treated)治疗的CLL/SLL的最新临床数据(NCT04215809)。 疗效数据显示,在87例接受APG-2575联合阿可替尼治疗的患者中,ORR为98%,在缓解患者中的DOR(DOR; 95% CI, 31-NE)和中位无进展生存期(PFS; 95% CI, 34-NE)均未达到。 联合阿可替尼治疗组中,有14例经维奈克拉治疗后复发/难治或不耐受的患者。中位(范围)治疗周期为16(3-25)个,ORR为86%。中位PFS未达到(11.3-NE),12个月PFS率为84%,18个月PFS率为73%。其中,有9例维奈克拉难治患者。中位(范围)治疗周期为16(3-25)个,ORR为89%。中位PFS未达到(NE-NE),12个月PFS率为89%,18个月PFS率为89%。各队列TEAEs的发生率和严重程度相似。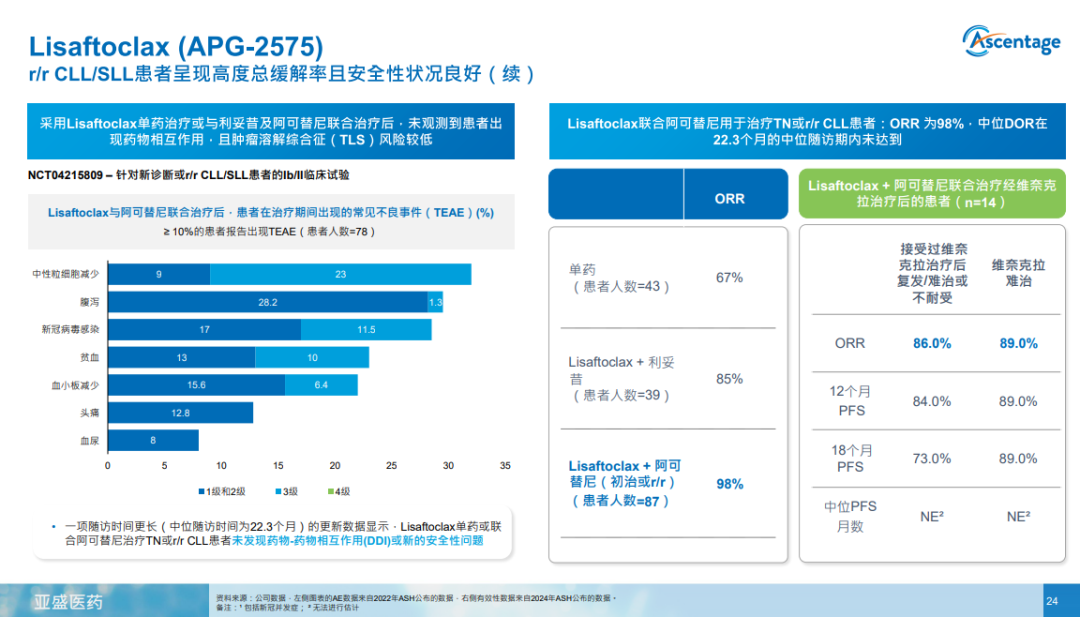 目前,APG-2575共有4项全球注册III期临床正在开展,涉及CLL/SLL、急性髓系白血病(AML)、骨髓增生异常综合征(MDS)几大适应症,且其中一项为FDA许可的全球注册III期临床。
目前,APG-2575共有4项全球注册III期临床正在开展,涉及CLL/SLL、急性髓系白血病(AML)、骨髓增生异常综合征(MDS)几大适应症,且其中一项为FDA许可的全球注册III期临床。
李建勇教授
该项临床研究的主要研究者
江苏省人民医院淋巴瘤中心主任
CLL/SLL是老龄化社会高发的血液肿瘤,我国发病率正持续攀升。尽管治疗取得进步,患者仍面临耐药、长期用药管理复杂、缓解率待提高等挑战。近年来,靶向促凋亡蛋白的药物成为肿瘤治疗研究热点,Bcl-2抑制剂为CLL/SLL患者提供了新治疗方向,在国际上已经成为CLL/SLL治疗的重要药物,而国内此前没有Bcl-2抑制剂在该治疗领域获批。
全新一代Bcl-2抑制剂利生妥®的获批,正是针对这一未满足临床需求的及时响应,填补了国内CLL/SLL领域Bcl-2抑制剂的空白。作为首个中国原研的Bcl-2抑制剂,利生妥®的良好疗效和独特的安全性优势,为医生提供了可供选择的新方案,为CLL/SLL患者带来了新的生存转机。
今年4月,利生妥®凭借其在中国CLL/SLL患者中的突破性疗效与安全性数据,正式被纳入《CSCO淋巴瘤诊疗指南2025》。利生妥®的获批和纳入指南为临床提供了一种可兼顾疗效和安全性的治疗新选择,是国内唯一获批用于治疗CLL/SLL的全新一代Bcl-2抑制剂,彰显了中国原研药的创新能力,是中国血液肿瘤精准治疗的重要进步。
翟一帆博士
亚盛医药首席医学官
感谢各级药监部门对利生妥®有效性及安全性的认可,感谢所有参与临床试验的研究者和他们的团队,以及入组患者的付出与信任。此次利生妥®的获批上市是亚盛医药长达10多年的专注研究与临床开发的成果。这一全球创新品种解决了临床急需,为CLL/SLL患者带来更安全、有效且便捷的治疗选择,贯彻了公司以患者为中心的全球创新理念。
值得一提的是,利生妥®在多种血液肿瘤和实体瘤治疗领域具备广阔的治疗前景,我们也将加速其在全球层面多适应症领域的开发,早日惠及更多患者。
杨大俊博士
亚盛医药董事长、CEO
亚盛医药创始团队在细胞凋亡领域深耕20多年,针对Bcl-2靶点更是深度布局。利生妥®的上市是我们团队在这一领域多年沉淀的结晶,也是亚盛医药创新征途中的又一重大里程碑,并进一步奠定了公司在血液肿瘤领域的领先地位。这款中国原创、全球创新的重磅药物不仅彰显了公司强大的创新实力,更将改写全球Bcl-2抑制剂市场的竞争格局。
未来,亚盛医药将继续坚守“解决中国乃至全球患者尚未满足的临床需求”的使命,带来更多重磅创新药物,惠及全球患者。
目前,亚盛医药还在开展利生妥®四项全球注册III期临床研究,分别为获美国FDA许可的治疗经治CLL/SLL患者的GLORA研究;治疗初治CLL/SLL患者的GLORA-2研究;治疗新诊断老年或体弱急性髓系白血病(AML)的GLORA-3研究;以及治疗新诊断中高危骨髓增生异常综合征(MDS)患者的GLORA-4研究。
参考资料
1. Yao, Y., Lin, X., Li, F., et al. The global burden and attributable risk factors of chronic lymphocytic leukemia in 204 countries and territories from 1990 to 2019: analysis based on the global burden of disease study 2019. Biomed Eng Online. 2022 Jan 11;21(1):4. DOI: 10.1186/s12938-021-00973-6
2. 刘澎. 复旦大学附属中山医院慢性淋巴细胞白细胞/小淋巴细胞淋巴瘤诊疗规范(2018)[J].中国临床医学, 2018, 25(1): 157-160. DOI: 10.12015/j. issn. 1008-6358. 2018. 20180
关于亚盛医药
亚盛医药是一家综合性的全球生物医药企业,致力于研发创新药,以解决肿瘤等领域全球患者尚未满足的临床需求。2019年10月28日,公司在香港联交所主板挂牌上市,股票代码:6855.HK;2025年1月24日,公司在美国纳斯达克证券交易所挂牌上市,股票代码:AAPG。
亚盛医药已建立丰富的创新药产品管线,包括抑制Bcl-2和 MDM2-p53 等细胞凋亡通路关键蛋白的抑制剂;新一代针对癌症治疗中出现的激酶突变体的抑制剂等。
公司核心品种耐立克®是中国首个获批上市的第三代BCR-ABL抑制剂,且获批适应症均被成功纳入国家医保药品目录,目前,亚盛医药正在开展耐立克®一项获美国FDA许可的全球注册III期临床研究(POLARIS-2),用于治疗既往接受过治疗的慢性髓细胞白血病慢性期(CML-CP)成年患者。此外,耐立克®联合治疗新诊断费城染色体阳性急性淋巴细胞白血病(Ph+ ALL)患者和治疗琥珀酸脱氢酶(SDH)缺陷型胃肠道间质瘤(GIST)患者的全球注册III期研究正在开展中。
公司另一重磅品种,新型Bcl-2选择性抑制剂利生妥®的新药上市申请(NDA)刚获NMPA批准。目前,亚盛医药正在开展利生妥®四项全球注册III期临床研究,分别为获美国FDA许可的治疗经治慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)患者的GLORA研究;治疗初治CLL/SLL患者的GLORA-2研究;治疗新诊断老年或体弱急性髓系白血病(AML)的GLORA-3研究;以及治疗新诊断中高危骨髓增生异常综合征(MDS)患者的GLORA-4研究。
截至目前,公司4个在研新药共获16项FDA和1项欧盟孤儿药资格认定,2项FDA快速通道资格以及2项FDA儿童罕见病资格认证。凭借强大的研发能力,亚盛医药已在全球范围内进行知识产权布局,并与武田、默沙东、阿斯利康、辉瑞、信达等领先的生物制药公司,以及梅奥医学中心(Mayo Clinic)、丹娜法伯癌症研究院(Dana-Farber Cancer Institute)、美国国家癌症研究所(NCI)和密西根大学等学术机构达成全球合作关系。
亚盛医药已在原创新药研发与临床开发领域建立经验丰富的国际化人才团队,以及成熟的商业化生产与市场营销团队。亚盛医药将不断提高研发能力,加速推进公司产品管线的临床开发进度,真正践行"解决中国乃至全球患者尚未满足的临床需求"的使命,以造福更多患者。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)