首页 > 医疗资讯/ 正文
研究亮点
- 蛋白酶体抑制剂(PIs)显著增强溶瘤脊髓病毒(Reovirus,RV)在循环单核细胞中的复制,从而提升病毒对多发性骨髓瘤(MM)细胞的传递。
- PIs通过阻断单核细胞中的NF-κB介导的抗病毒免疫反应,优化病毒感染环境,而不抑制T细胞免疫激活。
- 临床1b期研究显示,CFZ(卡非佐米)与RV联合治疗在复发/难治MM患者中诱导有效的病毒复制、单核细胞扩增及T细胞活化,且疗效独立于患者对PI的肿瘤细胞敏感性。
溶瘤病毒疗法通过选择性感染和杀死肿瘤细胞而不伤害正常组织,近年来成为肿瘤免疫治疗的重要方向。自FDA批准Talimogene laherparepvec(赫赛汀病毒改造产品)用于黑色素瘤以来,溶瘤病毒在实体瘤中的应用逐步深入。然而,在血液系统恶性肿瘤如多发性骨髓瘤中,溶瘤病毒疗法面临着多重挑战,特别是病毒体在机体内的传递、抵抗中和抗体和免疫清除等困难。Reovirus Serotype 3 – Dearing Strain(RV)天生对转化细胞具有亲和力,且安全性良好,是理想的未经改造的溶瘤病毒候选。其进入细胞依赖于sialic acid及结合JAM-A受体,而JAM-A在MM细胞表面广泛表达。
然而,单纯静脉注射RV治疗MM患者的试验显示,病毒虽可抵达骨髓并进入肿瘤细胞,但未能实现有效复制,缺少深入的病毒介导肿瘤细胞杀伤。由于蛋白酶体抑制剂(PIs)如硼替佐米(BTZ)和卡非佐米(CFZ)为MM标准治疗药物,其抑制NF-κB途径也被认作诱导肿瘤细胞死亡的关键机制,但关于PIs是否能协同促进RV疗效、其具体机制尚不明晰。本研究针对这一关键问题展开。

近期,发表于Journal of Hematology & Oncology杂志的一项,围绕溶瘤脊髓病毒(Reovirus, RV)治疗多发性骨髓瘤(MM)时的细胞及免疫机制进行深入剖析。此前单药RV治疗MM虽显示安全,但病毒在肿瘤细胞内未能有效复制并控制疾病。该研究系统验证蛋白酶体抑制剂(PIs,如卡非佐米CFZ)能够通过抑制单核细胞的NF-κB介导的抗病毒反应,促进病毒复制与骨髓瘤杀伤,并联合临床1b期试验,证明联合用药对复发难治MM具有可观疗效,且不依赖肿瘤细胞对PI的敏感性。
本研究结合基础研究与临床验证。基础层面,通过电子显微镜、CyTOF(单细胞质谱)、流式细胞术、Western blot和qRT-PCR等技术,评估了RV感染MM细胞及免疫细胞的情况,尤其重点关注单核细胞群体的病毒复制及NF-κB活性。利用免疫荧光及NF-κB荧光素酶报告系统验证病毒诱导NF-κB信号通路的激活及PIs的阻断作用。临床部分开展了1b期剂量递增试验,13例复发难治MM患者接受RV与卡非佐米联合治疗,结合流式及CyTOF分析免疫谱变动及T细胞受体测序,评估免疫动力学和临床疗效。
主要研究结果
1、PIs对MM细胞内RV复制的影响有限,依赖肿瘤微环境的介入才能发挥增强效应。
在多发性骨髓瘤细胞系中(如MM.1S、L363、H929、RPMI-8226和U266),CFZ或BTZ与RV联合治疗均未提升病毒复制,反而减弱病毒颗粒产生与细胞凋亡(图.1A-F)。但当从患者的骨髓单核细胞混合物(含肿瘤细胞及免疫细胞)开展体外实验时,CFZ+RV联用显著降低CD138+(MM肿瘤)细胞存活(图.1G),不影响CD138–非肿瘤细胞(图.1H),显示PIs增强的溶瘤效应需要肿瘤微环境支持。
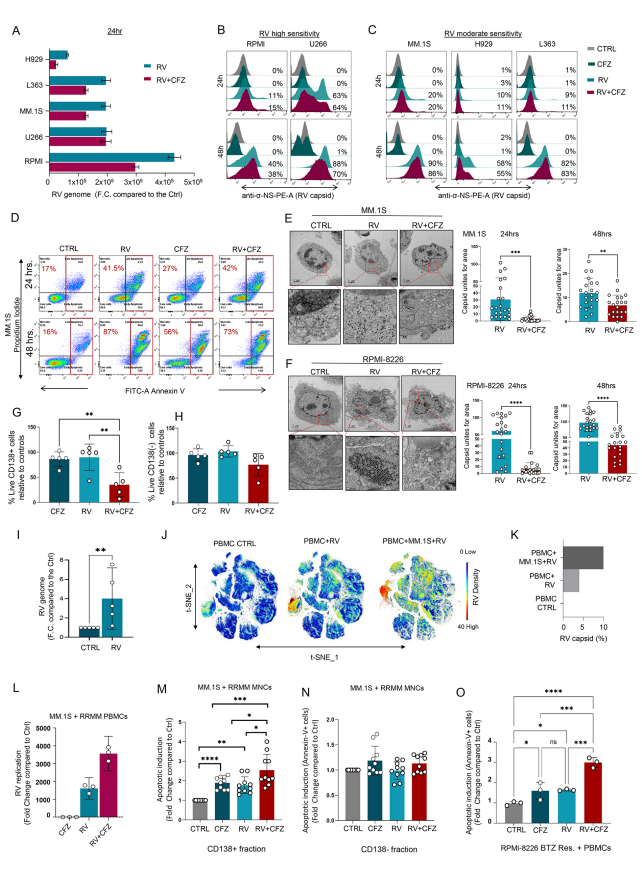
图1
2、单核细胞是RV复制的主要载体,PIs促进单核细胞内病毒复制并增强病毒传递到MM细胞。
通过CyTOF单细胞质谱分析,发现病毒内壳蛋白σ-NS主要在CD14+经典单核细胞中表达(图.2A-E)。且单核细胞表面高度表达JAM-A受体,是病毒进入单核细胞的关键通道(图.2H-J)。PIs(CFZ)能显著增加单核细胞内RV复制(图.2F-G)。在小鼠MM模型中,采用脂质体介导除单核/巨噬细胞后,RV在骨髓肿瘤细胞中的复制显著下降,明确单核细胞介导病毒向肿瘤转运的重要性(图.2K-M)。
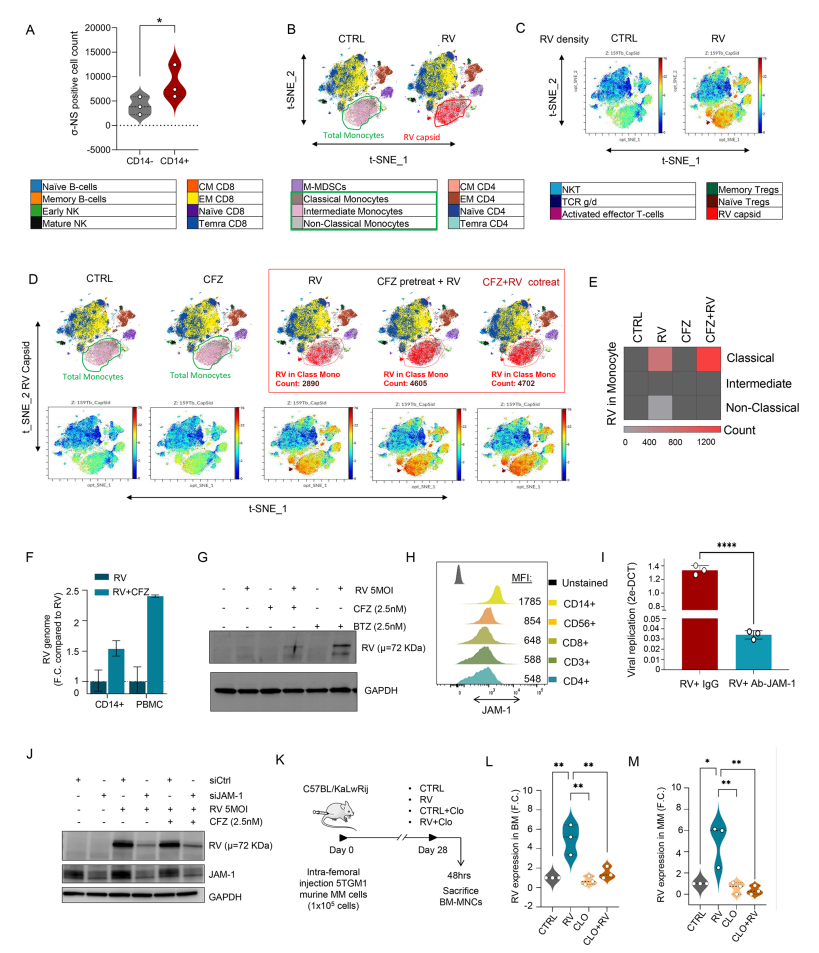
图2
3、NF-κB通路在单核细胞抗病毒反应中关键,PIs阻断该信号通路,抑制抗病毒干扰素产生,促进病毒复制。
RV感染单核细胞激活NF-κB通路,表现为p65亚单位核转位增加,诱导IFN-α和IFN-β表达( 图.3A-E)。CFZ及其他NF-κB抑制剂(Bay-11)阻断p65核转位和干扰素表达,降低单核细胞抗病毒反应,使病毒在单核细胞中高效复制(图.3F-L)。尽管抑制抗病毒炎症,PIs并不损伤T细胞及单核细胞的活化状态(CD69、CD80表达稳定)(图.3N-P),反而增强单核细胞对MM细胞的吞噬作用(图.3Q-T),有助于免疫介导的肿瘤细胞清除。
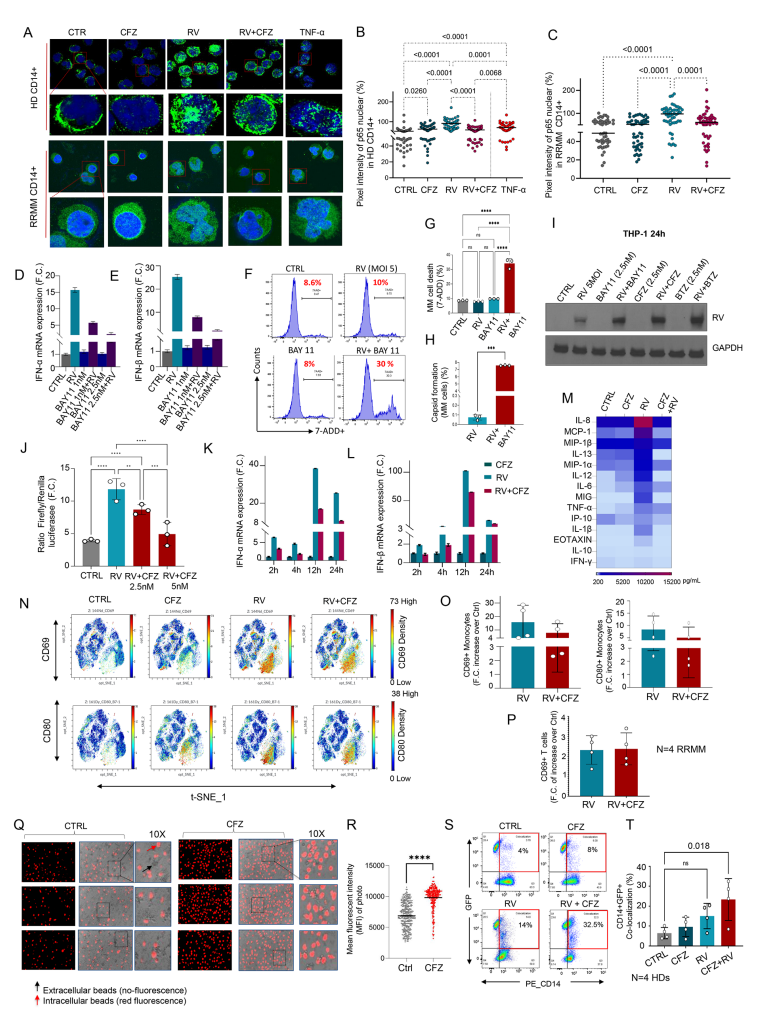
图3
4、临床1b期研究显示CFZ+RV联合治疗可实现有效的病毒复制、单核细胞扩增及T细胞重新活化,诱导部分患者获得显著的临床缓解。
13例复发/难治MM患者接受联合疗法,安全性良好(除若干剂量限制毒性)。治疗后临床缓解率达53.8%,疾病控制率69.2%(图.4B)。骨髓评估显示,联合疗法带来了包括病毒基因组和内壳蛋白的活跃病毒复制信号(图.4C-E),而单用RV患者未见活跃病毒复制。肿瘤细胞中PD-L1及凋亡标志物Caspase-3显著上调(图.4F-I),提示病毒诱导的免疫激活并促进肿瘤细胞死亡。
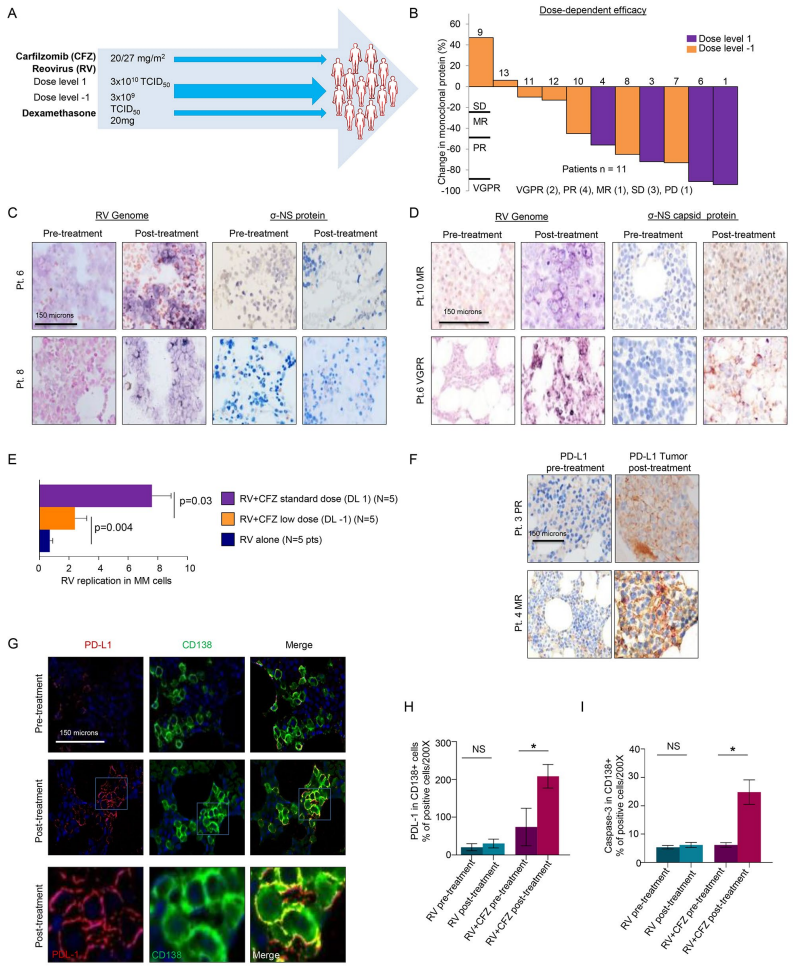
图4
外周血监测显示,治疗首周显著单核细胞(特别是经典单核细胞)扩增及激活增强(CD69阳性比例增加)(图.5A-D),伴随CD8+细胞上升、CD4+细胞下降,CD4/CD8比率降低(图.5F-H),T细胞增殖及功能均被激活。TCR测序揭示治疗相关T细胞克隆多样性下降,出现克隆扩增,提示特异性免疫应答的建立(图.6E)。小鼠体内模型及ELISPOT验证CFZ+RV联合显著诱导针对病毒感染的MM细胞的T细胞反应(图.6F-K)。
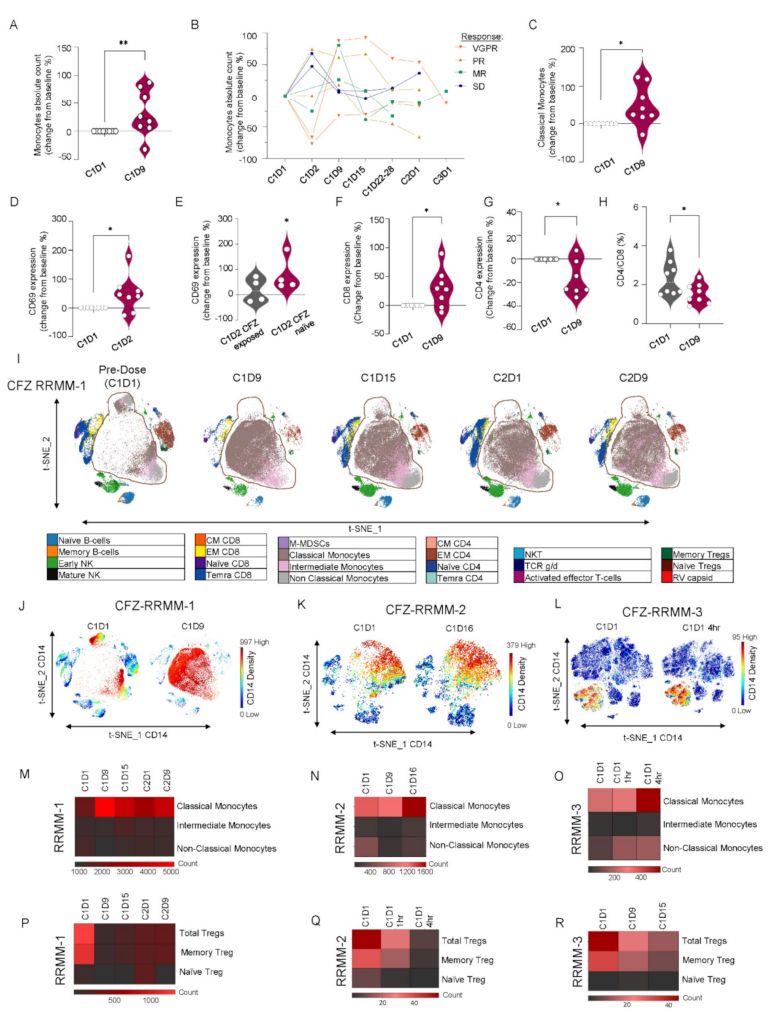
图5
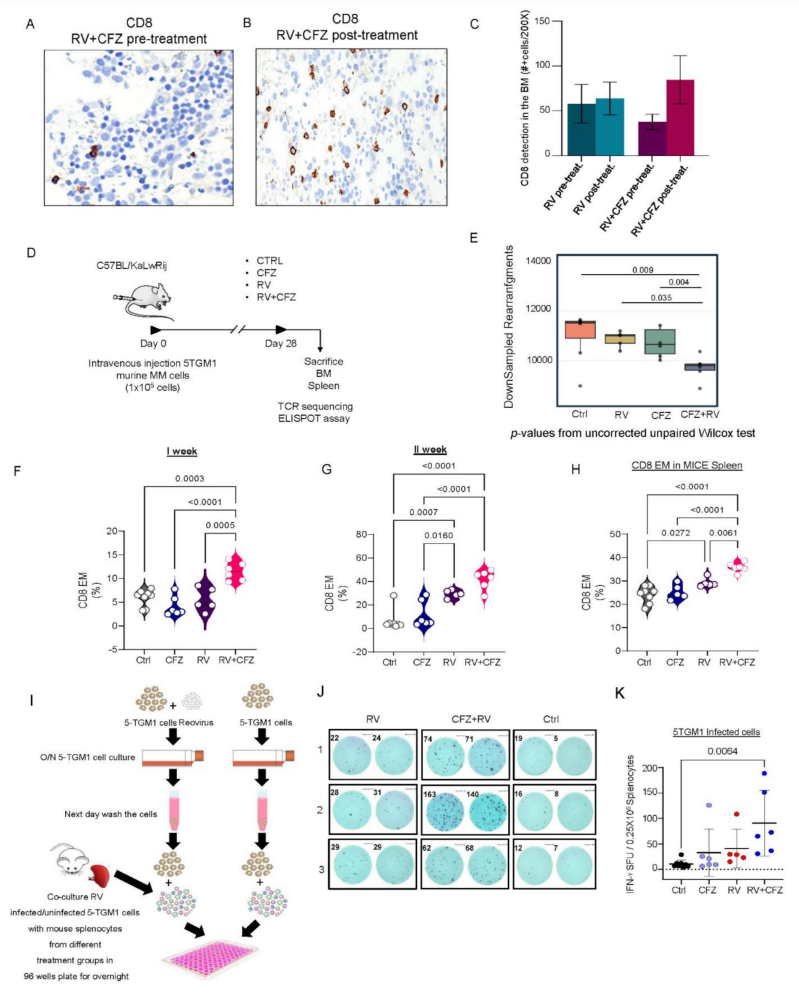
图6
5、图示总结
研究提出,PIs(CFZ)通过抑制单核细胞NF-κB抗病毒屏障,促进RV在单核细胞内复制,增强病毒载体输送并感染MM细胞,激活CD8+T细胞介导的抗肿瘤免疫,从而产生强效协同抗癌效果(图.7)。
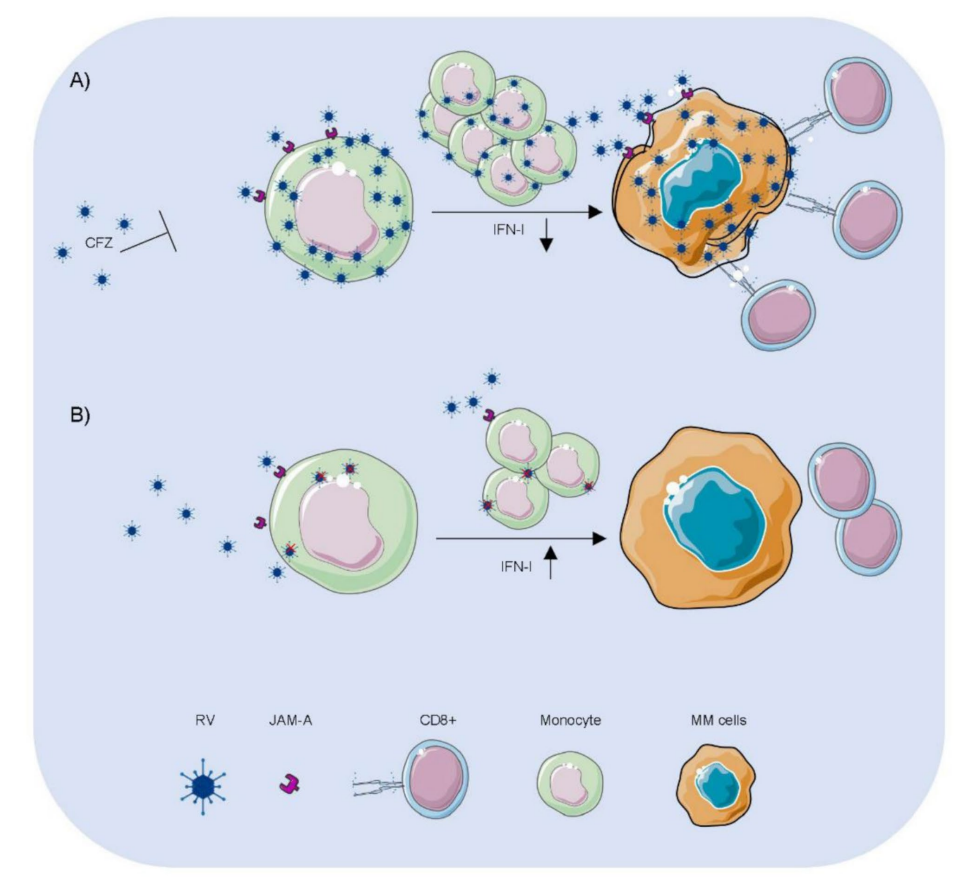
图7
讨论
本研究首次系统揭示了蛋白酶体抑制剂提升溶瘤脊髓病毒疗效的全新机理:PIs通过削弱单核细胞NF-κB抑制干扰素介导的抗病毒免疫,实现病毒在单核细胞内高效复制,促进感染肿瘤细胞,加速病毒介导的溶瘤及激活抗肿瘤T细胞应答。值得强调的是,此机制与MM细胞自身对PI的敏感性无关,意味着PIs不仅起直接杀伤肿瘤的作用,更具重要的免疫调节双重功能。
临床数据验证了联合方案的可行性及疗效,重度预处理且多为PI耐药患者仍获益,说明其广泛适用潜力。该机制突破了传统认为PIs免疫抑制的刻板印象,体现PIs在病毒治疗中的独特免疫激活作用,为今后设计更加精准的联合免疫治疗方案提供了理论依据。未来可考虑基于该机制,结合免疫检查点抑制剂优化疗效,或扩展至更多实体肿瘤的溶瘤病毒治疗。
原始出处
Dona, A.A., Tandoh, T., Nigam, L. et al. Proteasome inhibition enhances oncolytic reovirus therapy in multiple myeloma independently of its direct cytotoxic effects. J Hematol Oncol 18, 1 (2025). https://doi.org/10.1186/s13045-024-01645-3
- 上一篇:大咖谈 | 双特异性抗体药理机制
- 下一篇:e临床医学|儿童急髓白血病缓解标准新突破
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)