首页 > 医疗资讯/ 正文
[摘要]背景与目的:胰腺癌对白蛋白结合型紫杉醇耐药会影响疗效及患者预后,信号转导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)是调控癌细胞化疗敏感性的重要分子之一,针对STAT3 mRNA反义寡核苷酸的中性脂质体BP1003能够抑制STAT3表达并增加化疗敏感性。但BP1003对胰腺癌细胞白蛋白结合型紫杉醇敏感性的影响尚不清楚。本研究旨在研究脂质体结合的反义寡核苷酸BP1003通过抑制STAT3对胰腺癌细胞白蛋白结合型紫杉醇敏感性的影响。方法:培养胰腺癌细胞株PANC-1及ASPC-1,分为对照组(不含药物)、BP1003组(200 μg/mL BP1003干预)、不同浓度白蛋白结合型紫杉醇组(5、10、20 nmol/L白蛋白结合型紫杉醇干预)、BP1003+不同浓度白蛋白结合型紫杉醇组(200 μg/mL BP1003联合5、10、20 nmol/L白蛋白结合型紫杉醇干预)。检测细胞增殖活力、凋亡率及STAT3、STAT4、STAT6、Bcl-2、Bax、c-Myc的蛋白表达水平。BALC/c裸小鼠皮下注射PANC-1、ASPC-1细胞悬液,建立移植瘤模型,分为对照组(生理盐水干预)、BP1003组(25 mg/kg BP1003干预,每2周1次)、白蛋白结合型紫杉醇组(10 mg/kg白蛋白结合型紫杉醇,每周1次)、BP1003+白蛋白结合型紫杉醇组(25 mg/kg BP1003干预,每2周1次联合10 mg/kg白蛋白结合型紫杉醇,每周1次)。4周后测量移植瘤体积及质量,检测STAT3、Bcl-2、Bax、c-Myc的蛋白表达水平。结果:BP1003组及不同浓度白蛋白结合型紫杉醇组PANC-1及ASPC-1细胞的凋亡率、Bax的蛋白表达水平均高于对照组,细胞增殖活力及STAT3、Bcl-2、c-Myc的蛋白表达水平低于对照组(P<0.05)。BP1003组PANC-1及ASPC-1细胞的STAT4、STAT6蛋白表达水平与对照组相比差异无统计学意义(P>0.05)。BP1003+不同浓度白蛋白结合型紫杉醇组PANC-1及ASPC-1细胞的凋亡率、Bax的蛋白表达水平均高于对应浓度白蛋白结合型紫杉醇组,细胞增殖活力及STAT3、Bcl-2、c-Myc的蛋白表达水平均低于对应浓度白蛋白结合型紫杉醇组(P<0.05)。BP1003组、白蛋白结合型紫杉醇组、BP1003+白蛋白结合型紫杉醇组裸鼠移植瘤的体积、质量及STAT3、Bcl-2、c-Myc的蛋白表达水平均低于对照组,Bax的蛋白表达水平高于对照组(P<0.05)且BP1003+白蛋白结合型紫杉醇组的上述变化较BP1003组、白蛋白结合型紫杉醇组更为显著。结论:BP1003通过抑制STAT3表达增加胰腺癌细胞对白蛋白结合型紫杉醇的敏感性。
[关键词] 胰腺癌;BP1003;信号转导及转录激活因子3;白蛋白结合型紫杉醇;敏感性
[Abstract] Background and purpose: The resistance of pancreatic cancer to albumin-bound paclitaxel affects the therapeutic effect and prognosis. Signal transducer and activator of transcription 3 (STAT3) is one of the important molecules regulating the chemotherapy sensitivity of cancer cells. The liposome BP1003 targeting the antisense oligonucleotide of STAT3 mRNA can inhibit the expression of STAT3 and increase the chemotherapy sensitivity. However, the effect of BP1003 on the sensitivity of pancreatic cancer cells to albumin-bound paclitaxel remains unclear. The purpose of this study was to investigate the effects of liposome binding antisense oligonucleotide BP1003 on albumin-bound paclitaxel sensitivity in pancreatic cancer cells by inhibiting STAT3. Methods: Pancreatic cancer cell lines PANC-1 and ASPC-1 were cultured. They were divided into control group (without drugs), BP1003 group (200 μg/mL BP1003 intervention), different concentrations of albumin-bound paclitaxel group (5, 10, 20 nmol/L albumin-bound paclitaxel intervention), BP1003+different concentrations of albumin-bound paclitaxel group (200 μg/mL BP1003 combined with 5, 10, 20 nmol/L albumin-bound paclitaxel intervention). The proliferation viability, apoptotic rate and the protein expression levels of STAT3, STAT4, STAT6, Bcl-2, Bax and c-Myc were detected. The transplanted tumor model was established by subcutaneous injection of PANC-1 and ASPC-1 cell suspension in nude mice, which were divided into control group (normal saline intervention), BP1003 group (25 mg/kg BP1003 intervention, once every 2 weeks) and albumin-bound paclitaxel group (10 mg/kg albumin-bound paclitaxel, once a week), BP1003+albumin-bound paclitaxel group (25 mg/kg BP1003 intervention, once every 2 weeks combined with 10 mg/kg albumin-bound paclitaxel, once a week). Four weeks later, the graft volume and mass were measured, and the protein expression levels of STAT3, Bcl-2, Bax and c-Myc were detected. Results: The apoptotic rate and the protein expression levels of Bax of PANC-1 and ASPC-1 cells in BP1003 group and albumin-bound paclitaxel group were higher than those in the control group, while the proliferation viability and protein expression levels of STAT3, Bcl-2 and c-Myc were lower than those in control group (P<0.05). There was no significant difference in the expression levels of STAT4 and STAT6 in PANC-1 and ASPC-1 cells between BP1003 group and the control group (P>0.05). The apoptotic rate and the protein expression levels of Bax of PANC-1 and ASPC-1 cells in BP1003+different concentrations of albumin-bound paclitaxel groups were higher than those in different concentrations of albumin-bound paclitaxel groups, and the proliferation viability and protein expression levels of STAT3, Bcl-2 and c-Myc were lower than those in different concentrations of albumin-bound paclitaxel groups (P <0.05). The volume and mass of transplanted tumor and the protein expression levels of STAT3, Bcl-2 and c-Myc of nude mice in BP1003 group, albumin-bound paclitaxel group and BP1003+albumin-bound paclitaxel group were all lower compared with the control group, the protein expression level of Bax was higher compared with the control group (P<0.05), and the above changes in BP1003+albumin-bound paclitaxel group were more significant compared with BP1003 and albumin-bound paclitaxel group. Conclusion: BP1003 increases the sensitivity of pancreatic cancer cells to albumin-bound paclitaxel by inhibiting the expression of STAT3.
[Key words] Pancreatic cancer; BP1003; Signal transducer and activator of transcription 3; Albumin-bound paclitaxel; Sensitivity
胰腺癌是恶性程度极高的消化系统恶性肿瘤,中国胰腺癌患者的5年生存率不足10%[1-2]。胰腺癌的早期诊断难度大,超过30%的胰腺癌确诊时已经进入中晚期,其一线治疗方案是以白蛋白结合型紫杉醇为基础的化疗,但治疗有效率仅30%。多数胰腺癌患者因化疗药物引起的不良反应或对化疗药物不敏感而导致治疗失败[3-4]。因此,寻找有效的联合治疗手段以增加中晚期胰腺癌对白蛋白结合型紫杉醇的敏感性有助于在保证化疗效果的前提下降低化疗药物剂量并减轻不良反应,进而提高化疗有效率和患者生存率。
信号转导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)是具有促癌作用的信号分子,在外界刺激因素的作用下STAT3能够形成同源二聚体并移位进入细胞核,进而在细胞核中调控c-myc基因、Bcl-2基因、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)表达,最终实现对细胞增殖、凋亡的调控。在胰腺癌、乳腺癌、卵巢癌等实体恶性肿瘤中STAT3的表达增加且通过调控c-Myc、Bcl-2、Bax表达的方式促进癌细胞增殖、抑制癌细胞凋亡、诱导癌细胞化疗耐药[5-7]。BP1003是一种掺入了针对STAT3 mRNA反义寡核苷酸的中性脂质体,能够有效地降低STAT3表达且具有较强的稳定性、细胞摄取力及靶点亲和力,是治疗癌症的潜在药物。有研究[8]显示,BP1003能够显著增加乳腺癌、卵巢癌和胰腺癌等多种癌细胞的化疗敏感性,但其对胰腺癌细胞白蛋白结合型紫杉醇敏感性的影响尚不清楚。因此,本文将以两种胰腺癌细胞株PANC-1及ASPC-1为实验对象,通过细胞实验和动物实验分析BP1003通过抑制STAT3对胰腺癌细胞白蛋白结合型紫杉醇敏感性的影响。
1 材料和方法
1.1 细胞系
人胰腺癌细胞系PANC-1及ASPC-1购自武汉尚恩生物技术有限公司。
1.2 动物
BALB/c-nu无胸腺裸小鼠,雄性,5周龄,体质量(20±2) g,购自斯贝福(北京)生物技术有限公司[生产许可证号:SCXK(京 )2024-0001;使用许可证号:SYXK(京)2024-0010]。动物实验经湘西自治州人民医院伦理委员会批准(伦理号:[2022]伦审批第006号)。
1.3 主要试剂及仪器
脂质体结合的反义寡核苷酸BP1003购自美国Nitto Denko Avecia公司,白蛋白结合型紫杉醇购自美国Celgene Corporation公司,水溶性四氮唑-8(water-soluble tetrazolium-8,WST-8)细胞增殖分析试剂盒购自武汉艾美捷科技有限公司,Annexin Ⅴ-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)细胞凋亡检测试剂盒购自上海碧云天生物技术股份有限公司,兔来源Bcl-2、Bax、c-Myc、STAT3一抗购自英国Abcam公司。CellXpert® C170细胞培养箱购自德国Eppendorf公司,ReadMax 1200型光吸收全波长酶标仪购自上海闪谱生物科技有限公司,GenoSens 2000系列凝胶成像系统购自上海勤翔科学仪器有限公司。NovoCyte Opteon流式细胞仪购自安捷伦生物(杭州)有限公司。
1.4 方法
1.4.1 细胞培养及分组
PANC-1及ASPC-1细胞在DMEM培养基中培养,补充10%胎牛血清。细胞传代后进行如下分组处理:对照组(不含药物)、BP1003组(给予200 μg/mL BP1003干预)[8]、不同浓度白蛋白结合型紫杉醇组(分别给予5、10、20 nmol/L白蛋白结合型紫杉醇干预)[9]、BP1003+不同浓度白蛋白结合型紫杉醇组(给予200 μg/ mL BP1003并分别联合5、10、20 nmol/L白蛋白结合型紫杉醇干预)。
1.4.2 细胞增殖检测
将PANC-1及ASPC-1细胞按照1×104个/孔接种在96孔培养板中,贴壁24 h后按照1.4.1的方法进行分组处理,第24、48、72 h时分别采用WST-8试剂盒检测细胞增殖,按照试剂盒说明书检测每个培养孔的吸光度(D)值。细胞增殖活力用对照组细胞的百分比进行描述。
1.4.3 细胞凋亡检测
将PANC-1及ASPC-1细胞按照1×105个/孔接种在24孔培养板中,贴壁24 h后按照1.4.1的方法进行分组处理,第24 h时消化收集各组细胞,采用Annexin Ⅴ-FITC试剂盒检测细胞凋亡,进行Annexin Ⅴ-FITC和碘化丙啶(propidium iodide,PI)染色,在流式细胞仪中检测细胞的散射和荧光,Annexin Ⅴ-FITC阳性、PI阴性为凋亡细胞,计算细胞凋亡率。
1.4.4 动物实验
48只裸鼠随机分为对照组、BP1003组、白蛋白结合型紫杉醇组和BP1003+白蛋白结合型紫杉醇组,每组各12只。每组6只裸鼠皮下注射 0.2 mL 5×106个/mL PANC-1细胞悬液,另6只裸鼠皮下注射0.2 mL 5×106个/mL ASPC-1细胞悬液。待7 d后移植瘤形成,各组进行给药,BP1003组皮下注射25 mg/kg BP1003(每2周1次);白蛋白结合型紫杉醇组皮下注射10 mg/kg白蛋白结合型紫杉醇(每周1次);BP1003+白蛋白结合型紫杉醇组皮下注射25 mg/kg BP1003(每2周1次)和10 mg/kg白蛋白结合型紫杉醇(每周1次);对照组皮下注射50 μL生理盐水(每周1次)。治疗 28 d后,测量移植瘤体积及质量。
1.4.5 蛋白表达检测
取各组细胞及移植瘤,提取蛋白后进行蛋白质印迹法(Western blot)实验,将蛋白样本与上样缓冲液混合,在聚丙烯酰胺凝胶中电泳分离蛋白,转移至聚偏二氟乙烯膜并用5%脱脂牛奶室温封闭2 h,4 ℃下温育特异性一抗过夜,然后室温下温育辣根过氧化物酶标记的山羊抗兔的二抗1 h。最后,在GenoSens 2000系列凝胶成像系统中通过增强型化学发光试剂显示蛋白条带,分析条带灰度值并计算蛋白表达水平。
1.5 统计学处理
实验数据均为计量资料,均经Shapiro-Wilk检验和Levene检验确认满足正态分布和方差齐性,以x±s表示。采用SPSS 25.0软件对数据进行统计学处理。2组间比较采用独立样本t检验。3组及以上比较时采用单因素ANOVA分析,若ANOVA结果显著,进一步采用SNK检验进行两两比较。P <0.05为差异有统计学意义。
2 结 果
2.1 BP1003对胰腺癌细胞PANC-1及ASPC-1增殖和凋亡的影响
BP1003组胰腺癌细胞PANC-1及ASPC-1的增殖活力低于对照组,凋亡率均高于对照组,差异有统计学意义(P<0.05,图1、2)。
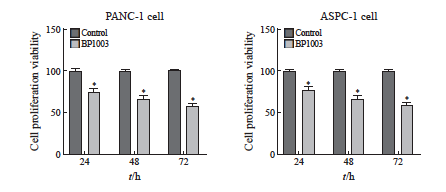
图1 BP1003对胰腺癌细胞PANC-1及ASPC-1增殖活力的影响(n=5)
Fig. 1 Effect of BP1003 on the proliferation viability of PANC-1 and ASPC-1 pancreatic cancer cells (n=5)
*: P<0.05, compared with control group.
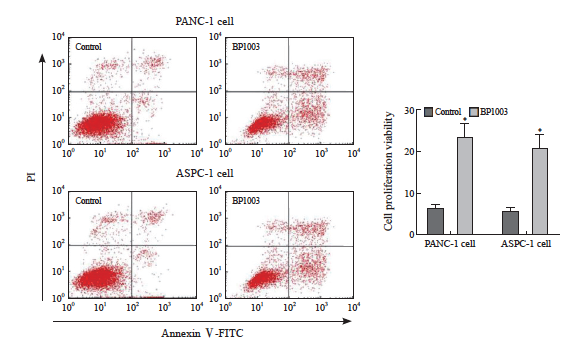
图2 胰腺癌细胞PANC-1及ASPC-1凋亡率的比较
Fig. 2 Comparion of apoptosis rate of PANC-1 and ASPC-1 pancreatic cancer cells
*: P<0.05, compared with control group.
2.2 BP1003对胰腺癌细胞PANC-1及ASPC-1中STAT3、STAT4、STAT6表达的影响
BP1003组胰腺癌细胞PANC-1及ASPC-1中STAT3的蛋白表达水平低于对照组,差异有统计学意义(P<0.05),STAT4、STAT6蛋白表达水平与对照组差异无统计学意义(P>0.05,图3)。
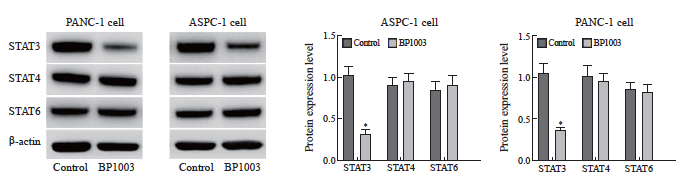
图3 BP1003对胰腺癌细胞PANC-1及ASPC-1中STAT3、STAT4、STAT6表达的影响
Fig. 3 Effect of BP1003 on the expression of STAT3, STAT4 and STAT6 in PANC-1 and ASPC-1 pancreatic cancer cells
*: P<0.05, compared with control group.
2.3 BP1003对胰腺癌细胞PANC-1及ASPC-1中STAT3下游蛋白表达的影响
BP1003组胰腺癌细胞PANC-1及ASPC-1中Bcl-2、c-Myc的蛋白表达水平低于对照组,Bax的蛋白表达水平高于对照组,差异有统计学意义(P<0.05,图4)。
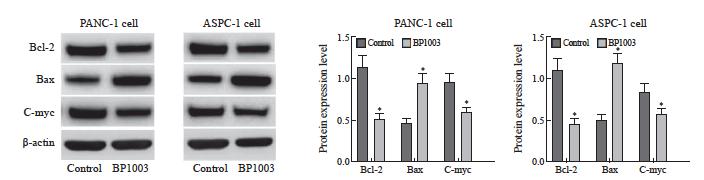
图4 BP1003对胰腺癌细胞PANC-1及ASPC-1中Bcl-2、Bax、c-Myc表达的影响
Fig. 4 Effect of BP1003 on the expression of Bcl-2, Bax and c-Myc in PANC-1 and ASPC-1 pancreatic cancer cells
*: P<0.05, compared with control group.
2.4 BP1003联合白蛋白结合型紫杉醇对胰腺癌细胞PANC-1及ASPC-1增殖和凋亡的影响
不同浓度白蛋白结合型紫杉醇组胰腺癌细胞PANC-1及ASPC-1的增殖活力低于对照组,凋亡率均高于对照组,差异有统计学意义(P <0.05)。BP1003+不同浓度白蛋白结合型紫杉醇组胰腺癌细胞PANC-1及ASPC-1的增殖活力低于对应浓度的白蛋白结合型紫杉醇组,凋亡率均高于对应浓度的白蛋白结合型紫杉醇组,差异有统计学意义(P <0.05,图5、6)。
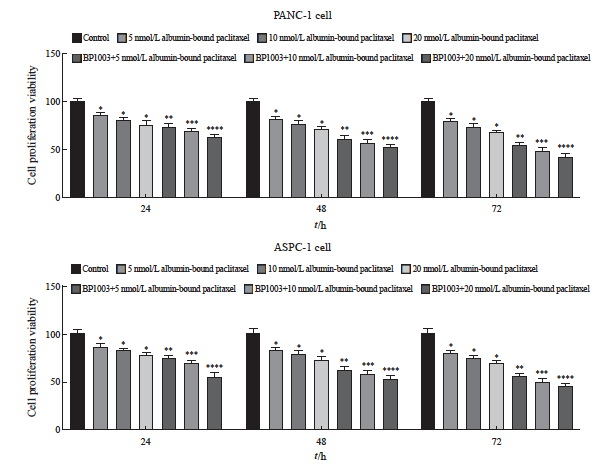
图5 BP1003联合白蛋白结合型紫杉醇对胰腺癌细胞PANC-1及ASPC-1增殖活力的影响(n=5)
Fig. 5 Effects of BP1003 combined with albumin-bound paclitaxel on proliferation viability rates of PANC-1 and ASPC-1 pancreatic cancer cells (n=5)
*: P<0.05, compared with control group; **: P<0.05, compared with 5 nmol/L albumin-bound paclitaxel; ***: P<0.05, compared with 10 nmol/L albumin-bound paclitaxel; ****: P<0.05, compared with 20 nmol/L albumin-bound paclitaxel.
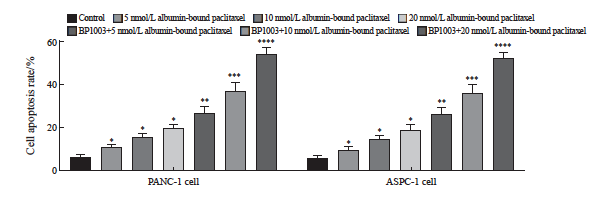
图6 BP1003联合白蛋白结合型紫杉醇对胰腺癌细胞PANC-1及ASPC-1凋亡的影响(n=5)
Fig. 6 Effects of BP1003 combined with albumin-bound paclitaxel on apoptosis of PANC-1 and ASPC-1 pancreatic cancer cells (n=5)
*: P<0.05, compared with control group; **: P<0.05, compared with 5 nmol/L albumin-bound paclitaxel; ***: P<0.05, compared with 10 nmol/L albumin-bound paclitaxel; ****: P<0.05, compared with 20 nmol/L albumin-bound paclitaxel.
2.5 BP1003联合白蛋白结合型紫杉醇对胰腺癌细胞PANC-1及ASPC-1中STAT3及下游蛋白表达的影响
不同浓度白蛋白结合型紫杉醇组胰腺癌细胞PANC-1及ASPC-1中STAT3、Bcl-2、c-Myc的蛋白表达水平均低于对照组,Bax的蛋白表达水平均高于对照组(P <0.05)。BP1003+不同浓度白蛋白结合型紫杉醇组胰腺癌细胞PANC-1及ASPC-1中STAT3、Bcl-2、c-Myc的蛋白表达水平均低于对应浓度的白蛋白结合型紫杉醇组,Bax的蛋白表达水平均高于对应浓度的白蛋白结合型紫杉醇组(P <0.05,图7)。
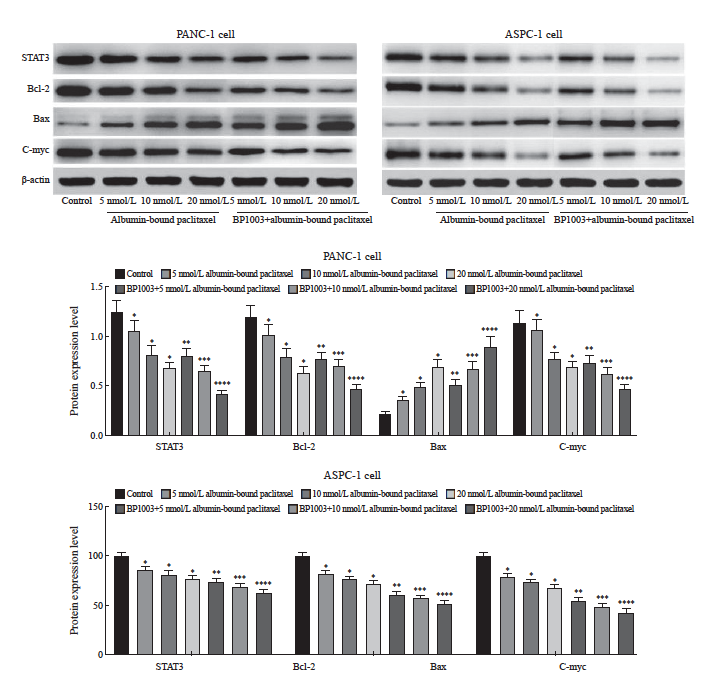
图7 BP1003联合白蛋白结合型紫杉醇对胰腺癌细胞PANC-1及ASPC-1中STAT3、Bcl-2、Bax、c-Myc表达的影响
Fig. 7 Effect of BP1003 combined with albumin-bound paclitaxel on the expression of STAT3, Bcl-2, Bax and c-Myc in PANC-1 and ASPC-1 pancreatic cancer cells
*: P<0.05, compared with control group; **: P<0.05, compared with 5 nmol/L albumin-bound paclitaxel; ***: P<0.05, compared with 10 nmol/L albumin-bound paclitaxel; ****: P<0.05, compared with 20 nmol/L albumin-bound paclitaxel.
2.6 BP1003和白蛋白结合型紫杉醇对胰腺癌移植瘤生长的影响
BP1003组、白蛋白结合型紫杉醇组、 BP1003+白蛋白结合型紫杉醇组的移植瘤体积及质量均低于对照组(P<0.05);BP1003+白蛋白结合型紫杉醇组的移植瘤体积及质量均低于BP1003组、白蛋白结合型紫杉醇组(P <0.05,图8)。
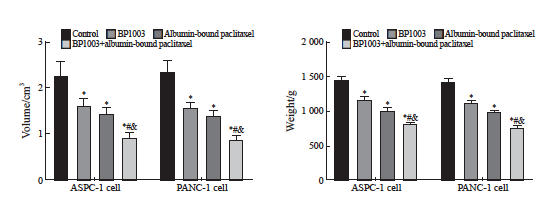
图8 BP1003和白蛋白结合型紫杉醇对胰腺癌移植瘤体积及质量的影响
Fig. 8 Effects of BP1003 and albumin-bound paclitaxel on tumor volume and quality of pancreatic cancer transplantation
*: P<0.05, compared with control group; #: P<0.05, compared with BP1003 group; &: P<0.05, compared with albumin-bound paclitaxel group.
2.7 BP1003和白蛋白结合型紫杉醇对胰腺癌移植瘤中STAT3及下游蛋白表达的影响
BP1003组、白蛋白结合型紫杉醇组、B P1003+白蛋白结合型紫杉醇组移植瘤中STAT3、Bcl-2、c-Myc的蛋白表达水平均低于对照组,Bax的蛋白表达水平均高于对照组,差异有统计学意义(P <0.05);BP1003+白蛋白结合型紫杉醇组移植瘤中STAT3、Bcl-2、c-Myc的蛋白表达水平均低于BP1003组、白蛋白结合型紫杉醇组,Bax的蛋白表达水平均高于BP1003组、白蛋白结合型紫杉醇组,差异有统计学意义(P<0.05,图9)。
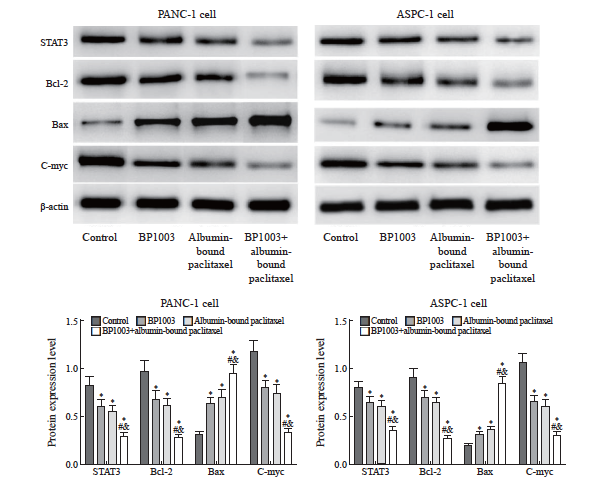
图9 BP1003和白蛋白结合型紫杉醇对胰腺癌移植瘤中STAT3及下游蛋白表达的影响
Fig.9 Effects of BP1003 and albumin-bound paclitaxel on STAT3 and downstream protein expression in pancreatic cancer transplant tumors
*: P<0.05, compared with control group; #: P<0.05, compared with BP1003 group; &: P<0.05, compared with albumin-bound paclitaxel group.
3 讨 论
STAT3是具有促癌作用的信号蛋白,编码该蛋白的基因位于17q21染色体,编码产物是一种DNA结合蛋白。在发挥促癌作用的过程中, STAT3能够将细胞外信号转导至细胞质并形成同源二聚体,随后移位至细胞核并与c-myc、Bcl-2等基因的DNA结合,调控基因表达并促进细胞增殖、抑制细胞凋亡。STAT3的活化依赖于赖氨酸去乙酰化、丝氨酸和酪氨酸磷酸化,靶向STAT3的小分子抑制剂因其抑制癌细胞生长的作用正成为备受关注的潜在抗癌药物。有研究显示,靶向STAT3磷酸化的小分子抑制剂Stattic、N4、WB436B能够显著抑制胰腺癌细胞的增殖并促进细胞凋亡[11-13];靶向STAT3去乙酰化的内源性竞争性RNA对胰腺癌的免疫微环境具有调控作用,进而抑制癌细胞生长和转移[14-15]。
在胰腺癌的发生、发展过程中,STAT3在胰腺癌组织中的表达增加且与患者预后不良相关[10],抑制STAT3表达对胰腺癌细胞的生长具有抑制作用[5]。以上结果提示STAT3能够促进胰腺癌的发生、发展。目前已知的STAT3抑制剂Stattic、N4、WB436B以及内源性竞争性RNA仅靶向STAT3活化的一个靶点,而BP1003是一种内部掺入针对STAT3 mRNA反义寡核苷酸的中性脂质体,其作用是在转录水平特异性抑制STAT3的表达,从而对STAT3的生物学功能实现更全面的抑制。本文将BP1003用于两种胰腺癌细胞干预实验,结果显示,BP1003抑制了两种胰腺癌细胞中的STAT3表达,但不影响STAT4和STAT6表达,表明BP1003能够特异性抑制STAT3表达。进一步进行细胞增殖和凋亡检测的结果显示,BP1003处理两种胰腺癌细胞能够显著抑制增殖、促进凋亡,表明BP1003在胰腺癌中发挥抑癌作用。
以白蛋白结合型紫杉醇为基础的化疗方案是治疗胰腺癌的常用方案,但是存在不良反应明显、有效率不高、5年生存率低的问题[16-17]。胰腺癌细胞对化疗药物耐药是影响疗效的主要原因,为解决这一问题,相关研究尝试使用尼氟酸前体、食欲素A、XPO1抑制剂与白蛋白结合型紫杉醇联合给药的方式以达到增加胰腺癌细胞对白蛋白结合型紫杉醇敏感性的目的[18-20]。本研究将BP1003用于增加胰腺癌细胞对白蛋白结合型紫杉醇的敏感性,结果显示,不同浓度的白蛋白结合型紫杉醇作用于两种胰腺癌细胞均能够抑制增殖、促进凋亡,联合使用BP1003后,白蛋白结合型紫杉醇抑制细胞增殖及促进细胞凋亡的作用均明显增强,表明BP1003能够增强白蛋白结合型紫杉醇对胰腺癌细胞的杀伤作用,提示BP1003能够增加胰腺癌细胞对白蛋白结合型紫杉醇 的敏感性。
STAT3在化疗敏感性的调控中发挥重要作用,相关研究[6,21-22]显示,敲低STAT3表达或抑制STAT3活化能够显著增加胃癌、卵巢癌、前列腺癌等多种癌细胞对化疗药物的敏感性,这与本研究中BP1003增加胰腺癌细胞对白蛋白结合型紫杉醇敏感性的结果一致,提示STAT3高表达是导致癌细胞化疗耐药的重要因素,靶向STAT3是改善化疗耐药的重要靶点。STAT3影响化疗敏感性的潜在分子生物学机制是转位进入细胞核并调控多种与增殖和凋亡相关基因的表达,包括增加Bcl-2及c-myc表达并促进细胞增殖和存活,降低Bax表达并抑制细胞凋亡[23-27]。本研究对STAT3下游蛋白的表达进行检测,结果显示,不同浓度白蛋白结合型紫杉醇作用于两种胰腺癌细胞均抑制Bcl-2及c-myc表达、增加Bax表达,联合使用BP1003后,白蛋白结合型紫杉醇抑制Bcl-2及c-myc表达、增加Bax表达的作用更为显著。 BP1003联合白蛋白结合型紫杉醇的上述调控Bcl-2、Bax及c-myc表达的作用与其调控STAT3表达及细胞增殖、凋亡的作用一致,表明BP1003增加胰腺癌细胞对白蛋白结合型紫杉醇敏感性的作用与调控下游增殖及凋亡相关基因的表达有关。
最后,本研究通过动物实验对BP1003用于胰腺癌的抗癌作用进行验证,构建胰腺癌皮下移植瘤裸鼠模型后给予BP1003及白蛋白结合型紫杉醇治疗,BP1003和白蛋白结合型紫杉醇均能缩小移植瘤体积、减轻移植瘤质量,且BP1003联合白蛋白结合型紫杉醇对移植瘤的上述作用较单用白蛋白结合型紫杉醇更为显著,表明BP1003能够增强白蛋白结合型紫杉醇对胰腺癌移植瘤的杀伤作用,提示BP1003能够增加移植瘤中胰腺癌细胞对白蛋白结合型紫杉醇的敏感性。
综上所述,本研究通过动物实验和细胞实验证实脂质体结合的反义寡核苷酸BP1003通过抑制STAT3表达增加胰腺癌细胞对白蛋白结合型紫杉醇的敏感性,这为今后在临床实践中使用BP1003改善胰腺癌患者白蛋白结合型紫杉醇化疗效果提供了理论依据。但关于STAT3在胰腺癌细胞对白蛋白结合型紫杉醇耐药中的上游调控机制尚不清楚,相关研究提示环状RNA、微小RNA等非编码RNA能够在转录后水平调控STAT3的表达,进而影响胰腺癌细胞的化疗药物敏感性。因此,今后可以对靶向调控STAT3的非编码RNA进行探索,以解析胰腺癌细胞化疗耐药过程中STAT3的上游调控机制。
第一作者:
付华,学士,主治医师。
通信作者:
周国超,硕士研究生,副主任医师。
作者贡献声明:
付华:实验开展、论文写作;周国超:实验指导、论文审校;蔡融民,宋新:数据收集、录入及统计学处理;杨定华:试剂采购。
[参考文献]
[1] HUANG J J, LOK V, NGAI C H, et al. Worldwide burden of, risk factors for, and trends in pancreatic cancer[J]. Gastroenterology, 2021, 160(3): 744-754.
[2] 刘永鹏, 张晶晶, 任 艳, 等. 1990—2019年中国胰腺癌疾病负担变化趋势研究[J]. 现代预防医学, 2022, 49(17): 3079-3085.
LIU Y P, ZHANG J J, REN Y, et al. Trends of disease burden of pancreatic cancer in China, 1990: 2019[J]. Mod Prev Med, 2022, 49(17): 3079-3085.
[3] BODEKER K L, SMITH B J, BERG D J, et al. A randomized trial of pharmacological ascorbate, gemcitabine, and nabpaclitaxel for metastatic pancreatic cancer[J]. Redox Biol, 2024, 77: 103375.
[4] JIN M, LIU H L, XUE J, et al. Nab-paclitaxel plus S-1 versus nab-paclitaxel plus gemcitabine in patients with advanced pancreatic cancer: a multicenter, randomized, phase II study[J]. Oncologist, 2024, 29(10): e1406-e1418.
[5] BLASZCZAK W, WHITE B, MONTERISI S, et al. Dynamic IL-6R/STAT3 signaling leads to heterogeneity of metabolic phenotype in pancreatic ductal adenocarcinoma cells[J]. Cell Rep, 2024, 43(1): 113612.
[6] DING L Y, WANG Q W, MARTINCUKS A, et al. STING agonism overcomes STAT3-mediated immunosuppression and adaptive resistance to PARP inhibition in ovarian cancer[J]. J Immunother Cancer, 2023, 11(1): e005627.
[7] ZHU Z Y, XIANG Q, LI S Q, et al. Serine/threonine kinase 16 phosphorylates STAT3 and confers a JAK2-inhibition resistance phenotype in triple-negative breast cancer[J]. Biochem Pharmacol, 2024, 225: 116268.
[8] GAGLIARDI M, KEAN R, DAI B B, et al. BP1003 decreases STAT3 expression and its pro-tumorigenic functions in solid tumors and the tumor microenvironment[J]. Biomedicines, 2024, 12(8): 1901.
[9] 李 静, 王志芬, 张晓慧, 等. 阿帕替尼与白蛋白结合型紫杉醇在MDA-MB-231乳腺癌细胞系中的协同抗癌作用[J]. 中华细胞与干细胞杂志(电子版), 2021, 11(2): 90-98.
LI J, WANG Z F, ZHANG X H, et al. Synergistic anticancer effects of apatinib and nab-paclitaxel in MDA-MB-231 breast cancer cell line[J]. Chin J Cell Stem Cell Electron Ed, 2021, 11(2): 90-98.
[10] AL-HETTY H R A K, ABDULAMEER S J, ALKUBAISY S A, et al. STAT3 signaling in pancreatic ductal adenocarcinoma: a candidate therapeutic target[J]. Pathol Res Pract, 2023, 245: 154425.
[11] CHEN H, BIAN A W, YANG L F, et al. Targeting STAT3 by a small molecule suppresses pancreatic cancer progression[J]. Oncogene, 2021, 40(8): 1440-1457.
[12] CHEN H, ZHOU W B, BIAN A W, et al. Selectively targeting STAT3 using a small molecule inhibitor is a potential therapeutic strategy for pancreatic cancer[J]. Clin Cancer Res, 2023, 29(4): 815-830.
[13] GUO H C, XIAO Y Y, YUAN Z W, et al. Inhibition of STAT3Y705 phosphorylation by stattic suppresses proliferation and induces mitochondrial-dependent apoptosis in pancreatic cancer cells[J]. Cell Death Discov, 2022, 8(1): 116.
[14] HE Y, HAN P Y, CHEN C, et al. circPTPN22 attenuates immune microenvironment of pancreatic cancer via STAT3 acetylation[J]. Cancer Gene Ther, 2023, 30(4): 559-566.
[15] HE Z W, WANG J, ZHU C H, et al. Exosome-derived FGD5- AS1 promotes tumor-associated macrophage M2 polarizationmediated pancreatic cancer cell proliferation and metastasis[J]. Cancer Lett, 2022, 548: 215751.
[16] LIU H N, PAN D, YAO Z Y, et al. Efficacy and safety of gemcitabine/nab-paclitaxel combined with anlotinib and PD-1 inhibitors as a first-line treatment for advanced pancreatic cancer[J]. Int Immunopharmacol, 2024, 139: 112635.
[17] GIORDANO G, MILELLA M, LANDRISCINA M, et al. Prognostic analysis and outcomes of metastatic pancreatic cancer patients receiving nab-paclitaxel plus gemcitabine as second or later-line treatment[J]. Cancer Med, 2024, 13(12): e7345.
[18] AGOSTINI A, GUERRIERO I, PIRO G, et al. Talniflumate abrogates mucin immune suppressive barrier improving efficacy of gemcitabine and nab-paclitaxel treatment in pancreatic cancer[J]. J Transl Med, 2023, 21(1): 843.
[19] UDDIN M H, AL-HALLAK M N, KHAN H Y, et al. Molecular analysis of XPO1 inhibitor and gemcitabine-nab-paclitaxel combination in KPC pancreatic cancer mouse model[J]. Clin Transl Med, 2023, 13(12): e1513.
[20] VOISIN T, NICOLE P, GRATIO V, et al. The orexin-A/OX1R system induces cell death in pancreatic cancer cells resistant to gemcitabine and nab-paclitaxel treatment[J]. Front Oncol, 2022, 12: 904327.
[21] OUYANG S M, LI H X, LOU L L, et al. Inhibition of STAT3- ferroptosis negative regulatory axis suppresses tumor growth and alleviates chemoresistance in gastric cancer[J]. Redox Biol, 2022, 52: 102317.
[22] SADRKHANLOO M, PASKEH M D A, HASHEMI M, et al. STAT3 signaling in prostate cancer progression and therapy resistance: an oncogenic pathway with diverse functions[J]. Biomed Pharmacother, 2023, 158: 114168.
[23] SINGH S, GOMEZ H J, THAKKAR S, et al. Overcoming acquired drug resistance to cancer therapies through targeted STAT3 inhibition[J]. Int J Mol Sci, 2023, 24(5): 4722.
[24] HSIEH Y C, DAI Y C, CHENG K T, et al. Blockade of the SRC/ STAT3/BCL-2 signaling axis sustains the cytotoxicity in human colorectal cancer cell lines induced by dehydroxyhispolon methyl ether[J]. Biomedicines, 2023, 11(9): 2530.
[25] LIU J S, YEH C A, HUANG I C, et al. Signal transducer and activator of transcription 3 mediates apoptosis inhibition through reducing mitochondrial ROS and activating Bcl-2 in gemcitabine-resistant lung cancer A549 cells[J]. J Cell Physiol, 2021, 236(5): 3896-3905.
[26] XIANG X X, YUAN D, LIU Y, et al. PIM1 overexpression in T-cell lymphomas protects tumor cells from apoptosis and confers doxorubicin resistance by upregulating c-myc expression[J]. Acta Biochim Biophys Sin (Shanghai), 2018, 50(8): 800-806.
[27] YU S, GONG L S, LI N F, et al. Galangin (GG) combined with cisplatin (DDP) to suppress human lung cancer by inhibition of STAT3-regulated NF-κB and Bcl-2/Bax signaling pathways[J]. Biomed Pharmacother, 2018, 97: 213-224.
猜你喜欢
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)