首页 > 医疗资讯/ 正文
动脉粥样硬化(AS)是一种慢性炎症性动脉疾病,M1巨噬细胞活化及增殖是AS发生发展的关键核心。与此同时,M1巨噬细胞活化及增殖可再激活端粒酶活性,并与NF-κB信号通路建立正反馈通路,从而促进其促炎介质的表达,加剧其介导的炎症反应,加速AS进展。然而,如何精准靶向调控AS斑块中M1巨噬细胞的端粒酶活性,成为研究的重点和难点。
2025年3月16日,深圳市人民医院超声科徐金锋、刘莹莹教授研究团队联合广东省人民医院心血管病研究所费洪文教授团队在Materials Today Bio杂志在线发表题为“Dual-Targeted Microbubbles for Atherosclerosis Therapy: Inducing M1 Macrophage Apoptosis by Inhibiting Telomerase Activity”的研究论文,开发了一种基于双靶向微泡药物递送系统(Ab-MMB1532)的动脉粥样硬化治疗新方法,该系统具备CD86抗体主动靶向作用和外置磁场响应性,可精准靶向至斑块区域M1巨噬细胞,通过超声介导端粒酶抑制剂BIBR1532释放入胞,进而抑制TERT/NF-κB信号轴触发M1巨噬细胞凋亡,最终显著延缓了动脉粥样硬化进展。

研究团队采用“双乳蒸发法”制备了载BIBR1532的磁性微泡(MMB1532),后通过“静电吸附法”将CD86加载至MMB1532表面,最终合成了Ab-MMB1532。随后通过SEM、TEM、DLS、VSM、Confocal等方法对其进行表征,结果显示成功合成了Ab-MMB1532,并且可在体内、外条件下保持相对稳定(图1)。
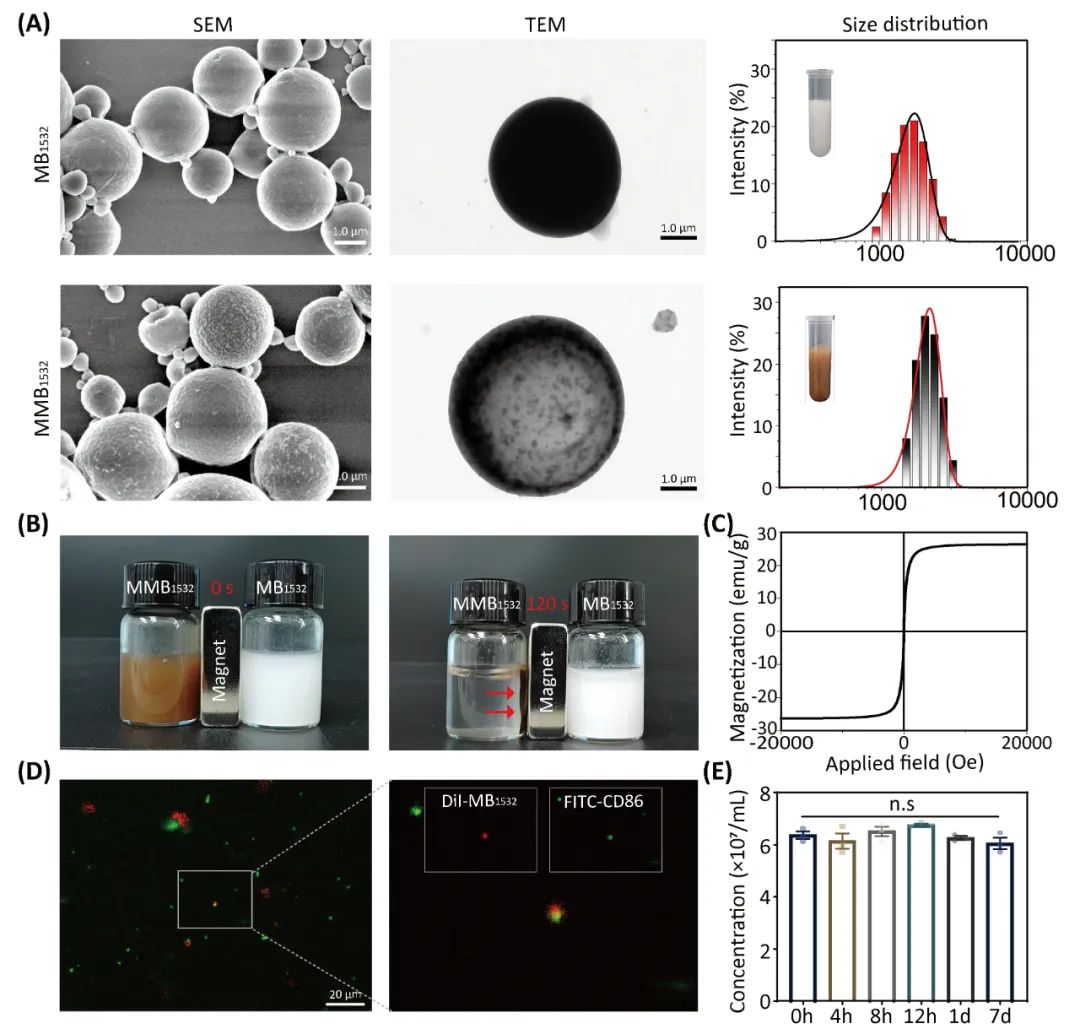
图1. Ab-MMB1532的制备与表征
随后研究团队重点考察了端粒酶抑制剂BIBR1532对于M1巨噬细胞的生物学效应,结果显示,其端粒酶逆转录酶(TERT) mRNA和蛋白表达、以及端粒酶的活性和长度具有浓度依赖性,尤其当BIBR1532浓度为30μM时,M1巨噬细胞的TERT mRNA和蛋白表达以及端粒酶的活性和长度均达到相对最低状态(图2)。
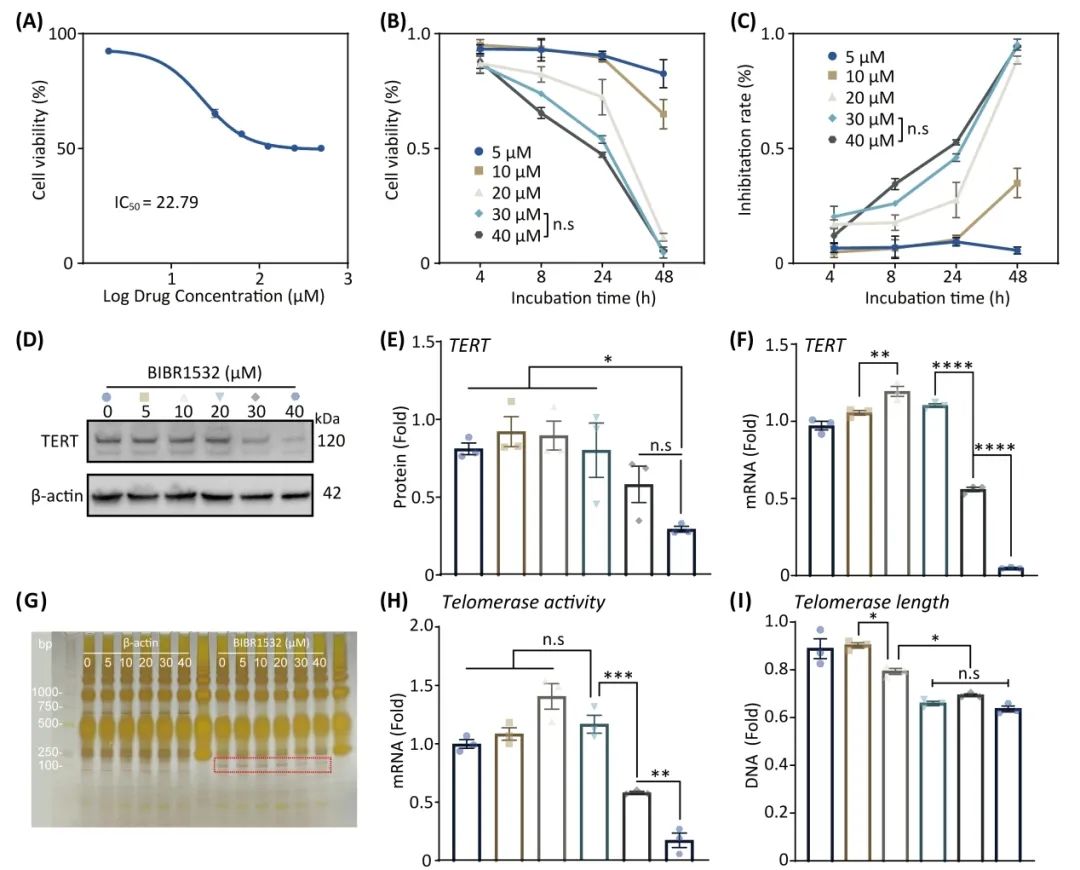
图2. BIBR1532对M1巨噬细胞的生物学效应
通过转录及代谢组学研究发现,BIBR1532对于M1巨噬细胞的生物学效应是通过抑制TERT/NF-κB信号轴,促进细胞凋亡实现的(图3)。
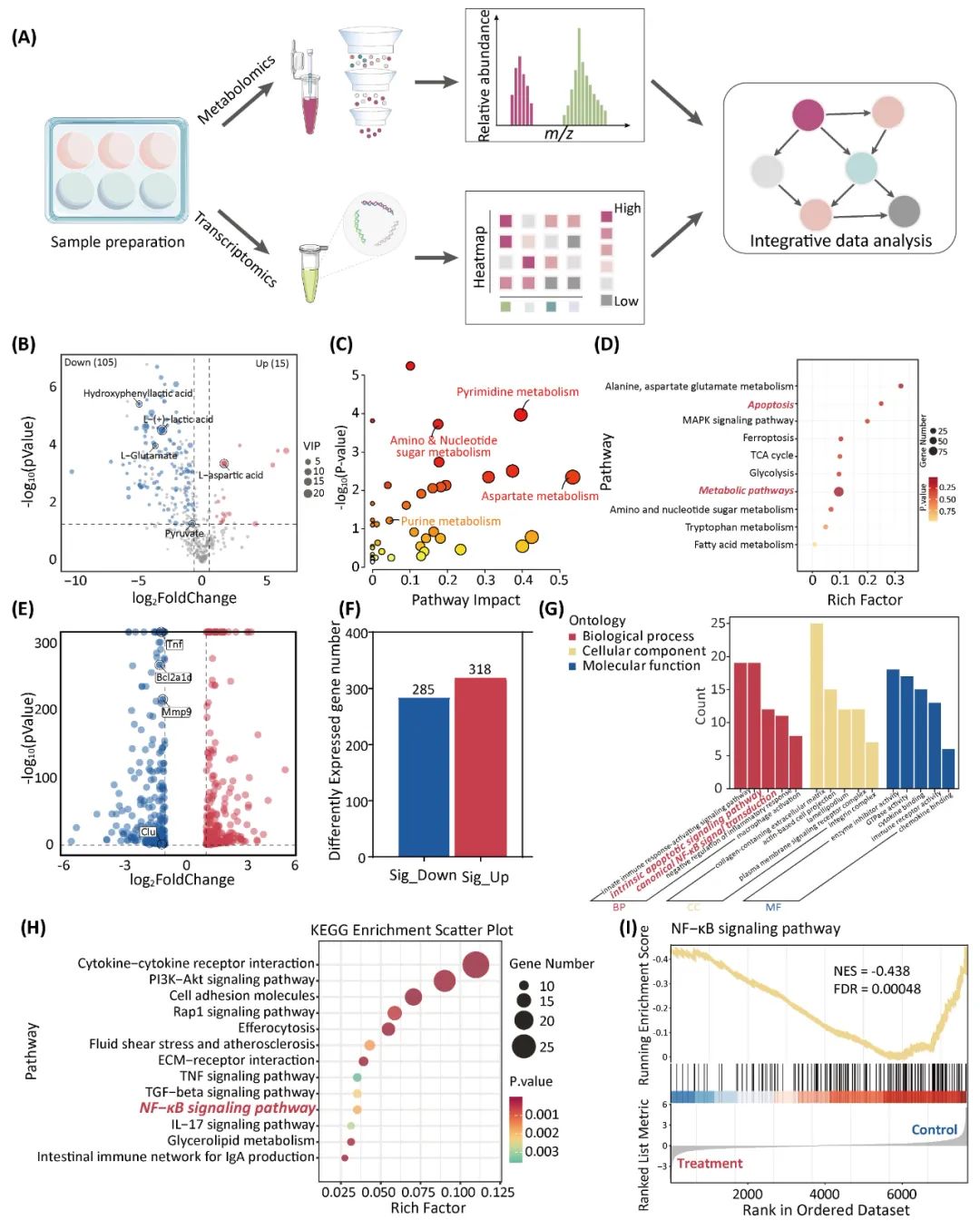
图3. BIBR1532对M1巨噬细胞的转录及代谢组学特征
此外,研究团队通过平行板流动腔和小动物活体成像考察了Ab-MMB1532体内、外靶向性能。研究结果显示,相较于磁性单靶(MMB1532)、抗体单靶(Ab-MB1532)和无靶(MB1532),双靶Ab-MMB1532在各剪切力下均展现最强靶向性能,尤其在高剪切力下(48 dyn/cm2)双靶组的靶向优势更为显著。体内小动物活体成像也证实了Ab-MMB1532的优秀在体靶向性能(图4)。
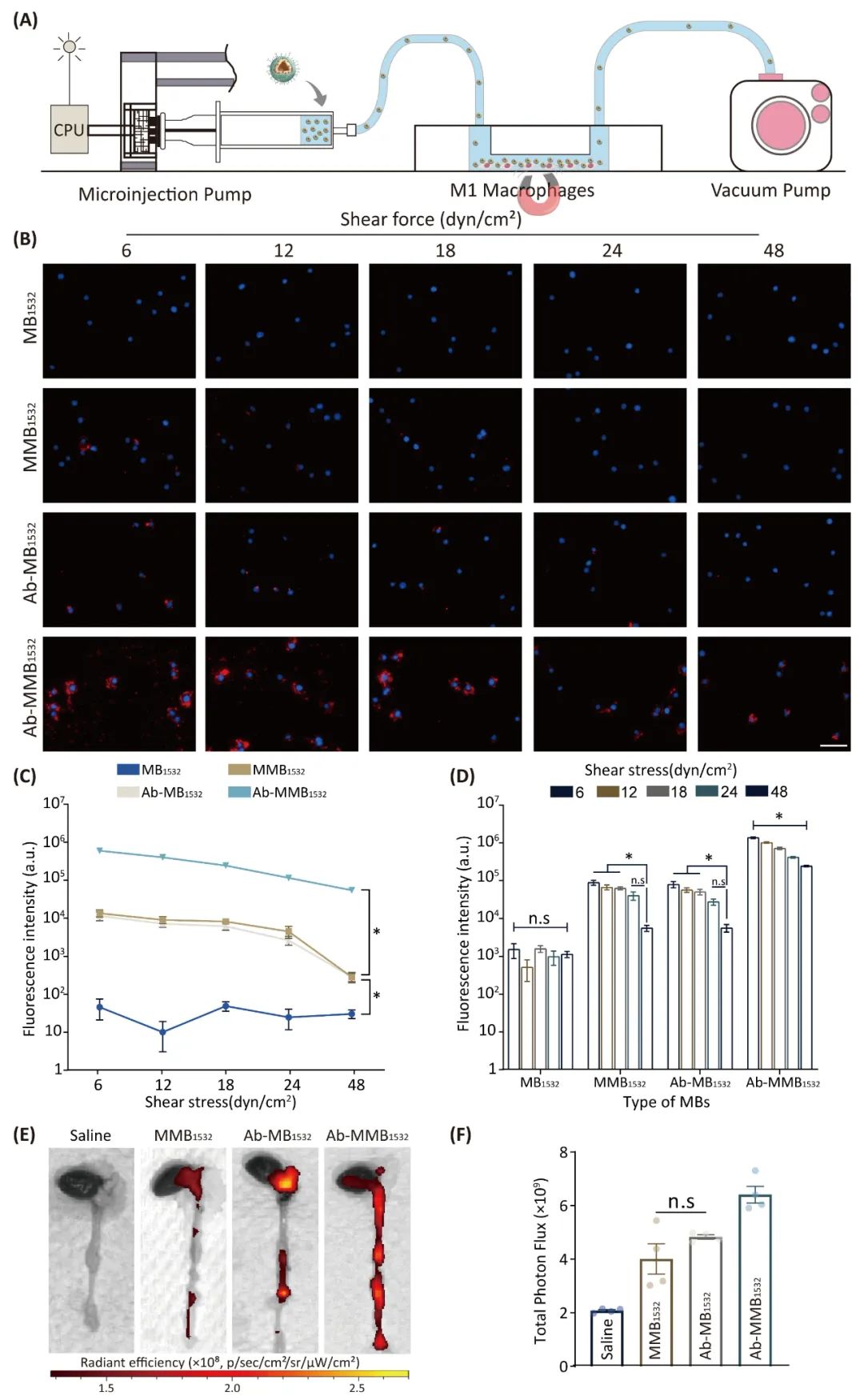
图4. Ab-MMB1532体外及体内斑块靶向性能
最后,研究团队对双靶向Ab-MMB1532的体内抗AS性能进行评估。研究结果显示,与对照组相比,Ab-MMB1532组表现出最显著的治疗效果:斑块面积减少了74.6%,脂质沉积减少了81.2% 。并且通过对病变区域巨噬细胞的监测发现,这种效果是通过显著减少斑块内浸润的巨噬细胞,尤其是M1巨噬细胞实现的(图5)。
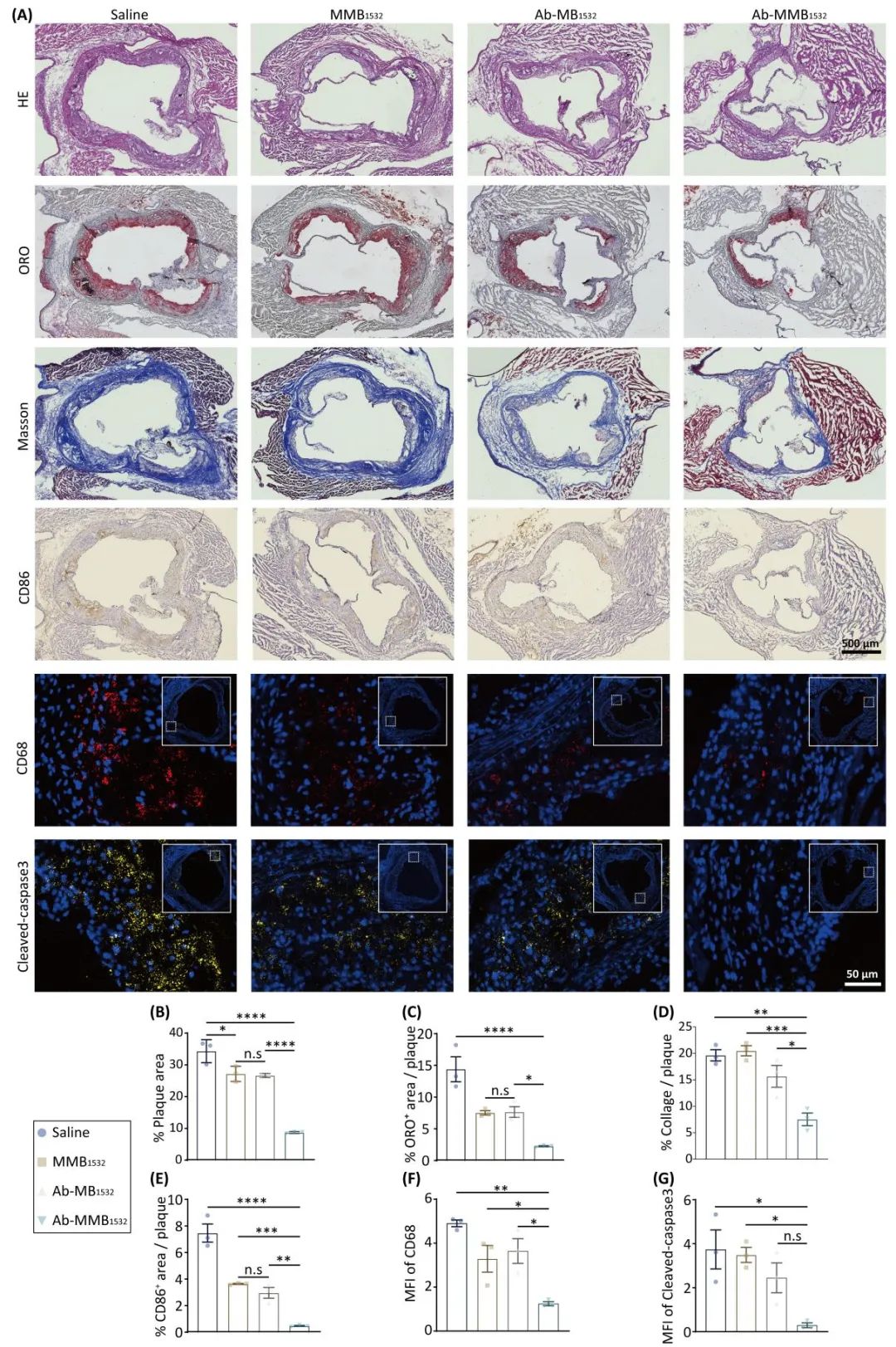
图5. Ab-MMB1532体内抗AS性能
综上,本研究开发了一种双靶向微泡药物递送系统,该系统有效识别并靶向AS斑块区域的M1巨噬细胞,进行特异性药物递送。值得注意的是,超声触发Ab-MMB1532释放的BIBR1532可通过抑制TERT/NF-κB信号轴,促进M1巨噬细胞凋亡,从而达到治疗AS的效果(图6)。可以预见,这种具有双靶向功能的新型微泡药物递送系统在治疗AS方面具有潜在的应用价值。
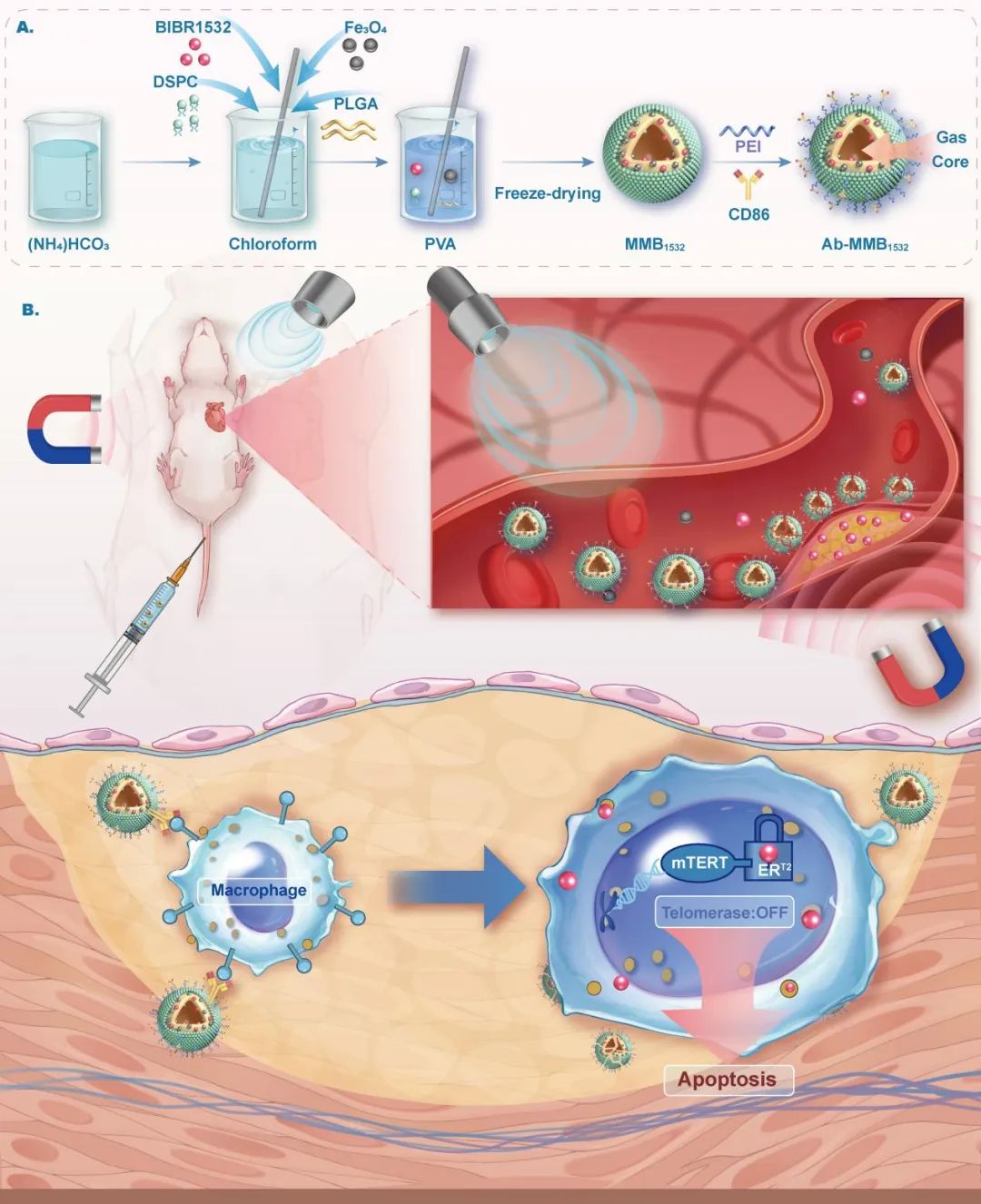
图6. 本文研究示意图
原文链接:
https://doi.org/10.1016/j.mtbio.2025.101675
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)