首页 > 医疗资讯/ 正文
论坛导读:帕金森病(Parkinson's disease, PD)是一种复杂的神经退行性疾病,其发病机制尚未完全阐明。近年来,研究者提出了"体优先"(body-first)和"脑优先"(brain-first)两种假说来解释PD的异质性发病模式。研究表明,体优先型PD可能起源于周围自主神经系统,随后向中枢神经系统扩散;而脑优先型PD则可能始于脑内特定核团,表现出不同的病理进程和临床症状。理解这两种发病途径的差异将有助于开发更精准的诊断方法和靶向治疗策略。
帕金森病是全球第二大神经退行性疾病,影响着1%-2%的65岁以上人群。传统观点认为PD主要源于黑质多巴胺能神经元的退行性变,导致运动症状如静止性震颤、运动迟缓和肌强直。然而,越来越多的证据表明PD具有显著的临床和病理异质性,非运动症状如快速眼动睡眠行为障碍(RBD)、自主神经功能障碍和认知损害在疾病早期即可出现,且在不同患者中表现各异。
近年来,基于α-突触核蛋白病理的传播模式和临床症状出现顺序,研究者提出了PD发病的"双通路"模型——"体优先"(body-first)和"脑优先"(brain-first)假说。这一模型为理解PD的复杂发病机制提供了新视角,可能解释为何不同患者在症状表现、疾病进展和治疗反应上存在显著差异。
体优先与脑优先假说的理论基础
病理学基础:α-突触核蛋白的传播模式
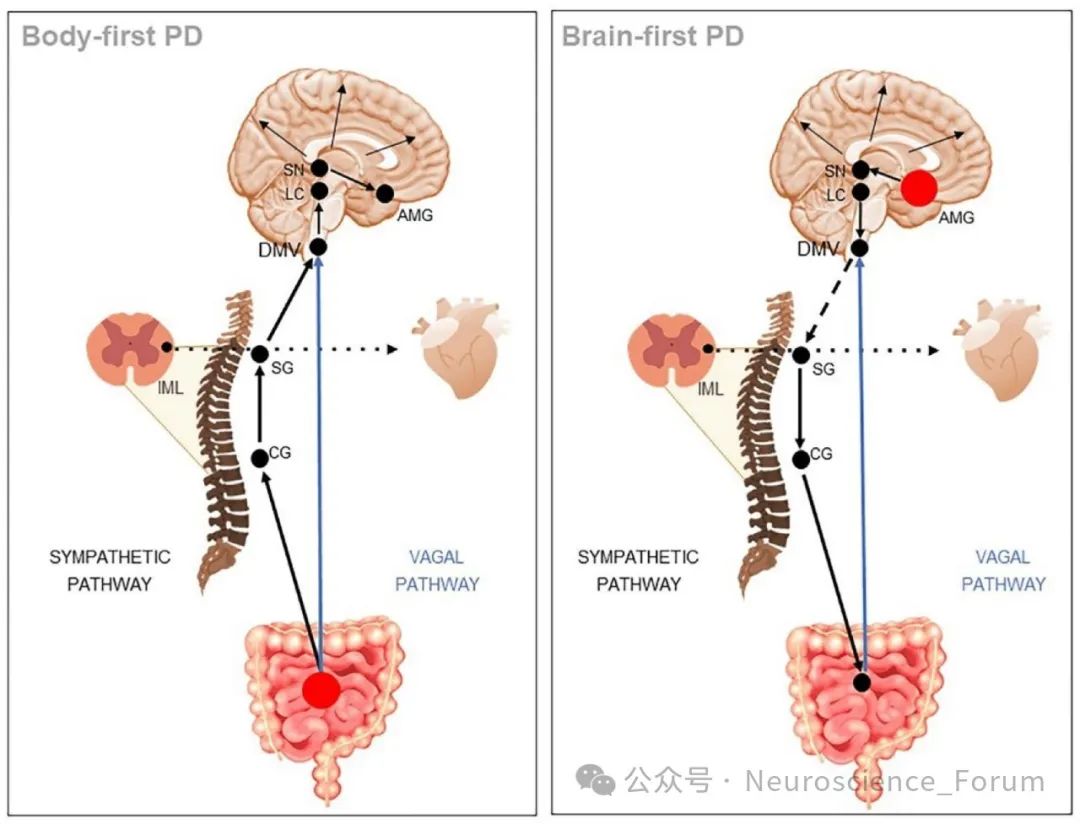
PD的主要病理特征是中枢神经系统内路易小体(Lewy bodies)和路易突触(Lewy neurites)的形成,其主要成分为错误折叠的α-突触核蛋白。Braak分期系统根据α-突触核蛋白病理的分布将PD进程分为六个阶段,提出病理可能始于延髓(包括迷走神经背核)或嗅球,随后向更高级脑区扩散。这一观察支持了病理可能从周围神经系统向中枢神经系统传播的观点,成为体优先假说的基础。
相反,脑优先假说则认为α-突触核蛋白病理可能首先出现在脑内特定核团(如黑质或蓝斑),随后向其他脑区和周围神经系统扩散。这种差异可能源于不同的病理触发因素或个体易感性,导致α-突触核蛋白以不同的"起点"开始其病理进程。
神经影像学证据
近年来,先进的神经影像学技术为区分体优先和脑优先型PD提供了重要工具。研究表明体优先型PD患者常表现出更显著的自主神经功能障碍,在心脏间碘苄胍(MIBG)闪烁扫描中显示心脏交感神经去神经支配,而在脑多巴胺转运体(DAT)扫描中纹状体多巴胺能神经元丢失相对较轻。脑优先型PD患者则表现出相反的模式:早期即有明显的纹状体多巴胺能神经元丢失,但心脏MIBG摄取相对保留。正电子发射断层扫描(PET)研究也发现,脑优先型PD患者常表现出更广泛和严重的脑代谢异常模式。
临床症状差异
临床观察发现,体优先和脑优先型PD患者在症状出现顺序和表现上存在系统性差异。体优先型PD患者通常在运动症状出现前多年就有明显的自主神经功能障碍(如便秘、体位性低血压)和RBD。这些症状反映了周围自主神经系统和脑干结构的早期受累。脑优先型PD患者则更可能以不对称的运动症状起病,非运动症状出现较晚且程度较轻。这类患者认知功能障碍可能更为突出,反映了皮层和边缘系统的早期受累。
体优先型PD的特征
体优先假说认为PD病理始于周围自主神经系统,特别是胃肠道的肠神经系统(ENS)。这一观点得到以下证据支持:迷走神经提供了ENS与脑干之间的直接神经连接,可能成为病理蛋白向中枢传播的通道。尸检研究发现,接受过迷走神经切断术的患者PD发病率降低,间接支持这一传播途径。病理学研究在PD早期甚至临床前期,ENS中即可检测到α-突触核蛋白病理。这些异常蛋白可能通过细胞间传播机制,经突触连接从周围神经系统向中枢神经系统扩散。动物模型在转基因小鼠模型中,将错误折叠的α-突触核蛋白注射到胃肠道壁后,可观察到病理蛋白沿迷走神经向脑干传播的现象。
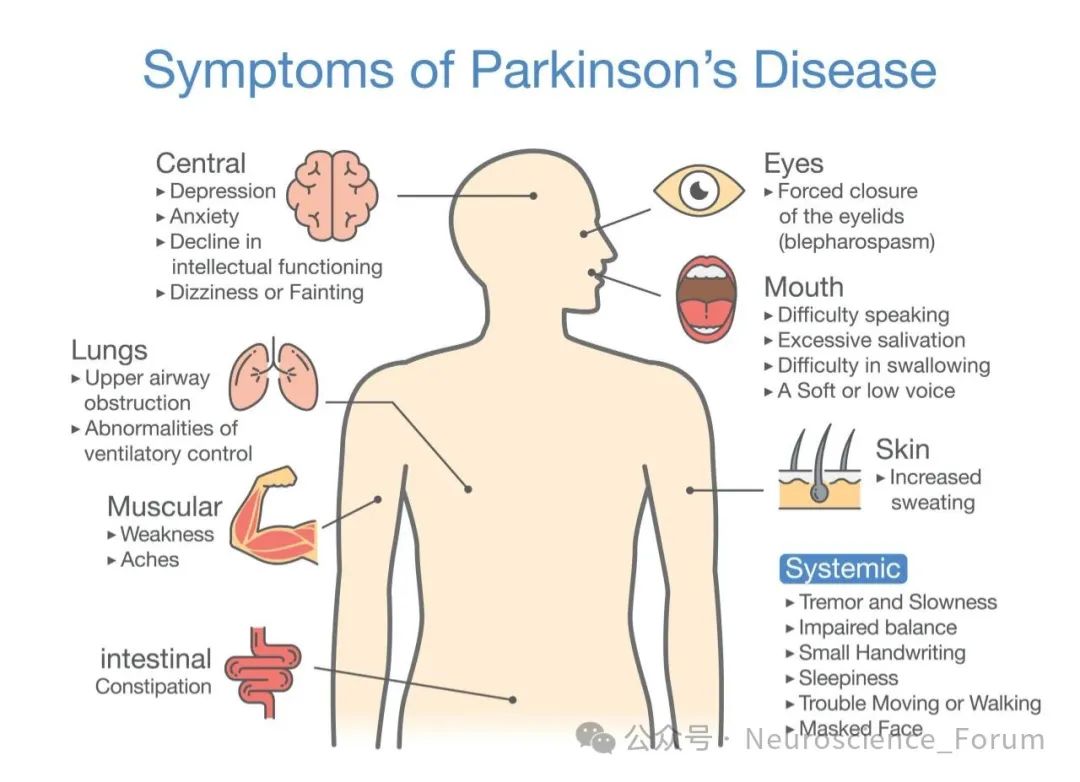
体优先型PD典型临床特征包括前驱症状常在运动症状出现前10-20年就有便秘、嗅觉障碍等表现。RBD是体优先型PD的高度特异性前驱标志,约80%的孤立性RBD患者最终发展为PD或其他突触核蛋白病。自主神经功能障碍包括严重的体位性低血压、泌尿系统症状和性功能障碍。心脏交感神经去神经支配是体优先型PD的特征性表现,可通过MIBG闪烁扫描检测。运动症状通常表现为相对对称的帕金森综合征,进展较慢。震颤可能不如脑优先型PD明显,而姿势不稳和步态障碍可能更突出。认知和精神症状:执行功能障碍和视空间能力损害可能更明显,反映了边缘系统和皮层区域的受累。抑郁和焦虑症状也较为常见。
体优先型PD的生物标志物研究主要集中在周围神经系统的病理标志物皮肤活检检测周围神经纤维中的α-突触核蛋白沉积显示出较高的诊断特异性。唾液腺活检也有类似价值。自主神经功能检测心率变异性分析、倾斜试验和定量泌汗轴突反射测试可客观评估自主神经功能损害程度。肠道微生物组特征研究发现体优先型PD患者肠道菌群组成与健康对照存在显著差异,某些菌种的变化可能与疾病发生发展相关。
脑优先型PD的特征
脑优先假说认为PD病理始于脑内特定核团,可能的起始部位包括:黑质致密部多巴胺能神经元的早期丢失导致典型的运动症状。病理可能从黑质向基底神经节其他区域和皮层扩散。蓝斑去甲肾上腺素能神经元的早期受累可能解释脑优先型PD患者的情绪和认知症状。蓝斑病理可能向边缘系统和皮层传播。杏仁核和边缘系统早期情绪调节障碍和认知症状提示这些区域的早期受累。与体优先型不同,脑优先型PD的α-突触核蛋白病理可能主要通过神经元之间的连接在脑内传播,而非从周围神经系统传入。
脑优先型PD的典型临床特征包括:运动症状常以明显不对称的静止性震颤、运动迟缓和肌强直起病。症状不对称性通常持续较长时间,反映了病理起始的单侧性。非运动症状认知功能障碍可能更突出,特别是在执行功能和工作记忆方面。情绪障碍如抑郁和淡漠也较为常见。自主神经功能障碍通常出现较晚且程度较轻。心脏MIBG扫描可能显示相对保留的交感神经支配。对多巴胺能药物治疗反应通常较好,但更容易出现运动并发症如异动症和症状波动。
脑优先型PD的神经影像学特征包括DAT扫描显示更明显和不对称的纹状体多巴胺能神经元丢失,尤其在疾病早期。fMRI和PET研究显示更广泛的脑功能连接异常和代谢改变,涉及基底神经节-丘脑-皮层环路。结构MRI可能显示更明显的皮层变薄和脑萎缩模式,特别是在前额叶和边缘系统区域。
治疗策略的潜在差异
理解PD的这两种亚型可能指导更个体化的治疗:体优先型PD需更积极管理自主神经功能障碍,如体位性低血压。早期干预RBD可能延缓疾病进展,针对周围神经系统的治疗策略可能有特殊价值,肠道菌群调节可能成为潜在干预手段。而脑优先型PD多巴胺能药物优化更为关键,需更早关注认知功能障碍的评估和干预,神经保护策略可能针对特定脑区和环路,经颅磁刺激等脑靶向治疗可能更有价值。
区分这两种PD亚型对研究具有多重意义,病因学研究可能反映不同的环境危险因素和遗传背景。体优先型PD可能与肠道炎症、环境毒素暴露更相关;脑优先型PD则可能与脑特异性损伤因素更相关。疾病修饰治疗开发针对不同传播途径和病理起始部位设计特异性干预措施。临床试验设计在患者分层和结局评估中考虑亚型差异,提高试验敏感性和特异性。
争议与未来研究方向
尽管体优先和脑优先假说为理解PD异质性提供了有用框架,但仍存在诸多争议和未解问题:PD可能是一个疾病谱而非截然分开的两种亚型。更复杂的分类系统可能需要考虑更多的临床和病理变量。病理传播的确切机制α-突触核蛋白病理在体内传播的具体细胞和分子机制仍需阐明。不同传播途径是否涉及不同的蛋白构象或修饰?两种亚型是否由不同的遗传或环境因素触发?基因-环境相互作用如何影响发病途径的选择?动物模型需要开发更准确地模拟两种PD亚型的动物模型,以研究机制和测试治疗干预。
未来研究应关注以下方向:前驱期生物标志物开发能够区分两种亚型的高灵敏度、高特异性早期诊断工具。纵向队列研究建立包含详细临床、影像学和生物标志物数据的前瞻性队列,追踪两种亚型的自然史。靶向治疗策略基于亚型特异性病理机制开发精准治疗,如针对周围神经系统或特定脑环路的干预。预防策略针对高风险个体(如RBD患者)开展基于亚型特征的预防性干预研究。
结论
帕金森病的体优先和脑优先假说为理解这种复杂疾病的异质性提供了有价值的框架。越来越多的证据支持存在两种不同的病理传播途径:一种始于周围自主神经系统(体优先),另一种始于脑内特定核团(脑优先)。这两种亚型在临床症状、病理特征、影像学表现和疾病进展上存在系统性差异。识别这些差异不仅有助于更准确的诊断和预后评估,也将指导开发更有针对性的治疗策略。未来研究应致力于阐明两种亚型的分子机制差异,开发亚型特异性生物标志物,并探索精准医学在PD管理中的应用。最终,理解PD的异质性本质将使我们更接近疾病修饰治疗的目标,为不同亚型患者提供更个体化的医疗照护。
参考文献
-
Passaretti M, et al. Clinical progression and genetic pathways in body-first and brain-first Parkinson's disease. Mol Neurodegener. 2025 Jun 20;20(1):74. doi: 10.1186/s13024-025-00866-5.
-
Horsager J, et al. Brain-first versus body-first Parkinson's disease: a multimodal imaging case-control study. Brain. 2020 Oct 1;143(10):3077-3088. doi: 10.1093/brain/awaa238.
-
Lee JY,et al. Distinct gut microbiome characteristics and dynamics in patients with Parkinson's disease based on the presence of premotor rapid-eye movement sleep behavior disorders. Microbiome. 2025 Apr 30;13(1):108. doi: 10.1186/s40168-025-02095-w.
-
Kim MS, et al. Correction: Gastric emptying time and its correlation with cardiac MIBG in body-first and brain-first subtype Parkinson's disease. J Neurol. 2025 Apr 21;272(5):352. doi: 10.1007/s00415-025-12953-0. Erratum for: J Neurol. 2024 Dec 12;272(1):28. doi: 10.1007/s00415-024-12783-6.
-
Qin K, et al. Divergent amygdala function in proposed brain-first and body-first Parkinson's disease: a resting-state functional magnetic resonance imaging study. J Affect Disord. 2025 Aug 1;382:123-130. doi: 10.1016/j.jad.2025.04.063.
-
Schröter N, et al. Amygdala neurodegeneration differentiates brain-first and body-first Parkinson's disease: An MRI study. Parkinsonism Relat Disord. 2025 Jun;135:107827. doi: 10.1016/j.parkreldis.2025.107827.
-
Velucci V, et al. The natural history of body-first versus brain-first Parkinson's disease subtypes. J Neurol. 2025 Apr 9;272(5):325. doi: 10.1007/s00415-025-13050-y.
-
Li S, et al. Plasma GFAP and NfL associate with cerebral glucose metabolism in putative brain-first and body-first Parkinson's disease subtypes. NPJ Parkinsons Dis. 2025 Mar 22;11(1):54. doi: 10.1038/s41531-025-00898-0.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)