首页 > 医疗资讯/ 正文
肾细胞癌(RCC)根据细胞形态学主要分为透明细胞肾癌(ccRCC)和非透明细胞肾癌(nccRCC)。乳头状肾细胞癌是nccRCC中最常见的亚型,约占全部RCC的10-20%。相比于ccRCC,pRCC临床发病率低,异质性强,且中晚期患者预后差,难以早期准确诊断,且常被误分类。现有依赖于影像学和侵入性组织活检的诊断与分期方法存在局限。先进的质谱蛋白质组技术为识别疾病特异性血浆蛋白提供可能,量化大量蛋白表达差异,有望发现新的非侵入性生物标志物,辅助临床精准诊断和预后评估,弥补现有检测短板。

由复旦大学团队牵头完成的发表在Journal of Hematology & Oncology杂志的一项研究,针对低发病率且异质性大的非透明细胞肾细胞癌中最常见的乳头状肾细胞癌(pRCC),基于非侵入性血浆样本,采用先进的质谱蛋白质组学技术,采集了涵盖713例患者的三组独立队列样本,系统建立并验证了多个基于蛋白质组的机器学习预测模型。这些模型不仅实现了肾细胞癌亚型的准确诊断,同时覆盖了TNM分期并提供了无进展生存的动态风险预测,有望推动pRCC临床转化管理,促进早期诊断和个体化治疗策略的制定。
研究结果
1,研究设计与样本概况
本研究共纳入三大队列:479例发现队列,140例时间独立验证队列,94例外部独立验证队列。涵盖pRCC、ccRCC、chRCC患者以及健康对照人群。详细样本量分布如下:
此外,对于15例pRCC患者配对肿瘤及邻近正常组织进行了蛋白组分析,以比较组织与血浆蛋白表达的一致性。
2,RCC亚型诊断模型的开发与验证
通过机器学习流程筛选16种低共线性蛋白质作为特征输入,采用多种分类算法训练模型,模型在发现队列通过自助法(bootstrap)评估表现优异,主指标包括AUROC、平衡准确率、召回率、精确率及F1值均表现稳定优良。
模型对样本比例进行校正,更贴合真实流行病学结构,表现依然稳健,显示宏平衡(macro-average)、微平均(micro-average)和加权平均(weighted-average)AUROC均超0.95。重训练后,模型在独立时间与外部验证队列亦表现卓越,AUROC分别超过0.9,平均精确度AP约为0.91与0.88,各分类AP均高于0.8,证明模型优异的泛化能力。
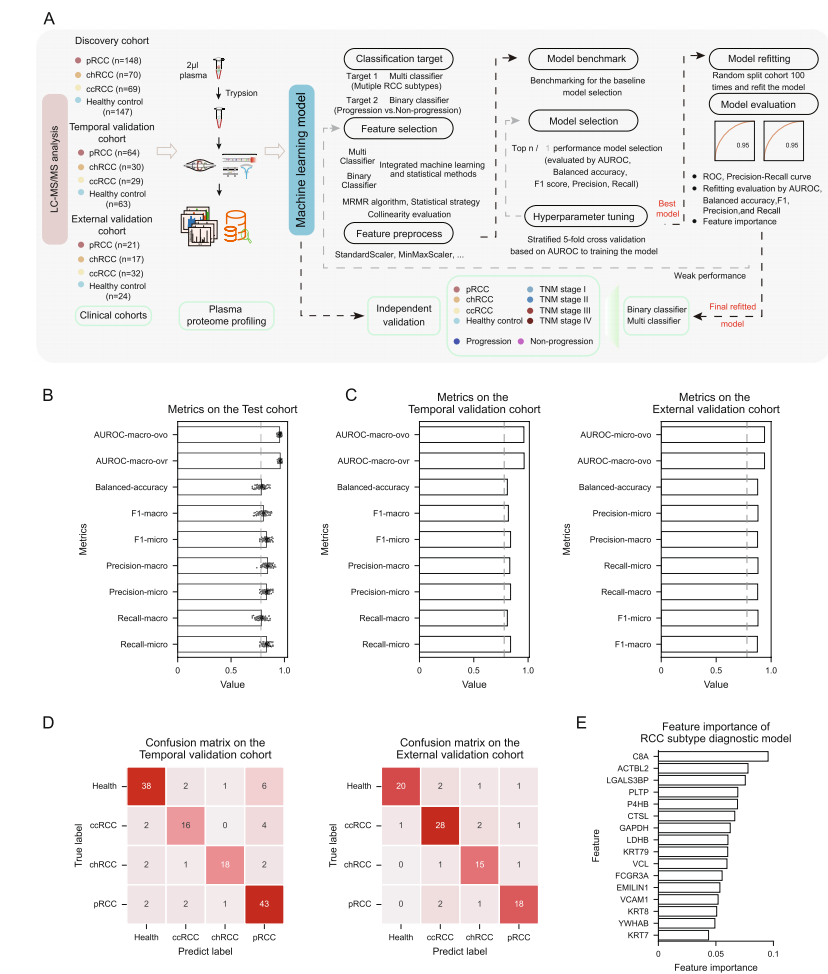
图:研究设计流程(A)、模型性能多指标评估(B)、两个独立验证队列上的表现(C、D)及16个蛋白标志物的重要性排名(E)
3,组织与血浆蛋白表达一致性验证
肿瘤及邻近正常组织蛋白组分析证实,多数重要蛋白在组织及血浆中的表达趋势一致,增强了血浆蛋白质组作为非侵入性诊断材料的可靠性(Fig.S4)。
4,TNM分期诊断模型
鉴于TNM分期是pRCC临床治疗决策的核心,研究团队依托血浆蛋白组数据构建分期诊断模型。该模型在发现及验证队列均表现达AUROC >0.90(Fig.S5D、S5E),为现有侵入性或影像学分期提供了有力的非侵入式补充手段。
5,pRCC无进展生存(PFS)时间点“时间钟”进展预测模型
针对pRCC高恶性及较差预后特点,研发了基于临床血常规指标及蛋白质组特征,分时点(2、3、4、5年)预测患者无进展生存状态的时间钟模型(Fig.2A)。在发现队列,所有时间点预测AUROC及AP均超过0.89,经bootstrap检验稳健性强(Fig.S6、S7)。独立时间验证队列中,模型表现进一步提升,各时间点AUROC和AP皆超过0.9,混淆矩阵显示精准分类(Fig.2B-D)。特征分析揭示了预测中的关键蛋白及临床指标,反映模型的生物学合理性(Fig.2E)。
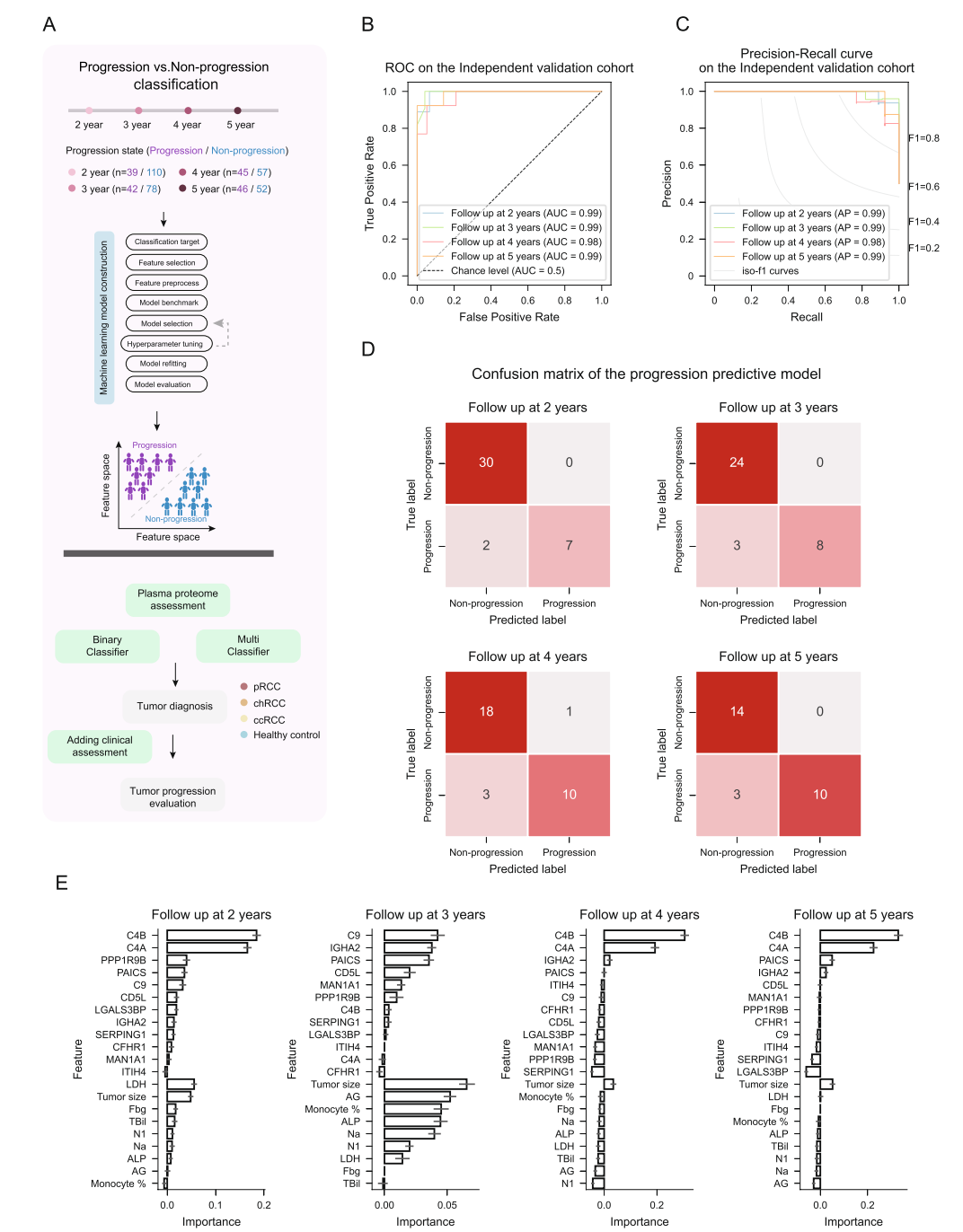
图:复旦团队构建的肾细胞癌亚型区分模型
综上,本研究首创性地整合大规模血浆蛋白质组数据及临床指标,结合机器学习技术,系统构建了一套包括肾细胞癌亚型诊断、TNM分期判断及PFS风险动态预测的多层次临床辅助模型。这一系列模型性能优越、稳定性好,并在多个独立队列中验证,显示出极高的临床转化潜力。
精准区分pRCC、ccRCC和chRCC亚型,有助于避免误诊误治,指导不同亚型的个性化治疗;TNM分期模型辅助非侵入性快速评估癌症进展阶段,免除部分患者侵入性活检与昂贵成像;时间钟模型对pRCC患者无进展生存预测提供实时动态监测工具,有望提升临床随访效率和调整治疗方案的科学性。
本研究充分利用血浆这一易获取且安全的生物样本,实现蛋白质组精准检测,填补了pRCC生物标志物缺乏的领域空白。为未来pRCC的早期筛查、风险分层及疗效跟踪开辟了新路径,同时为肿瘤蛋白质组学与机器学习在复杂异质性肿瘤精准医疗中的深度融合树立了典范。
原始出处:
Xu Z, Zhang L, Lyu J, Cai M, Ji T, Bai L et al. Integrated clinical and proteomic-based model for diagnostic and prognostic prediction in pRCC. J Hematol Oncol. 2025;18:59. doi:10.1186/s13045-025-01707-0
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)