首页 > 医疗资讯/ 正文
J Hematol Oncol: 殷咏梅教授新型抗 TROP2 ADC 药物 Sac-TMT 首次人体试验数据公布,在晚期乳腺癌中展现 37.3% 客观缓解率与可控安全性
来源 2025-06-23 12:10:47 医疗资讯亮点总结
- 首次报道抗TROP2抗体偶联药物(Sacituzumab tirumotecan,Sac-TMT)在晚期不可切除或转移性实体瘤及三阴乳腺癌(TNBC)、HR+/HER2−乳腺癌患者中的安全性和抗肿瘤活性。
- Sac-TMT 4 mg/kg及5 mg/kg为推荐剂量,最大耐受剂量(MTD)为5.5 mg/kg,副作用可控,主要为胃肠道及血液学毒性。
- 在既往接受标准治疗失败的TNBC及HR+/HER2−乳腺癌患者中,客观缓解率(ORR)分别为37.3%和31.7%,显示出显著的治疗潜力。
研究背景与意义
三阴性乳腺癌(TNBC)和HR+/HER2−乳腺癌是乳腺癌中临床上治疗难度较大且预后较差的两大亚型。尽管近年来免疫治疗和靶向治疗获得发展,然而相当一部分患者仍表现出原发或继发耐药,疾病进展迅速,生存亟待提高。TROP2是一种高度表达于多种癌症细胞表面的跨膜糖蛋白,参与肿瘤细胞增殖和侵袭,且高表达与预后不良相关。利用抗TROP2抗体偶联药物(ADC)作为载体,将细胞毒性药物精准输送至肿瘤细胞,减少正常细胞损伤,已成为肿瘤靶向治疗的热点方向。

此前,Sacituzumab govitecan,作为首个获批的抗TROP2 ADC,已显示在TNBC及HR+/HER2−乳腺癌中取得治疗效果。Sac-TMT(MK-2870/SKB264)同样是以抗TROP2抗体为基础,但负载了不同的拓扑异构酶I抑制剂(KL610023),且采用了更加稳定的新型连接子,旨在提升药物稳定性及抗肿瘤效能,同时优化安全性。本研究为Sac-TMT首个人体试验(MK-2870-001)的Ⅰ/Ⅱ期临床结果,首次系统评估该药在难治性实体瘤及乳腺癌患者中的安全性和疗效。
研究设计
本研究分为两期:
- Ⅰ期为剂量递增部分,纳入中国及美国不可手术切除或转移性实体瘤患者,采用静脉滴注每两周给药,剂量范围2-12 mg/kg,目标评估最大耐受剂量(MTD)和推荐的扩展剂量(RDE)。
- Ⅱ期为剂量扩展部分,仅纳入中国的TNBC和HR+/HER2−乳腺癌患者,基于Ⅰ期确定的RDE(4 mg/kg和5 mg/kg)评估客观缓解率(ORR)、无进展生存期(PFS)及整体生存期(OS)。
主要终点为Ⅰ期MTD和RDE的确定,以及Ⅱ期的ORR(依据RECIST v1.1标准)。副作用通过CTCAE 5.0分级评估。
【临床患者特征表(Ⅰ期,n=30)】
【治疗安全及耐受性(Ⅰ期)】
总计93%的患者出现了至少1项药物相关不良事件(TRAEs),57%达到3级及以上,未见5级不良事件。最常见不良事件为恶心(63%)、脱发(57%)及贫血(50%)。剂量限制性毒性(DLT)主要为3级口腔炎、皮疹和荨麻疹,6 mg/kg组DLT发生率为29%,故最大耐受剂量确定为5.5 mg/kg。4 mg/kg和5 mg/kg剂量安全性良好,成为Ⅱ期剂量推荐。
【临床患者特征表(Ⅱ期扩展部分)】
【临床疗效(Ⅱ期)】
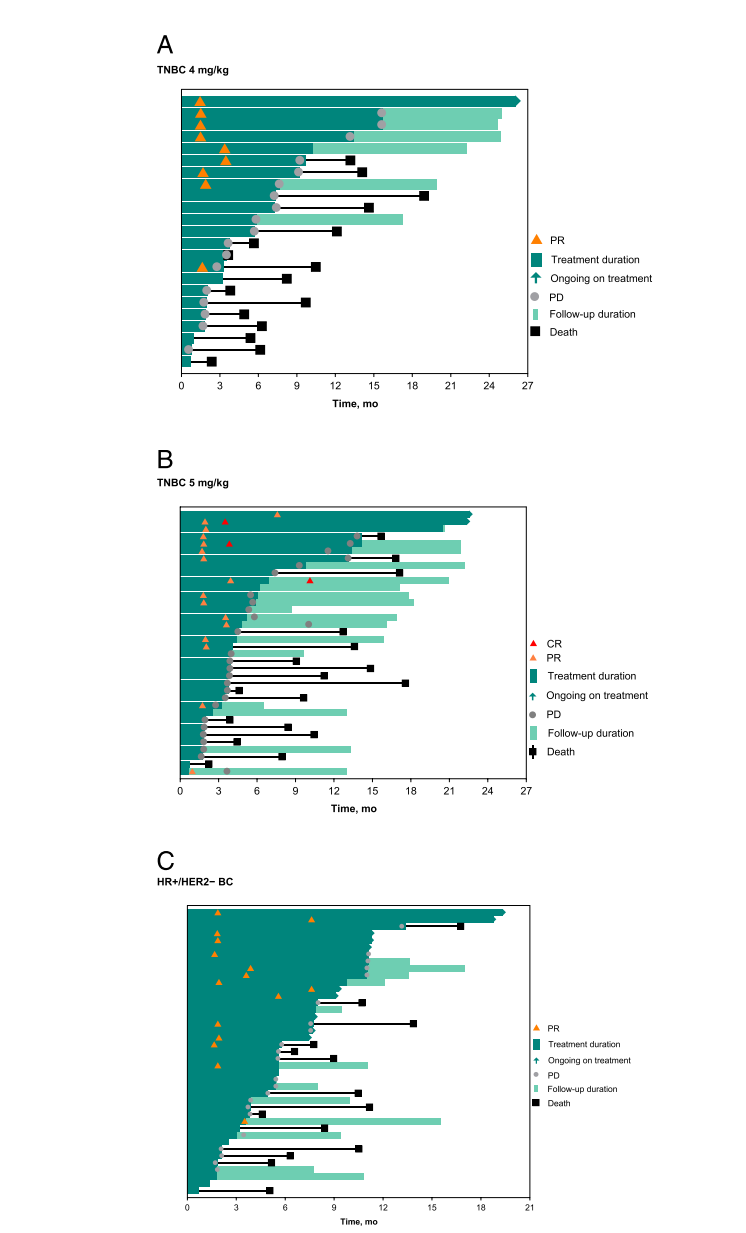
图:肿瘤响应时间线与治疗反应
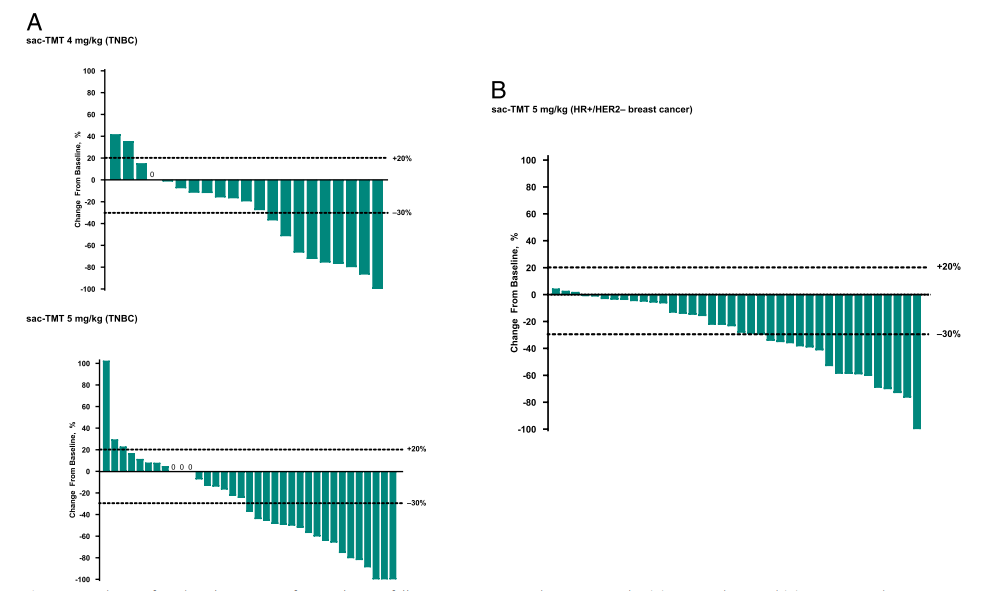
图:响应性肿瘤病灶变化瀑布图
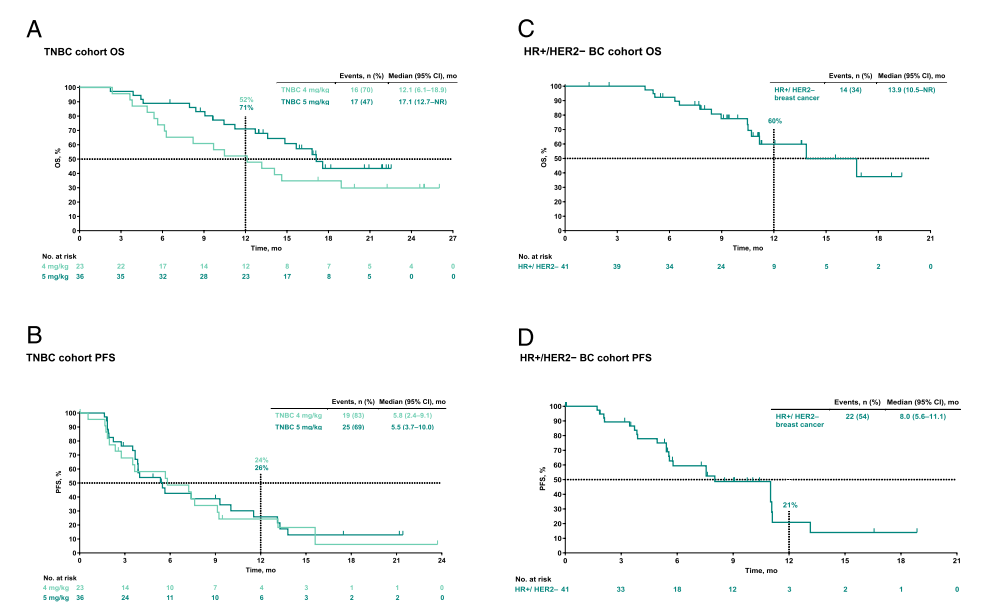
图:总生存期(OS)及无进展生存期(PFS)Kaplan–Meier曲线
【治疗安全性分析(Ⅱ期)】
TNBC患者组中,所有患者均出现TRAEs,3级及以上发生率在4 mg/kg与5 mg/kg组分别为52%和67%。主要不良事件包括贫血(74%与89%)、白细胞减少(74%与78%)和中性粒细胞减少(61%与72%)。HR+/HER2−患者组不良事件类似,3级及以上发生率为54%,导致治疗中断主要为血液学毒性。
研究价值与意义
本研究首次报道Sac-TMT这一新型抗TROP2 ADC的临床前瞻数据,体现出其在标准疗法进展后TNBC及HR+/HER2−乳腺癌患者中的良好安全性与显著抗肿瘤活性。4 mg/kg和5 mg/kg两个剂量均获得良好疗效与可控毒性,提供了宝贵的剂量选择依据。与已获批的Sacituzumab govitecan相比,Sac-TMT采用了不同的拓扑异构酶I抑制剂以及更稳定的连接子,这可能解释了其独特的安全性特征,为肿瘤治疗提供了新的药物平台。此外,本研究确认了抗TROP2 ADC在晚期乳腺癌中作为靶向治疗的巨大潜力,并将为后续的Ⅲ期临床试验及临床应用铺平道路。
然而需要指出的是,本研究为单臂、样本量有限的早期临床研究,缺乏对照组,且2期扩展队列患者均来自中国,可能存在一定的区域及人种限制。此外,针对生物标志物的深入探索尚未展开,有待未来更大样本多中心研究进一步探讨。
原文出处
Ouyang Q, Rodon J, Liang Y, et al. Results of a phase 1/2 study of sacituzumab tirumotecan in patients with unresectable locally advanced or metastatic solid tumors refractory to standard therapies. J Hematol Oncol. 2025;18:61. https://doi.org/10.1186/s13045-025-01705-2
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)