首页 > 医疗资讯/ 正文
日本国家癌症中心的Akihiko Yoshida博士为通讯作者,在病理学知名期刊《Histopathology》上发表题为“NUT carcinoma and thoracic SMARCA4-deficient undifferentiated tumour: facts and controversies”的综述性文章,详尽介绍了这两种肿瘤的临床病理特点及分子遗传学特点。

本期甘肃省人民医院病理科陈旭老师将这篇综述要点编译如下,供相关医师参考。
NUT癌
定义
NUT癌是一种低分化的癌,包含涉及NUTM1基因的基因重排(15q14),1991年首次发现。2003年,学者French发现此类肿瘤具有BRD4::NUTM1融合,并将其命名为“NUT中线癌”。最初,学者认为 NUT癌是鳞状细胞癌的一种亚型,累及年轻人膈膜上方的中线结构,目前已经清楚,NUT癌可以起源于任何器官,老年患者也可发生。
临床特点
NUT癌影响任何年龄组的患者,但最常见的是儿童和年轻人,中位年龄在20岁,没有性别倾向。最常见的部位是胸腔(50%)和头颈部(40%),罕见的部位包括泌尿生殖道、腹腔和中枢神经系统,极少累及骨及软组织。肿瘤累及胸腔的患者表现为胸痛、咳嗽、呼吸短促、上腔静脉综合征和体重减轻。肿瘤体积过大,常累及肺门或纵隔,常伴有同侧胸腔积液和转移到区域淋巴结、骨和其他器官。NUT癌具有高度侵袭性,中位总生存期为6.5个月,对化疗通常不敏感。
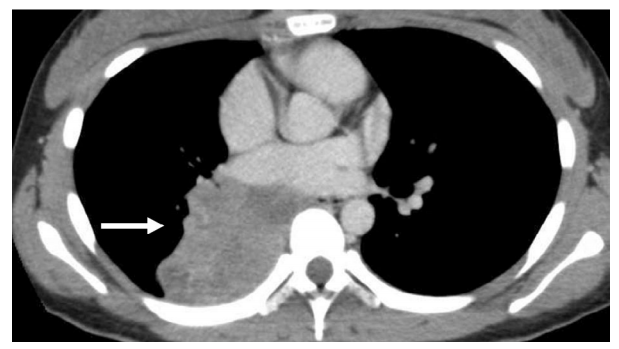
图1. 肺部NUT癌的影像学表现。CT显示较大的纵隔肿瘤(箭头)。
形态学改变
肿瘤由小到中等大小的圆形、上皮样或基底样细胞的薄片或巢组成,有时分布于增生的纤维间质中。肿瘤细胞具有高度均匀的细胞核,没有明显的多形性。核染色质通常呈囊泡状,中央有明显的核仁,但有时也可见染色质致密的肿瘤细胞。瘤细胞核分裂活跃,可见坏死。三分之一的病例中可见散在角化。有些肿瘤完全由粘连的小圆形细胞组成,没有上皮特点,或在黏液样或透明的背景下的网状生长,肿瘤组织内可见中性粒细胞浸润。
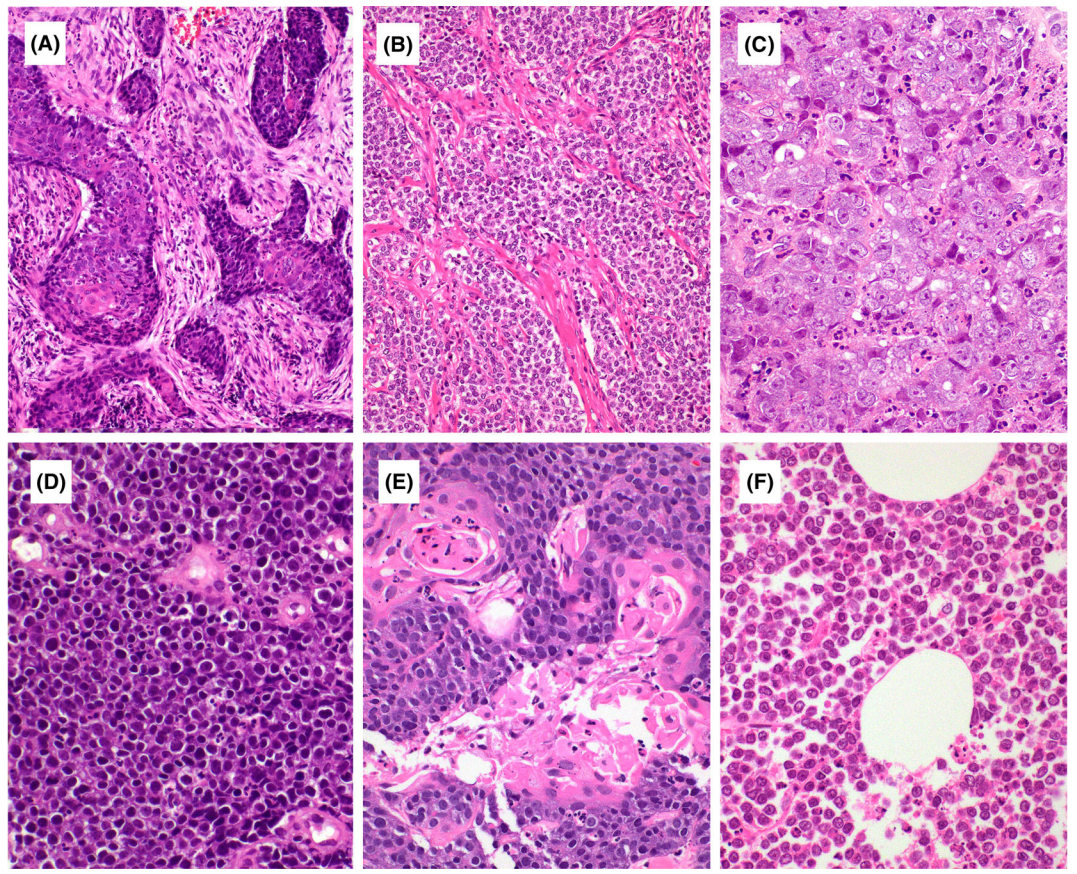
图2. NUT癌的组织学表现。肿瘤在纤维背景下呈巢状或片状排列(A、B)。肿瘤细胞为均匀的上皮样、基底样或圆形细胞(C、D)。肿瘤内中性粒细胞浸润明显(C)。突然的角化较为罕见(E)。一些肿瘤完全由粘连的小圆形细胞组成,没有上皮形态特征(F)。
免疫组化特点
NUT免疫组化,使用兔单克隆抗体C52B1,是NUTM1融合检测的可靠替代物,敏感性为87%。NUT癌的核染色具有独特的斑点反应(成年人睾丸可以作为阳性对照)。NUT癌常具有鳞状分化的证据,伴有全角蛋白、高分子量角蛋白和p63、p40表达。神经内分泌标记物,如Syn、CgA和INSM1,也可以在NUT癌中表达。在少数病例中,肿瘤细胞可表达TTF-1(克隆号为 8G7G3/1),甲状腺NUT癌中偶尔出现的TTF1和PAX8的表达。NUT癌还可以表达CD34。
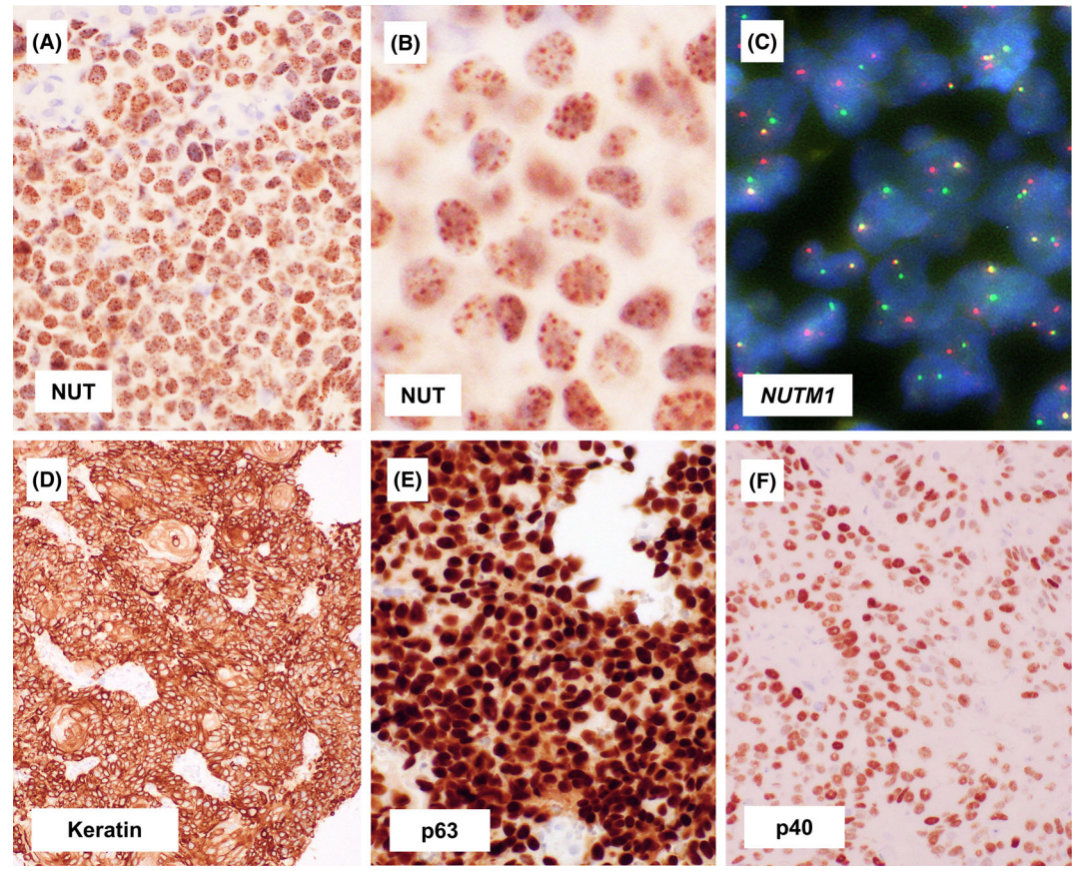
图3.NUT癌的免疫组化和分子细胞遗传学表现。NUT癌表现为NUT蛋白(A)的弥漫性核表达,高倍镜下NUT表达呈斑点模式(B)。NUTM1分离荧光原位杂交试验显示绿色和橙色信号分裂,表明NUTM1重排(C).除了p63(E)或p40(F)外,NUT癌通常是角蛋白(D)呈阳性。
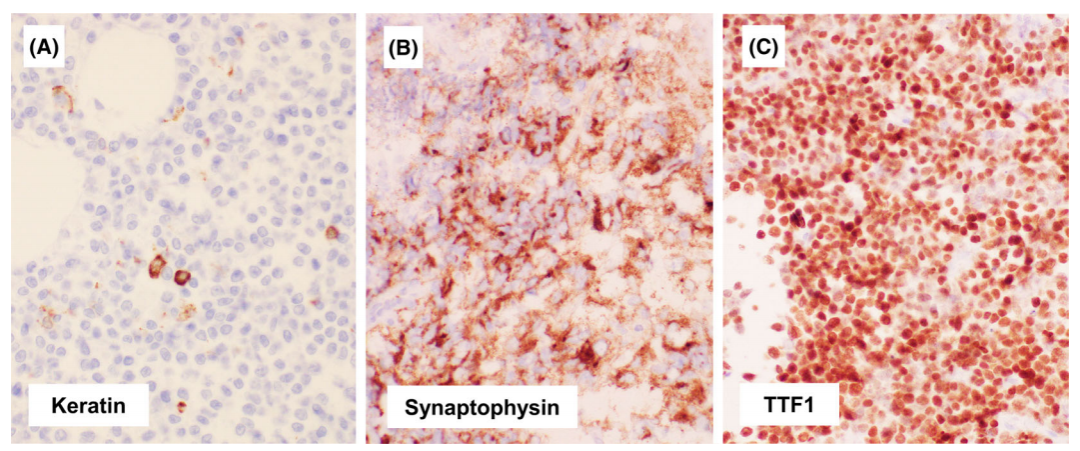
图4.罕见的NUT癌的免疫表型。未分化的NUT癌角蛋白(A)阴性或局灶阳性。一些NUT癌表达突触素(B)或TTF1 (C)。
分子遗传学改变
常见的NUTM1融合基因是BRD4(19p13,75%),BRD3(9q34,15%)和NSD3(8p11,5%)。较少见的融合基因为ZNF532和ZNF592。NSD3融合在甲状腺NUT癌中常见。BRD3和BRD4属于BET蛋白家族,通过双溴结构域识别乙酰化组蛋白。NSD3、ZNF532和ZNF592与BET蛋白相互作用,共同形成染色质调控复合物。NUT作为融合基因合并到这些BRD复合物中,招募并激活组蛋白乙酰转移酶p300,p300进一步将BRD复合物招募至乙酰化染色质,通过p300依赖的基因激活细胞增殖和p300隔离来调节转录,从而阻止细胞的正常分化。
其它存在NUTM1重排的肿瘤:
在一部分汗孔瘤/汗孔癌中,可见YAP1:: NUTM1和WWTR1::NUTM1融合。在少数儿童急性淋巴细胞白血病中,可见NUTM1与ACIN1、BRD9、CUX1、ZNF618的融合,这类急性淋巴细胞白血病预后较好。在部分CIC重排的肉瘤中,可见 CIC::NUTM1重排,这类肿瘤好发于中枢神经系统和椎旁软组织,瘤细胞表达ETV4和WT-1。MGA::NUTM1融合的肿瘤好发于儿童,可见圆形、梭形细胞,伴粘液样、胶原样间质和骨样透明沉积,多见于胸壁。MXD4::NUTM1融合的肿瘤通常起源于结直肠,由梭形、上皮样或横纹肌样细胞组成。
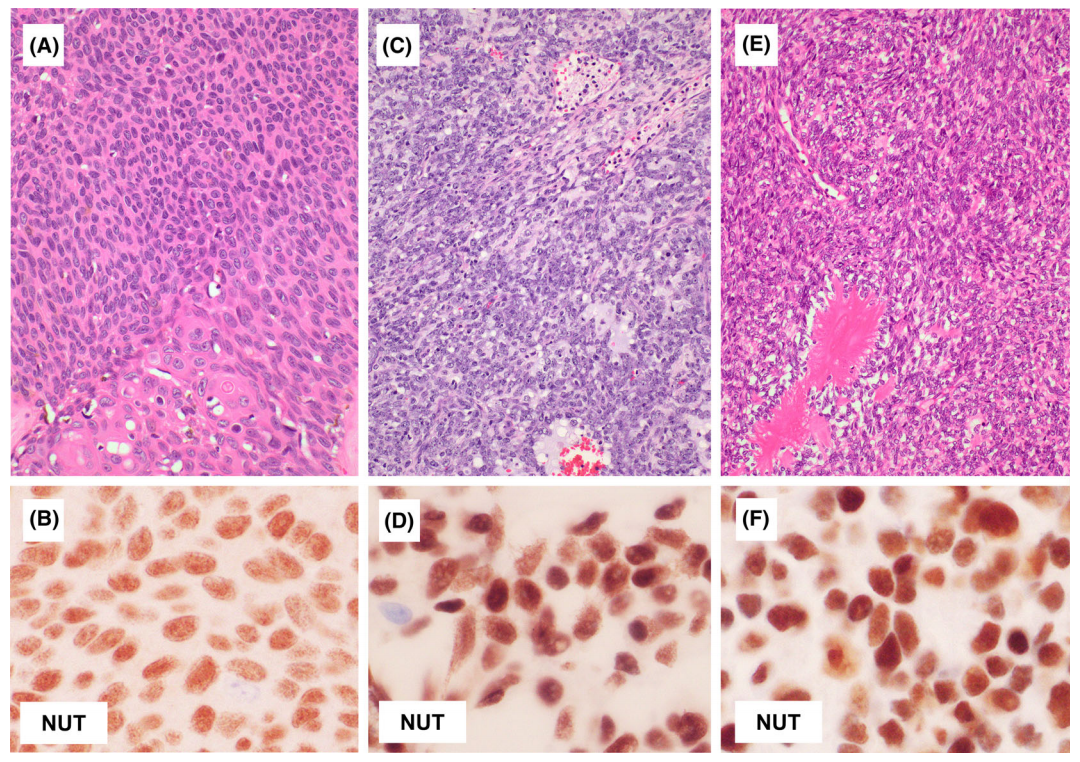
图5.除NUT癌以外的NUTM1-重排肿瘤的组织学表现。YAP1::NUTM1融合的汗孔瘤显示多孔状细胞与表皮细胞(A)和NUT免疫组化阳性(B)CIC::NUTM1融合肉瘤,显示圆形细胞,局灶性黏液样改变(C),NUT免疫组化阳性。(D)MGA::NUTM1融合肉瘤的梭形细胞显示均匀的梭形细胞束,骨样透明基质沉积(E),NUT免疫组化染色阳性(F)。
鉴别诊断
鳞状细胞癌、大细胞癌和高级别神经内分泌癌
①当肿瘤表现为单形核特征且缺乏清晰的腺体/乳头,无论p63/p40、TTF1或神经内分泌标志物表达时,应怀疑NUT癌
②NUT癌中常见泡状核和位于中央的核仁,局部角化和瘤组织内中性粒细胞浸润。
尤文肉瘤和尤文样肉瘤
①p63/p40表达阴性,CD99表达阳性时。尤文氏肉瘤通常对NKX2.2和PAX7呈阳性。
②CIC重排肉瘤的特征是ETV4和WT1的表达。
淋巴造血系统肿瘤和恶性黑色素瘤
淋巴造血系统肿瘤标志物(CD45、CD20、CD3、PAX5、TdT、CD43、髓过氧化物酶)和恶性黑色素瘤标志物(S100、SOX10、HMB45、Melan A)有助于鉴别诊断。
生殖细胞肿瘤
肿瘤表达PLAP、CD30和SALL4,血清AFP值升高。
SMARCA4缺失的未分化肿瘤
在NUT癌中,SMARCA4表达。
胸部SMARCA4缺失的未分化肿瘤
定义
胸部SMARCA4缺失的未分化肿瘤(胸部SMARCA4-UT)是一种高级别恶性肿瘤 ,SMARCA4(也称为BRG1),由SMARCA4(19p13.2)编码,是SWI/SNF中的成分,在转录和分化中发挥重要作用。学者Le Loarer于2015年首次提出“SMARCA4-UT”的概念。肿瘤好发于纵隔,表现为未分化/横纹肌样组织学,与恶性横纹肌样肿瘤的基因表达谱重叠。
临床特点
SMARCA4-UT好发年龄27-90岁,男性多见,与吸烟密切相关。症状包括呼吸困难、疼痛、体重减轻和上腔静脉综合征。肿瘤通常位于纵隔或肺门。肿瘤经常转移到淋巴结、骨、肾上腺、中枢神经系统或腹腔、骨盆,腹部转移最为常见。肿瘤表现出高度侵袭性行为和预后不良,中位总生存期为4-7个月,化疗通常无效。

图6.胸部SMARCA4-UT的影像表现。冠状动脉重建显示左侧纵隔有一个较大的肿块(箭头)。
形态学特点
肿瘤体积通常很大,切面柔软,呈棕褐色,并伴有坏死。组织学上,它们由分散的大圆形到上皮样细胞组成,可见囊泡状染色质和突出的核仁。上皮细胞分化的证据,如腺体,乳头和角化,较为少见。肿瘤的细胞核相对单调,只有偶尔的细胞表现出轻微的多形性。横纹肌样细胞可能存在,但通常很少见。瘤细胞核分裂及坏死常见,网状生长、纺锤状生长和黏液样变化很少见。
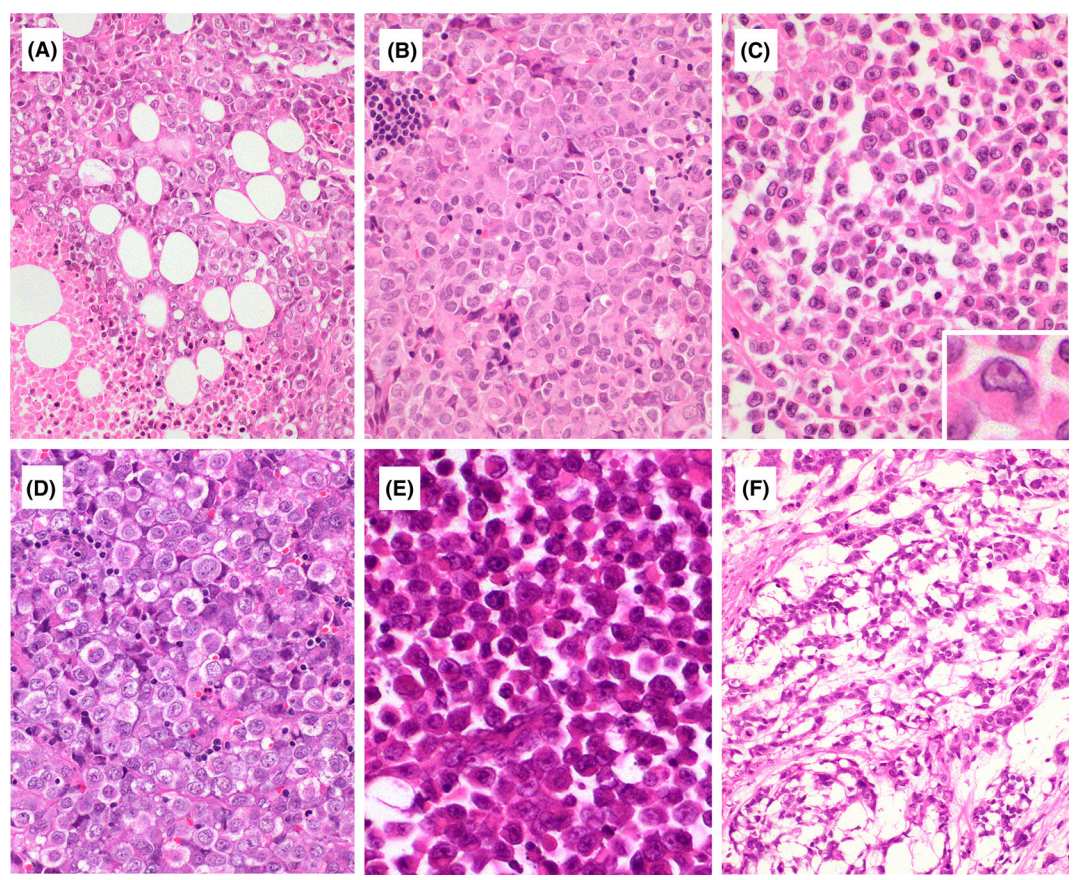
图7.胸部SMARCA4-UT的组织学表现。肿瘤由大的上皮样圆形细胞组成,轻度粘连。肿瘤细胞具有相对均匀的细胞核,有泡状染色质和突出的核仁(A-E)。肿瘤细胞浸润纵隔脂肪,可见坏死(A)。部分区域可见横纹肌样细胞(C,插图)。罕见的病例显示黏液样间质(F),呈现索状或网状生长。
免疫组化特点
SMARCA4的表达在大多数病例中完全丢失,此外,SMARCA2在大多数情况下丢失。角蛋白的表达,通常是局部的或弱的,但也可以完全是阴性的。Claudin-4在几乎所有病例中都是阴性的。肿瘤表达“干细胞”标记物,包括CD34、SOX2或SALL4,类似于恶性横纹肌样肿瘤。P53和Syn在大多数病例中过表达。TTF1、p40或WT1表达较弱。
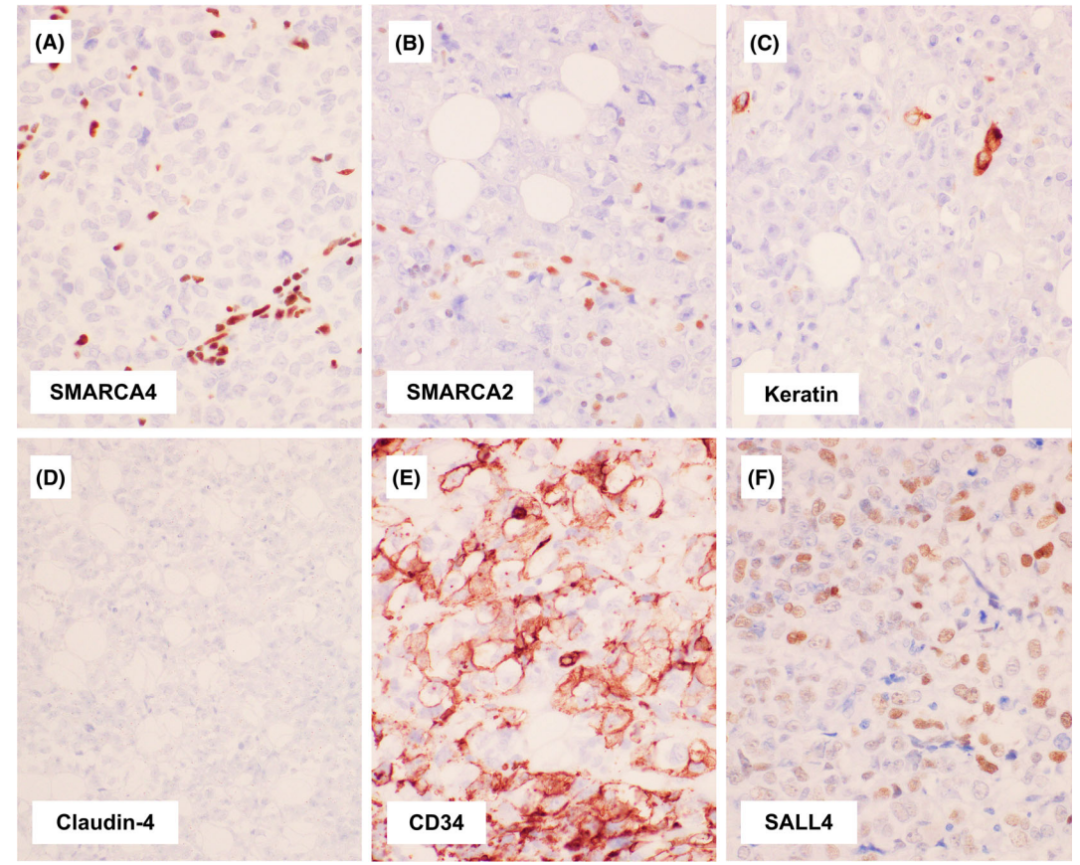
图8.胸部SMARCA4-UT的免疫组化结果。SMARCA4染色丢失(A),几乎所有病例的SMARCA2染色也丢失(B),内皮细胞和炎症细胞表达SMARCA2,可作为内阳性对照。可见局灶性角蛋白表达(C)。Claudin-4在大多数情况下(D),部分病例表达CD34 (E)或SALL4(F)。
分子遗传学改变
SMARCA4双等位基因失活是该疾病的基础,但其对肿瘤发生的影响的确切机制尚不清楚。SMARCA4失活主要以无意义突变或帧移突变的形式出现,在部分病例中存在错义突变、剪接位点突变和缺失。另一个等位基因通常具有拷贝中性的杂合性缺失。SMARCA4种系突变在这种肿瘤类型中尚未见报道。该突变广泛分布在SMARCA4基因中,需要下一代测序才能进行检测。TP53突变是常见的,高达44%的病例存在KRAS、STK11或KEAP1突变。非复发性的全基因组拷贝数变化是常见的。大多数肿瘤都有与吸烟相关的突变特征,而大多数肿瘤都有较高的TMB。SMARCA4-UT的基因表达谱与恶性横纹肌样肿瘤和卵巢小细胞癌,高钙血症型(SCCOHT)类似。
非小细胞癌中的SMARCA4突变
在8-11%的非小细胞肺癌中观察到SMARCA4突变,其中一半(4-5%的非小细胞肺癌)存在截断突变或纯合子缺失,导致SMARCA4缺失,这与吸烟密切相关。多数为形态学上的常规腺癌,这些肿瘤大多是EGFR和ALK呈阴性改变,但包含TP53、KRAS、KEAP1和STK11突变。这些非小细胞肺癌的预后较差。
在NSCLC中不需要常规的SMARCA4染色,无论SMARCA4状态如何,肿瘤细胞TTF1染色阳性可以诊断为腺癌。目前,SMARCA4染色仅推荐用于怀疑SMARCA4-UT的病例。SMARCA4缺失的NSCLC与SMARCA4-UT可以通过上皮结构和细胞凝聚来区分。辅助标记物可能有帮助,癌通常表现为弥漫性强角蛋白表达,同时SMARCA2和claudin-4阳性,而CD34和SALL4通常为阴性。
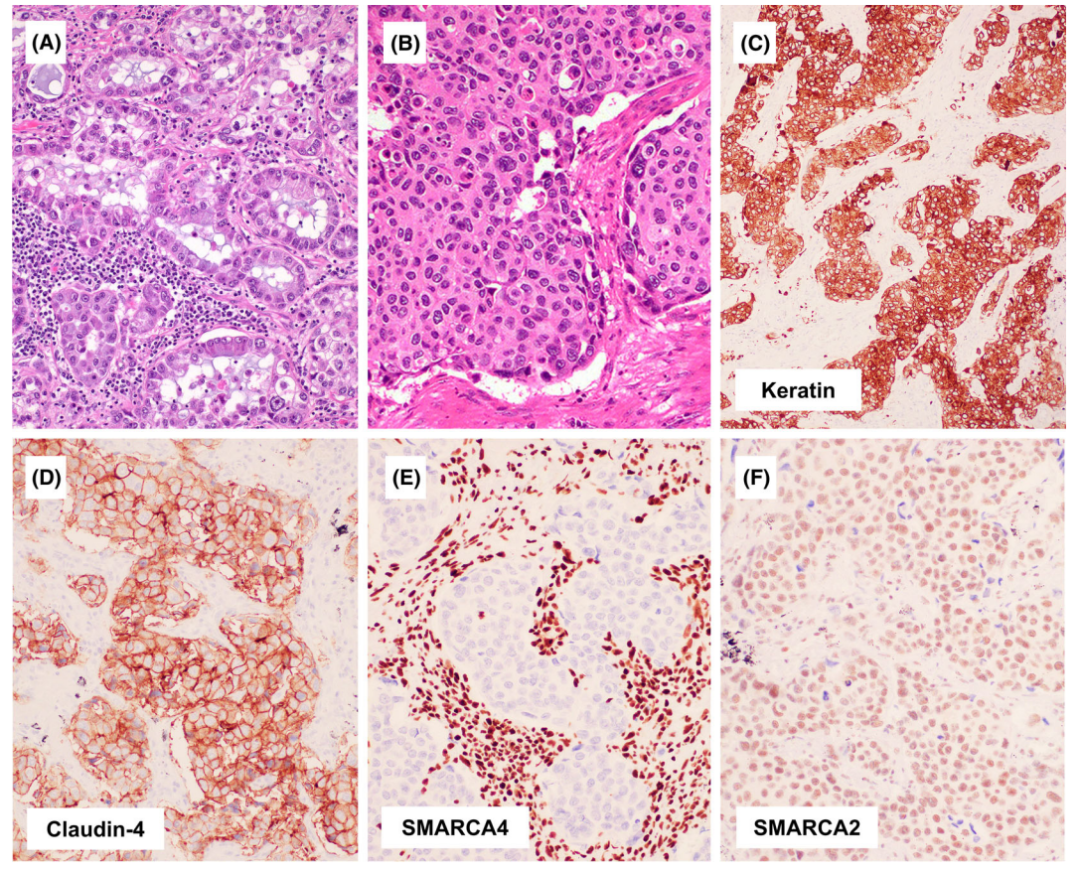
图9.存在SMARCA4缺失的肺腺癌。肿瘤显示明显的上皮细胞生长(A,腺泡型;B,实体型)。肿瘤弥漫性表达角蛋白(C)和Claudin-4(D),SMARCA4丢失(E,基质中保留的表达作为内部阳性对照),而SMARCA2表达(F)。
伴有其它SWI/SNF成分缺失的胸部未分化肿瘤
胸部SMARCB1缺陷的未分化肿瘤往往发生在吸烟的男性中。大多数突变特征,缺乏吸烟相关的突变特征或常见的NSCLC驱动突变。SMARCB1缺失在肺和胸膜肿瘤中极为罕见。少数胸部未分化肿瘤伴有SMARCA2丢失,而不伴有SMARCA4丢失。
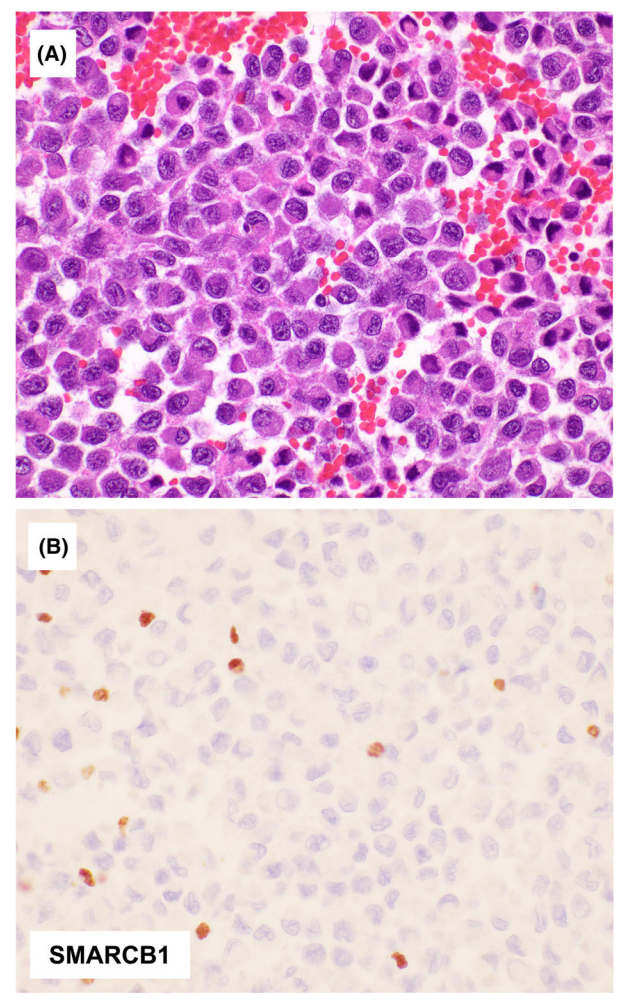
图10.胸腔SMARCB1缺陷的未分化肿瘤。该肿瘤,在有严重吸烟史的成人中,显示均匀分散的上皮样/横纹肌样细胞(A)的弥漫性增殖SMARCB1的免疫反应性丧失(B,在炎症细胞中的表达作为内部阳性对照)。
其它器官的SMARCA4-UT
SMARCA4-UT已经在许多其它器官被发现,包括卵巢、子宫、食道、胃、肠、胰腺、尿路、肾脏、头/颈部和皮肤。一部分肿瘤表达角蛋白,然而,有一部分肿瘤显示完全未分化及横纹肌样生长模式,这些肿瘤claudin-4和SMARCA4/SMARCA2阴性。
鉴别诊断
生殖细胞肿瘤
生殖细胞肿瘤常影响中线前纵隔,通常具有均匀的弥漫性和强的SALL4表达。在SMARCA4-UT中,SALL4具有异质性的多灶性表达。OCT3/4在SMARCA4-UT中为阴性。
近端型上皮样肉瘤
近端型上皮样肉瘤可累及胸椎区,通常显示SMARCB1缺失,保留SMARCA2的表达,而SALL4和SOX2通常为阴性。
恶性横纹肌样肿瘤(MRT)
好发于婴儿或儿童中,大多数MRTs显示SMARCB1缺失,而<5%的病例显示SMARCA4缺失。然而,在MRT中,TP53突变和p53过表达通常是不存在的。
淋巴瘤、尤文氏肉瘤、CIC重排肉瘤、黑色素瘤和NUT癌
对应的免疫组化标记可鉴别。
小结
NUT癌和SMARCA4-UT在肺部肿瘤WHO分类中很明显,其定义包括分子遗传异常。然而,表型特征在诊断中仍然起着重要作用,这与临床预后相关。由于两种肿瘤具有明确的免疫组化标记,因此在大多数情况下不需要分子检测。目前,对于这两种肿瘤的治疗方法仍在研究中。
参考文献及书籍:
Yoshida A. NUT carcinoma and thoracic SMARCA4-deficient undifferentiated tumour: facts and controversies. Histopathology. 2024 Jan;84(1):86-101. doi: 10.1111/his.15063. Epub 2023 Oct 24. PMID: 37873676.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)