首页 > 医疗资讯/ 正文
摘 要
目的 探讨脑小血管病(cerebral small vessel disease,CSVD)患者的血清尿酸(uric acid, UA)水平与步态运动学特征间关系。
方法 回顾性分析2023年1月至2023年12月就诊于广州中医药大学附属中山中医院神经内科·康复科且诊断为CSVD的患者。收集一般资料,对患者进行三维步态分析,结合步态结果将患者分为轻度步态障碍组(0~1分)、中度步态障碍组(2~3分)和重度步态功能障碍组(4~5分),记录CSVD影像总负荷及UA等血清学结果。分析UA水平与CSVD步态障碍之间的关系。
结果 本研究纳入CSVD患者共105例,根据步态障碍严重程度分组,轻度步态障碍组40例,中度步态障碍组49例,重度步态障碍组16例。中度步态障碍组的血清UA[(358.43±13.44)μmol/L]高于轻度步态障碍组血清UA[(336.00±12.48)μmol/L],重度步态障碍组的血清UA[(289.94±11.88)μmol/L]低于轻、中度步态障碍组(P<0.05),重度步态障碍组的蒙特利尔认知评估量表评分(21.38±0.13)低于轻、中度步态障碍组(28.05±0.09;25.22±0.10)(P<0.05);CSVD影像学总负荷重度组的步宽[(13.26±2.80)cm]相比轻、中度组[(11.22±1.70)cm vs. (11.65±2.70)cm]增加(P<0.05),CSVD影像学总负荷重度组左侧摆动相(35.90%)相比轻、中度组(38.50% vs. 37.20%)下降(P<0.05); Spearman相关分析显示血清UA水平与脑微出血呈负相关(r=-0.20,P=0.04),高尿酸血症与脑萎缩呈负相关(r=-0.20,P=0.04);在轻中度步态障碍组患者中,高尿酸血症与步态障碍总负荷之间呈正相关(r=0.25,P=0.02),高尿酸血症与右侧步速(r=-0.22,P=0.04)、右侧步幅(r=-0.29,P<0.01)、左侧步速(r=-0.32,P<0.01)、左侧步频(r=-0.29,P<0.01)、左侧步幅(r=-0.26,P=0.01)均呈负相关。
结论 CSVD轻中度步态障碍患者中,UA水平及高尿酸血症的发生与步态障碍总负荷呈正相关,步态障碍以双侧步速、双侧步幅、左侧步频减少为主要特征。
关键词
脑小血管病;血清尿酸;高尿酸血症;脑小血管病总负荷;步态障碍;三维步态分析;步态特征
脑小血管病(cerebral small vessel disease,CSVD)指由多种因素导致的颅内小血管病变,表现为一系列临床症状、影像学及病理综合征[1],患病率与年龄呈正相关,约影响5%的50岁人群及近全部90岁以上人群[2-3],可引发步态、认知及情绪障碍、脑卒中等[4]。步态障碍是CSVD患者主要运动功能障碍之一[5],与生活质量下降、住院率、死亡风险及外伤等不良事件发生高度相关[6]。步态是复杂的神经调控过程,涉及视觉、前庭和感觉系统信号整合及肢体运动调控[7-8],临床常用时空参数(步速、步幅、步频等)、足底压力及关节角度参数进行步态评估。既往研究表明,步态评定可预测患者跌倒风险,预防运动相关骨质疏松、心血管疾病等,降低骨折及死亡风险[9]。随着饮食及生活习惯变化,高尿酸血症(hyperuricemia ,HUA)患病率逐年递增,中国HUA总体患病率在2000—2014年间达13.3%,痛风总体患病率为1.1%[10]。HUA与动脉粥样硬化、血管内皮功能受损和心脑血管事件高度相关[11-12],当UA沉积于关节到达临界阈值时可引发炎症反应及关节结构损伤进而影响步态[13],且步速下降0.1 m/s,患者存活率可随之下降12%[14]。目前探究UA水平与CSVD患者步态相关性文献较少。因此本研究将纳入本院2023年收治的CSVD患者,探究UA与CSVD患者步态特征间关系。
1 对象与方法
1.1 研究对象 回顾性纳入于2023年1月至12月期间就诊于广州中医药大学附属中山中医院神经内科·康复科的CSVD患者。
纳入标准:①患者临床特征及神经影像学表现符合《中国脑小血管病诊治指南2020》中所描述的CSVD特点[15];②步态时空参数符合文献中步态异常描述[16-18];③年龄≥50岁。
排除标准:①考虑为大脑动脉粥样硬化型脑卒中及其他引起步态障碍的疾病,如心脏来源的栓塞、小脑梗死、视觉/前庭/本体感觉障碍等;②由感染、免疫、遗传、代谢或中毒性脑白质高信号;③未控制的心血管疾病;④颅内肿瘤、肺性脑病、肝性脑病等;⑤骨骼肌肉系统疾病;⑥精神心理疾病;⑦严重认知障碍无法配合者;⑧磁共振检查禁忌证或不能配合检查者。
本研究在CSVD患者知情同意下,经医院伦理委员会批准后进行(审批号:2023ZSZY-LLK-274)。
1.2 研究方法
1.2.1 一般临床资料收集 收集患者性别、年龄、病史、生化指标、血压、步态运动学特征蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA)。
1.2.2 步态评估 使用三维步态分析系统(美国Motion analysis公司)评估步态,包括Cortex 5.3、OrthoTrak 6.6.1分析系统。测量方法: ①测量前校正;②患者穿短裤赤脚,球贴在体表标记关键解剖点;③记录原点数据,建立静态模型;④取下标记球,患者以自然步态沿走廊行走,进行4~5轮适应性步行;⑤选取3个合格数据,用Cortex分析系统建立三维静态和运动模型,用Ortho trak系统得到时空参数及运动参数;⑥分析系统整合数据,得到步态时空参数(步频、步态周期、双足支撑期、单足支撑期、步宽、步长、步幅、步速)和运动参数(支撑相位最大角、支撑相位最小角、摆动相位最大角、摆动相位最小角)。根据文献中健康被试正常时空参数标准[16-17],正常参考值如下:步速0.88~1.38 m/s;步频96.05~127.76 steps/min;步宽0.07~0.18 m/s;步长0.52~0.71 m;步幅1.06~1.36 cm。摆动相(0.43±0.04) s;支撑相60%。参考文献对CSVD步态障碍研究结果,以步速、步频、步幅、步宽、步长损伤为主要特征,评估步态障碍严重程度,0~1分为轻度,2~3分为中度,4~5分为重度[18-19]。
1.2.3 头颅磁共振检查 使用Siemens Magentom Trio 3.0T扫描仪进行头颅检查,包括T1、T2 FLAIR、磁敏感加权以及弥散加权成像序列,阅片诊断由2位副主任医师完成,若存在异议,则由第3位副主任医师仲裁,采纳一致结果。CSVD总负荷评分及影像学标志物分级标准[20]:①腔隙性梗死(lacunar infarction,LI)≥1个为1分;②脑微出血(cerebral microbleeds,CMBs)≥1个为1分;③血管周围间隙增宽(enlarged perivascular spaces,EPVs),即位于基底节区的EPVS(半定量量表评为3、4级),为1分;④脑白质高信号(white matter hyperintensity,WMH),即对于中重度白质疏松(Fazekas合并评分≥3分),为1分。总负荷评分:0~1分为轻度,2~3分为中度,4分为重度。按照评分将患者分为轻度组、中度组和重度组。
1.3 统计学方法 使用SPSS 27.0。计数数据用百分比(%)表示,采用 χ2 检验进行组间比较;运用均数±标准差(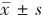 )描述符合正态分布计量数据,利用单因素方差分析对多组数据进行比较,并运用LSD检验事后分析;对于非正态分布计量数据采用中位数(四分位数)[M(QL,QU)]来表示,并通过Mann-Whitney U检验进行组间比较。最后,通过Spearman相关分析来评估UA水平与步态障碍总分、步态参数及CSVD影像学负荷间的相关性。检验水准α=0.05。
)描述符合正态分布计量数据,利用单因素方差分析对多组数据进行比较,并运用LSD检验事后分析;对于非正态分布计量数据采用中位数(四分位数)[M(QL,QU)]来表示,并通过Mann-Whitney U检验进行组间比较。最后,通过Spearman相关分析来评估UA水平与步态障碍总分、步态参数及CSVD影像学负荷间的相关性。检验水准α=0.05。
2 结果
2.1 一般资料比较 共纳入CSVD患者105例,根据步态障碍程度分组,其中轻度步态障碍组40例,中度步态障碍组49例,重度步态障碍组16例。三组在年龄、性别、烟酒史、糖尿病、高血压病、慢性痛风、高同型半胱氨酸血症、空腹血糖、HbAlc及血细胞分析、血脂等指标上差异无统计学差异(P>0.05);但三组在HUA发生率、UA水平和MoCA评分上存在统计学差异(P<0.05)。具体而言,中度步态障碍组患者UA水平及HUA发生率比轻度组高,重度步态障碍组患者UA水平及HUA发生率比轻、中度步态障碍组皆低(P<0.05),且其MoCA评分也低于轻、中度步态障碍组(P<0.05)。见表1。
Tab.1 General information表1 一般资料
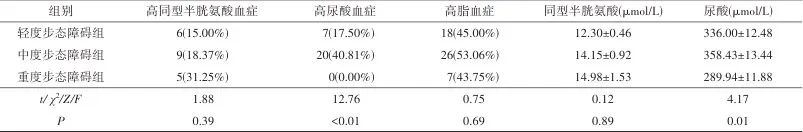
注:TC,血清总胆固醇;TG,甘油三酯;LDL,低密度脂蛋白胆固醇;HDL,高密度脂蛋白胆固醇。
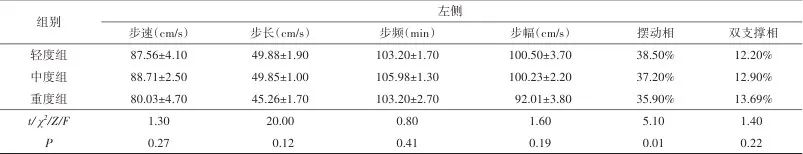
2.2 CSVD总负荷与步态运动学特征相关性分析 根据CSVD影像总负荷将研究对象分为轻度组24例,中度组63例,重度组18例。结果发现,CSVD影像总负荷与步态运动学特征相关,其中相比于CSVD总负荷轻、中度组,CSVD总负荷重度组患者的步宽增加,左侧摆动相下降(P<0.05)。CSVD总负荷轻、中度组的左侧摆动相较右侧高,而重度组左侧摆动相则较右侧低。左侧摆动相随着CSVD影像学负荷加重而降低。见表2。
Tab.2 Analysis of CSVD imaging burden and three dimensional gait spatiotemporal parameters表2 CSVD影像学负荷程度与三维步态时空参数分析
2.3 UA水平与CSVD总负荷相关性分析 Spearman相关分析发现,UA水平与CMB呈负相关(r=-0.20,P=0.04),并且WMH、LI、血管周围间隙扩大、CSVD总负荷与UA水平无统计学相关性(r=0.01,P=0.93;r=0.01,P=0.93;r<0.01,P=1.00;r=-0.09,P=0.38)。此外,HUA与脑萎缩呈负相关(r=-0.20,P=0.04)。
2.4 HUA与步态运动学特征间相关性分析 在轻、中度步态障碍患者中,HUA与步态障碍总负荷呈正相关(r=0.25,P=0.02)。在步态障碍中、重度步态障碍患者中,HUA与步态障碍总负荷呈负相关(r=-0.38,P<0.01)。HUA与右侧步速、步幅及左侧步速、步频、步幅均呈负相关(r=-0.22,P=0.04;r=-0.29,P<0.01;r=-0.32,P<0.01;r=-0.29,P<0.01;r=-0.26,P=0.01),与步宽、右侧步频无统计学相关性(r=0.01,P=0.93;r=-0.20,P=0.07)。
3 讨论
步态异常及平衡障碍是CSVD核心临床表现之一,发生率约27.8%,仅次于认知功能障碍[21],其与跌倒风险、全因死亡率增加密切相关[22]。目前对CSVD步态障碍患者的评估工具及与影像学、血清标志物的关联研究缺乏标准化体系。既往研究多依赖主观量表或简易步态测试[23-24],难以量化时空参数及运动学特征,对CSVD特异性步态模式的动态捕捉能力有限,且CSVD影像总负荷与血清生物学标志物如何协同影响步态障碍的机制尚不明确。
CSVD患者步态障碍机制主要有两方面:一是与基底节-丘脑-皮质神经环路受损密切相关[25],该环路在步态控制中起重要作用,其损伤可致步态不稳和运动协调障碍;二是与注意力等早期认知功能障碍有关,认知功能损伤可导致皮质变薄、白质完整性被破坏及CSVD总负荷增加,从而加剧步态障碍[26]。研究发现CSVD总负荷与步态障碍呈正相关[27]。
本研究利用三维步态分析系统定量评估CSVD患者步态,发现重度步态障碍组的MoCA评分低于轻、中度步态障碍组,二者呈负相关。重度步态障碍组患者步宽增加,左侧摆动相显著下降,表明CSVD患者可能表现为步宽和步态不对称性增加,可能与CSVD导致的额叶皮质萎缩、基底节损伤、海马和小脑萎缩以及额叶皮质区和基底节中脑白质环路损伤有关[28]。研究表明CMB数量与步态障碍呈正相关,且CMB位置处于颞叶、额叶和基底节时更明显[29]。
在步态参数与血清生物学标志物关系中发现,血清UA水平与HUA与步态联系密切。自2006年有研究发现尿酸可能通过氧化应激、改变内皮功能及血脑屏障通透性等机制影响脑血管病进展后,相关研究结果不尽相同[30]。
研究显示,中度步态障碍组的UA高于轻度步态障碍组,重度步态障碍组的UA低于轻、中度步态障碍组,差异有统计学意义。轻中度步态障碍组的步态障碍负荷总分与HUA呈正相关,中重度步态障碍组则呈负相关,提示UA水平、HUA发生率与CSVD功能障碍及影像学标志物进展呈非线性关联,可能与CSVD人群发病早、年龄跨度大、代谢状态复杂相关。有研究发现,无症状HUA患者也存在赤脚步态模式变化,如支撑相时间增加、步速减慢、步频减少等[31]。本研究中轻中度步态障碍患者表现为双侧步速、步幅减少及左侧步频降低。UA在人体中既扮演抗氧化角色,减轻氧化应激,保护脑结构;随着其含量增高又产生促氧化作用[32],加剧氧化应激及炎症反应导致脑血管内皮损伤。动物研究表明当UA处于5 mg/dL时,在小鼠中抗氧化、抗衰老作用明显;而达到10 mg/dL时则促进细胞衰老和氧化应激[33],在老年患者中影响更甚[34]。与此同时,过低UA水平亦被认为与CSVD所致抑郁及脑网络破坏相关[35]。新近研究还发现UA水平波动幅度也可造成神经损伤,其中额叶、颞叶功能更易受影响[36]。
此外,本研究中UA水平与CMB 总体呈负相关,但HUA的发生与步态障碍总负荷呈正相关,而CMB与步态障碍总负荷未见明显相关性。该结论与一项欧洲研究对比存在差异[37],可能与人群差异及CMB部位有关。在神经变性疾病中长期高UA水平可能导致其他CSVD损伤,如皮质萎缩、脑白质变性,影响基底节-丘脑-皮质环路完整性,最终表现为步态障碍[38]。本研究纳入患者可能处于不同病理阶段,中重度组UA水平降低,可能与疾病进展期肾功能下降或代谢补偿机制有关,但总体HUA与步态障碍总负荷呈正相关性,可能因HUA伴随的全身代谢改变间接加重步态障碍,掩盖UA对脑结构的局部保护作用。因此对CSVD患者进行UA水平个体化管理,平衡其神经保护与系统性损害风险,具有重要临床意义。
HUA与CSVD进展风险独立相关[39],且脑白质完整性丧失、脑萎缩与CSVD患者步速下降之间存在相关性[40],步速每下降0.1 m/s,死亡风险可增加1.15倍[41]。研究表明,步长缩短和末端双支撑时间延长是CSVD患者高跌倒风险的独立预测因素[42],即使在常规步态评估中未呈现明显异常,步态参数异常也可反映平衡控制及动态稳定性情况,对康复治疗有重要参考价值。
综上,本研究发现,CSVD轻中度步态障碍患者中,UA水平及HUA的发生与步态障碍总负荷呈正相关,中重度步态障碍患者中呈负相关,主要表现为双侧步速、步幅减少及左侧步频降低。未来研究可关注血清UA水平的动态变化与CSVD患者步态功能的关系,以及降UA治疗对步态障碍的改善效果。高UA水平可能通过加剧脑血管功能障碍和炎症反应导致步态不稳,但当前的证据还不足以得出明确的结论,需更多高质量研究揭示其潜在机制和临床意义。
本研究局限性:①样本量有限,单中心纳入广东地区人群,未对年龄、性别及肾功能差异等变量进行分层亚组分析,未来需扩大样本量、建立多中心纵向队列研究验证结果普适性;②采用横断面研究,缺乏健康人群对照,限制了UA与CSVD步态障碍的特异性关联探讨;③未系统分析UA对不同CSVD影像学标志物分布及其与三维步态特征的关联;④UA影响CSVD患者步态的潜在神经环路机制探讨尚不充分,需进一步研究完善。
参考文献:
1. 胡文立, 杨磊, 李譞婷, 等. 中国脑小血管病诊治专家共识2021[J]. 中国卒中杂志, 2021, 16(7): 716-726.
2. CROCKETT R, FALCK R, DAO E, et al. Sweat the fall stuff: physical activity moderates the association of white matter hyperintensities with falls risk in older adults[J]. Front Hum Neurosci, 2021, 21(15): 671464.
3. CANNISTRARO R, BADI M, EIDELMAN B, et al. CNS small vessel disease: A clinical review[J]. Neurology, 2019, 92(24): 1146-1156.
4. TER TELGTE A, VAN LEIJSEN E, WIEGERTJES K, et al. Cerebral small vessel disease: From a focal to a global perspective[J]. Nat Rev Neurol, 2018, 14(7): 387-398.
5. GILL T, MURPHY T, GAHBAUER E, et al. Association of injurious falls with disability outcomes and nursing home admissions in community living older persons[J]. Am J Epidemiol, 2013, 178(3): 418-425.
6. 王伊龙. 重视脑小血管病的步态障碍[J]. 中华医学杂志, 2019, 99(9): 641-643.
7. ZHANG W, LOW L F, SCHWENK M, et al. Review of gait, cognition, and fall risks with implications for fall prevention in older adults with dementia[J]. Dement Geriatr Cogn Disord, 2019, 48(2): 17-29.
8. BAKER J M. Gait disorders[J]. Am J Med, 2018, 131(6): 602-607.
9. NONNEKES J, GOSELINK RJM, RŮŽIČKA E, et al. Neurological disorders of gait, balance and posture: A sign-based approach[J]. Nat Rev Neurol, 2018, 14(3): 183-189.
10. LIU R, HAN C, WU D, et al. Prevalence of hyperuricemia and gout in China from 2000 to 2014: A systematic review and meta-analysis[J]. Biomed Res Int, 2015, 2015: 762820.
11. TU W, WU J, JIAN G, et al. Asymptomatic hyperuricemia and incident stroke in elderly Chinese patients without comorbidities[J]. Eur J Clin Nutr, 2019, 73(10): 1392-1402.
12. ZHONG C K, ZHONG X Y, XU T, et al. Sex-specific relationship between serum uric acid and risk of stroke: A dose-response meta-analysis of prospective studies[J]. J Am Heart Assoc, 2017, 6(4): e005042.
13. ROME K, SURVEPALLI D, SANDERS A, et al. Functional and biomechanical characteristics of foot disease in chronic gout: A case-control study[J]. Clin Biomech, 2011, 26(1): 90-94.
14. STUDENSKI S, PERERA S, PATEL K, et al. Gait speed and survival in older adults[J]. JAMA, 2011, 305(1): 50-58.
15. 中华医学会神经病学分会, 中华医学会神经病学分会脑血管病学组. 中国脑小血管病诊治指南2020[J]. 中华神经科杂志, 2022, 55(8): 807-818.
16. 王盛, 伍琦, 朱奕, 等. 便携式步态分析与实验室步态分析时空参数的一致性研究[J]. 中华物理医学与康复杂志, 2014, 36(8): 621-624.
17. 黄萍, 钟慧敏, 陈博, 等. 正常青年人三维步态:时空及运动学和运动力学参数分析[J]. 中国组织工程研究, 2015, 19(24): 3882-3888.
18. DE LAAT K F, REID A T, GRIM D C, et al. Cortical thickness is associated with gait disturbances in cerebral small vessel disease[J]. NeuroImage, 2012, 59(2): 1478-1484.
19. 宗黎霞, 姜坤, 崔丽英, 等. 57例脑小血管病患者步态及平衡障碍特征分析[J]. 中国卒中杂志, 2015, 10(12): 1000-1005.
20. MORAN C, PHAN T G, SRIKANTH V K. Cerebral small vessel disease: A review of clinical, radiological, and histopathological phenotypes[J]. Int J Stroke, 2012, 7(1): 36-46.
21. DE LAAT K F, TULADHAR A M, VAN NORDEN A G, et al. Loss of white matter integrity is associated with gait disorders in cerebral small vessel disease[J]. Brain, 2011, 134(1): 73-83.
22. TINETTI M E. Performance-oriented assessment of mobility problems in elderly patients[J]. J Am Geriatr Soc, 1986, 34(2): 119-126.
23. PERLMUTTER J S. Assessment of Parkinson disease manifestations[J]. Curr Protoc Neurosci, 2009, Chapter 10: Unit10.1.
24. PANTONI L. Cerebral small vessel disease: from pathogenesis and clinical characteristics to therapeutic challenges[J/OL]. Lancet Neurol, 2010, 9(7): 689-701.
25. CANNISTRARO R J, BADI M, EIDELMAN B H, et al. CNS small vessel disease: A clinical review[J]. Neurology, 2019, 92(24): 1146-1156.
26. PINTER D, RITCHIE S J, DOUBAL F, et al. Impact of small vessel disease in the brain on gait and balance[J]. Sci Rep, 2017, 7: 41637.
27. WILSON J, ALLCOCK L, M C ARDLE R, et al. The neural correlates of discrete gait characteristics in ageing: A structured review[J]. Neurosci Biobehav Rev, 2019, 100: 344-369.
28. DE LAAT K F, VAN DER HOLST H M, VAN NORDEN A G, et al. Microbleeds are independently related to gait disturbances in elderly individuals with cerebral small vessel disease[J]. Stroke, 2011, 42(2): 494-497.
29. BOS M J, KOUDSTAAL P J, HOFMAN A, et al. Uric acid is a risk factor for myocardial infarction and stroke: the Rotterdam study[J]. Stroke, 2006, 37(6): 1503-1507.
30. ZHONG C, ZHONG X, XU T, et al. Sex-Specific relationship between serum uric acid and risk of stroke: A dose-response meta-analysis of prospective studies[J]. JAHA, 2017, 6(4): e005042.
31. STEWART S, DALBETH N, VANDAL A C, et al. Spatiotemporal gait parameters and plantar pressure distribution during bare foot walking in people with gout and asymptomatic hyperuri cemia: comparison with healthy individuals with normal serum urate concentrations[J]. J Foot Ankle Res, 2016, 9:15.
32. SUN X, JIAO H, ZHAO J, et al. Unexpected effect of urate on hydrogen peroxide-induced oxidative damage in embryonic chicken cardiac cells[J]. Free Radic Res, 2017, 51(7): 693-707.
33. DU L, ZONG Y, LI H, et al. Hyperuricemia and its related diseases: mechanisms and advances in therapy[J]. Signal Transduct Target Ther, 2024, 9(1): 212.
34. 樊玲, 杨欢, 罗宇, 等.脑小血管病患者血清尿酸水平和步态障碍之间的相关性[J].现代生物医学进展,2020,20(10):1897-1900.
35. LV H, SUN J, ZHANG T, et al. Associations of serum uric acid variability with neuroimaging metrics and cognitive decline: A population-based cohort study[J]. BMC Med, 2024, 22(1): 256.
36. VANNORSDALL T D, JINNAH H A, GORDON B, et al. Cerebral ischemia mediates the effect of serum uric acid on cognitive function[J/OL]. Stroke, 2008, 39(12): 3418-3420.
37. WEI C, YU X, WANG L, et al. Can hyperuricemia predict the progression risk of cerebral small vessel disease?[J]. Neurol Res, 2022, 44(10): 910-917.
38. VAN DER HOLSTA H M, TULADHARA A M, ZERBIC V, et al. White matter changes and gait decline in cerebral small vessel disease[J]. NeuroImage: Clinical vol, 2018, 17(8): 731-738.
39. VAN DER HOLST H M, VAN UDEN I W, TULADHAR AM, et al. Factors associated with 8⁃year mortality in older patients with cerebral small vessel disease: the Radboud University Nijmegen Diffusion tensor and Magnetic resonance Cohort (RUN DMC) Study[J]. JAMA Neurol, 2016, 73(4): 402⁃409.
40. WANG Y, LI Y, LIU S, et al. Gait characteristics related to fall risk in patients with cerebral small vessel disease[J]. Front Neurol, 2023, 14: 1166151.
41. YU L, YI M, GUO J, et al. Lower serum uric acid and impairment of right cerebral hemisphere structural brain networks are related to depressive symptoms in cerebral small vessel disease: A cross-pal study[J]. Heliyon, 2024, 10(6): e27947.
42. STAALS J, MAKIN S D, DOUBAL F N, et al. Stroke subtype, vascular risk factors, and total MRI brain small-vessel disease burden[J]. Neurology, 2014, 83(14): 1228-1234.
【引用格式】郑颖影,李羽萱,王凌敏 ,等.基于三维步态分析的脑小血管病步态障碍特征与血清尿酸水平的相关性研究[J]. 中国神经精神疾病杂志,2025,51(4):218-224.
【Cite this article】ZHENG Y Y, LI Y X,WANG L M,et al.Study on the correlation between gait disorder characteristics and serum uric acid levels in cerebral small vessel disease based on three-dimensional gait analysis[J]. Chin J Nervous Mental Dis,2025,51(4):218-224.
DOI:10.3969/j.issn.1002-0152.2025.04.003
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)