首页 > 医疗资讯/ 正文
摘要
自身免疫性肌炎(AIM)是一组以肌肉受累为主,可同时合并皮肤、肺和关节等多器官受累的自身免疫性疾病,是成人最常见的可治疗的骨骼肌疾病。尽管传统的免疫抑制治疗可使得大部分AIM患者能够得以缓解,但药物相关的不良反应以及疾病的高复发率和高致残率仍严重影响患者的生活质量。随着对AIM免疫病理机制认识的不断深入,针对本病免疫病理机制不同靶点的生物制剂为患者的治疗带来了新的希望。本研究对AIM的治疗进展进行了回顾。
自身免疫性肌炎(autoimmune myositis,AIM)是一组以肌肉受累为主,可同时合并皮肤、肺和关节等多器官受累的自身免疫性疾病,是成人最常见的可治疗的骨骼肌疾病。基于临床表现、自身抗体类型和肌肉病理特点3个维度目前将AIM主要分为皮肌炎(dermatomyositis,DM)、免疫介导的坏死性肌病(immune-mediated necrotizing myopathy,IMNM)、多发性肌炎(polymyositis,PM)、抗合成酶抗体综合征(antisynthetase syndrome,ASS)、包涵体肌炎(inclusion body myositis,IBM)等几个亚型。不同亚型的AIM在临床、抗体谱和肌肉病理表现有不同特征,提示其可能存在不同的免疫病理机制。因此,不同亚型AIM对药物治疗的反应及预后亦不尽相同。流行病学研究显示,AIM的发病率低,复发率高,约20%~60%的患者会经历1次或多次的复发。部分伴有快速进展的间质性肺病(interstitial lung disease,ILD)、肿瘤或特殊抗体的患者对常规药物反应治疗欠佳,致残率及死亡率较高。以上均提示AIM的治疗目前仍然充满了挑战性。本文将从以下方面对AIM的治疗进展进行回顾总结。
1 糖皮质激素治疗
糖皮质激素(以下简称激素)是AIM初始治疗方案中的基础用药。AIM患者确诊后应尽早给予激素治疗,自发病至启动治疗的时间越长,患者的临床预后越差;发病超过18个月以后开始给予激素治疗的患者可能效果不佳。
既往研究表明,当泼尼松初始剂量≤30 mg/d时,AIM患者的临床好转率明显低于泼尼松50~60 mg/d的方案。长期服用同等剂量的激素时,隔天1次服用方案较1次/d方案,能减少激素相关副作用的发生率,并且有助于提高AIM患者20年的整体生存率。目前激素的初始剂量一般为口服泼尼松(或等效剂量的甲泼尼松龙)1 mg/(kg·d),平均剂量60 mg/d,一般不超过80 mg/d。静脉应用甲泼尼龙(intravenous methylprednisolone,IVMP)冲击治疗在AIM中的证据较少,一般用于伴有吞咽困难或出现呼吸肌无力、ILD等临床病情较重的AIM患者。最近的一项回顾性研究发现,IVMP联合或者不联合静脉注射丙种球蛋白(intravenous immunoglobulin,IVIG)较单纯使用IVIG或口服药物治疗的AIM患者在治疗后1年内有更高的完全缓解率。
通常AIM的患者在激素治疗4~6周后肌酸激酶(creatine kinase,CK)开始下降,肌力开始恢复,此时可以考虑将激素逐渐减量。目前国内外尚无激素减量的统一方案,具体减量方案应该遵循个体化原则,总体可以参考治疗4~8周病情开始改善后,每个月减量幅度为当前剂量的20%~25%,逐渐减至5~10 mg/d,整体减量过程不少于6个月。长期应用激素的不良反应主要有骨质疏松、高血糖、高血压、白内障、肥胖等,应注意低碳水化合物、低脂肪、低盐、补钙和高蛋白饮食。补充钙剂,必要时可给予抗酸和补钾治疗。由于单用激素的AIM患者复发率高且常常不能完全缓解,加上长期应用激素的副作用明显,可考虑初始治疗的同时加用其他的免疫抑制剂。
AIM的患者长期应用激素治疗的同时应积极改变生活方式,建议高蛋白、低脂肪、低碳水化合物饮食,定期监测血糖、血脂和骨密度,评估骨折风险。每日补充钙剂1 000~1 200 mg,同时补充维生素D3 800~1 200 IU,维持血清25羟维生素D3水平30 ng/ml(75 nmol/L)以上。对于重度骨折疏松或骨质风险高的患者,可选择联合用药,双磷酸盐为一线用药,特立帕肽、地舒单抗等可作为二线用药。
2 非激素类免疫抑制剂
成人AIM中常用的免疫抑制剂包括细胞毒性药物和钙调磷酸酶抑制剂两大类。前者的主要药理作用是通过干扰细胞DNA的合成而影响淋巴细胞的增殖,包括甲氨蝶呤(methotrexate,MTX)、硫唑嘌呤(azathioprine,AZA)、霉酚酸酯(mycophenolate mofetil,MMF)、环磷酰胺(cyclophosphamide,CTX);后者的主要药理作用是通过抑制钙调磷酸酶的活性,特异性地抑制T淋巴细胞的活化、增殖和分化过程,包括环孢素A(cyclosporine A,CsA)和他克莫司(tacrolimus,Tac)。
上述免疫抑制剂的选择应根据患者的年龄、并发症、疾病严重程度等综合因素判断。既往多项回顾性研究结果显示,早期激素联合MTX或AZA的AIM治疗方案相较单用激素能减少激素的用量,有利于疾病恢复并更容易达到停用激素的状态。MTX可能优于AZA,但是有诱发ILD的风险,故不推荐已合并或有ILD高危风险的患者使用。2016年的一项针对青少年皮肌炎的多中心随机对照试验结果显示,激素联合MTX或CsA作为初始治疗方案,较单用激素更有利于达到临床缓解和停用激素;但是毛发增多、胃肠道症状等副作用在激素联合CsA组更明显;联合治疗较单用激素治疗组的感染风险明显增加。日本的两项回顾性研究结果显示,无论是初治或者复发的AIM患者,激素联合Tac与单用激素相比更有助于疾病的缓解并达到停用激素的结局。最近的一项Meta分析证实了Tac治疗AIM的安全性和有效性,且对改善合并ILD患者的肺功能有益。MMF作为联合治疗在AIM中的有效性亦在多项研究中得以证实,更多用于青少年DM以及伴有顽固性皮疹的患者。CTX一般用于病情较重或者难治性AIM,伴有快速进展的ILD或者合并系统性血管炎的患者;为了减少CTX的累积毒性作用,目前更多采用间断静脉冲击疗法。
尽管缺乏严格规范的临床试验证据,对于病情较重、合并症较多的AIM患者,早期加用免疫抑制剂,不仅有利于激素的减量和停药,同时有助于疾病的恢复并减少疾病复发。欧洲神经肌肉疾病中心的专家共识中推荐,对于IMNM的患者免疫抑制剂的减量和停药应在患者停用激素或最小量剂量激素维持治疗,病情持续稳定2年以上开始,并采用逐渐减量至停用。
3 皮肤损害的治疗
皮肤损害可以作为DM患者的主要或唯一的临床表现。当皮肤症状比较轻或范围比较局限时,通过防晒、局部使用激素或者钙调磷酸酶抑制剂(他克莫司或吡美莫司软膏)使部分患者的症状在一段时间内得到缓解。但是大部分DM患者的皮肤损害最终需要给予全身系统性的免疫抑制治疗。羟氯喹(hydroxychloroquine,HCQ)可以使75%的DM患者的皮损症状得以改善;应用HCQ时应注意其本身亦可能会发生皮疹(可见于12%~31%的患者)、视网膜毒性以及肌肉毒性,有时需要与原发病进行鉴别。其他传统的免疫抑制剂,除AZA对于DM患者的皮损表现治疗效果可能不理想以外,MTX、MMF以及钙调磷酸酶抑制剂均可以作为伴有顽固性皮疹DM患者的添加治疗。
IVIG可用于治疗伴有顽固性皮肤损害的DM患者。一项多中心随机对照临床试验(ProDERM)证实了IVIG在DM患者中的安全性及有效性。随后更大样本量分析证实,DM患者在IVIG治疗后不同严重程度的皮肤损害均可以得到改善。
利妥昔单抗(rituximab,RTX)可用于激素、常规免疫抑制剂和IVIG治疗效果不佳的难治性皮肤损害的DM患者。有两项研究显示,RTX可使67%~72%的难治性DM患者的皮肤症状获得明显改善。
Ⅰ型干扰素(type Ⅰ interferon,IFN-1)信号通路的活化在DM的发病机制中发挥着重要作用。JAK抑制剂通过抑制Janus激酶而阻断IFN-1的信号传导,其在DM治疗中的地位日显突出。多项研究显示,JAK抑制剂(托法替尼、巴瑞替尼、芦可替尼等)对青少年和成人DM患者的顽固性皮疹均有明显疗效,但肌无力的症状改善不明显。应用JAK抑制剂时应注意其潜在的心血管事件、感染、血管栓塞以及远期的肿瘤风险。
4 皮下钙化的治疗
钙化系因不可溶性的钙盐沉积于皮肤、皮下结缔组织、筋膜、肌腱和肌肉等软组织所致,可伴疼痛、感染、溃疡、关节挛缩等,是AIM的一种顽固的临床表现,见于约40%的青少年DM和20%的成人DM患者,以抗NXP-2抗体阳性的患者最为常见。皮下钙化可出现在疾病活动期,亦可以出现在疾病缓解期。长期的慢性炎症、反复卡压、缺血缺氧等都可能是促使钙化形成的因素,但其具体的形成机制尚不清楚。因此,早期强化诱导治疗、积极控制疾病活动对于预防皮下钙化至关重要。对于已经形成的钙化,尽管目前尚缺乏明确有效的药物和治疗指南,但有些药物已经显示出良好的应用前景。
双磷酸盐可以通过影响钙磷代谢而抑制钙质沉积,同时可以抑制巨噬细胞活性及前炎症因子的释放。双磷酸盐(主要包括口服阿伦磷酸盐和静脉注射帕米磷酸盐)作为辅助治疗在皮下钙化中的临床应用最为广泛:部分缓解率达50%~100%,完全缓解率最高达33%。
硫代硫酸钠具有抗氧化、血管扩张作用,同时作为一种钙离子螯合剂,可以减少不溶性钙的沉积。外用或局部注射硫代硫酸钠明显改善DM患者的皮下钙化D。
钙通道拮抗剂被认为可以通过抑制线粒体的钠-钙交换,减少胞内钙离子水平以及血管扩张作用等,来减少钙的异位沉积。有报道应用地尔硫卓治疗皮下钙化的部分缓解率为0%~64%,也有应用氢氧化铝和丙磺舒治疗皮下钙化有效的报道。近年来,多个病例报道显示JAK抑制剂可以使DM患者的皮下钙化明显减轻甚至消失,这为DM患者皮下钙化的治疗带来了新的希望。
外科切除可能有效解除因为钙化导致的疼痛、溃疡、神经卡压或关节功能障碍,但并非所有部位的钙化都适合行外科手术切除。而且,手术部位愈合不良、感染、窦道形成、局部坏死等并发症以及复发等因素影响手术治疗的选择。
5 AIM合并ILD的治疗
AIM患者合并ILD时可表现为急性、亚急性和慢性进程。病程<1个月者为急性;1个月内出现进行性加重的憋喘、低氧等临床表现,同时高清胸部CT显示纤维化进展者,称为快速进展的ILD(rapidly progressive ILD,RP-ILD)。病程1~2个月为亚急性;病程超过3个月者则为慢性。ILD尤其是RP-ILD是AIM患者死亡的一个重要原因。临床实践中,ILD的治疗应根据疾病进展的速度、肺部病变的严重程度、抗体类型以及患者自身条件等综合因素来制定治疗方案(见图1)。
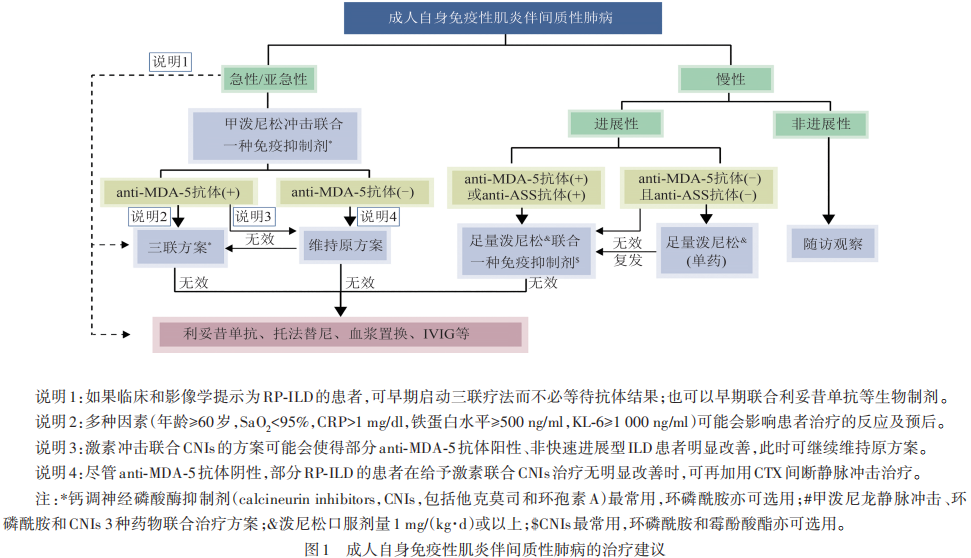
对于慢性且无进展的患者,可暂不给予特殊的药物干预,但需要定期监测。对于慢性进展型患者,若抗体ASS抗体和抗MDA抗体阴性,可以先给予足量泼尼松单药治疗,并密切监测临床症状、肺功能及胸部影像学的变化;而对于合并抗ASS或MDA-5抗体阳性者,建议给予激素治疗的同时加用一种免疫抑制剂(CNIs最常选用,MMF、CTX亦可选用)。
对于抗MDA-5抗体阴性的RP-ILD患者,可选用IVMP冲击治疗的同时加用一种免疫抑制剂(CNIs最常选用,CTX亦可选用)。而对于抗MDA-5抗体阳性的RP-ILD的患者,常常需要“三联方案”(甲泼尼松静脉冲击+CNIs+CTX静脉冲击)。血浆置换可以降低患者体内的炎性因子及抗MDA5抗体滴度,提高患者的生存率,可以作为此类患者的补救方案。抗MDA5抗体阳性的AIM-ILD患者,如果同时合并多个预后不佳的危险因素(患者年龄≥60岁,SaO2<95%,CRP>1 mg/dl,铁蛋白水平≥500 mg/dl,涎液化糖链抗原-6≥1 000 U/ml),提示该患者极有可能发展为RP-ILD,应尽早启动“三联方案”。
对于进展迅速、病情严重的ILD患者,除了IVMP冲击治疗以外,也可以治疗初期即给予RTX治疗,后者在AIM或者其他的结缔组织病相关的ILD中的有效性已经被多项研究证实。此外,越来越多的数据显示,JAK抑制剂托法替布联合激素作为诱导治疗,可以有效降低血清铁蛋白水平,改善患者的肺功能和胸部CT表现,提高患者的生存率。IVIG可能使部分AIM-ILD的患者获益,但其在AIM相关ILD中应用研究有限,可以作为AIM-ILD患者的添加治疗。值得注意的是,多种免疫抑制联合治疗时,患者感染风险明显增加,应注意加强预防。胸部影像学有陈旧性结核灶的患者,可考虑给予口服异烟肼进行预防性治疗。巨细胞病毒感染会加重肺间质纤维化的进展,病毒核酸检测能够帮助早期诊断,及时启动抗病毒治疗。对于机会性感染风险高的患者,亦可考虑给予口服复方新诺明1片/d,或者2片/d×3 d/周,连续服用1个月,预防卡氏肺孢子虫感染。此外,2014年抗纤维化药物尼达尼布被美国FDA批准用于慢性特发性ILD患者的治疗,但此类药物在AIM相关的ILD中的应用能否使患者获益并不清楚,故目前不作为常规推荐应用于AIM相关的ILD患者。
6 难治性AIM的治疗
对于难治性AIM,目前尚缺乏一个统一、明确的定义。根据既往的经验和临床研究中的标准,一般认为足量泼尼松[≥1 mg/(kg·d)]口服至少6~8周以上,联合IVIG或者至少2种有效剂量的免疫抑制剂治疗3个月以上,仍不能达到国际肌炎评估和临床研究(International Myositis Assessment and Clinical Studies,IMACS)定义的轻度改善标准,则被认为是难治性AIM。对于难治性AIM患者持续不改善的肌无力症状,首先应该明确是由持续活动的肌肉炎症损伤引起,还是由严重的肌肉损伤后修复缓慢或修复困难(萎缩或脂肪化)所致。此外,还应注意鉴别患者是否合并类固醇肌病以及AIM的诊断是否正确。复查血清CK、肌肉核磁、肌电图检查,必要时重复肌肉活检和基因检测有助于鉴别上述情况。
以抗HMGCR或抗SRP抗体阳性为代表的IMNM患者肌肉破坏重、病情进展快,容易发展为难治性AIM。几乎所有的IMNM患者(78%~100%)都需要包括激素在内的2种或以上的免疫抑制治疗。因此,对于诊断明确、病情较重的IMNM患者,可考虑初始治疗即给予大剂量激素联合一种免疫抑制剂,或加用RTX或IVIG进行诱导治疗。
RTX可使SRP抗体阳性的患者病情明显改善,但在HMGCR抗体阳性患者的效果并不肯定。2014年的一项RTX治疗难治性ASS的开放性标签Ⅱ期临床试验结果中,70%的患者肌力可以得到改善。2017年的一项回顾性病例系列研究发现,81.8%的难治性DM患者在RTX治疗后肌力可得以改善。以上研究结果提示,RTX同样可以改善ASS和DM患者的肌无力症状。
RTX治疗AIM的传统剂量为375 mg/(m2·次)(每周1次,连续4周)或750 mg/(m2·次)×2次(最大不超过1g/次,间隔2周);感染风险高的AIM患者可尝试低剂量方案(500 mg/次×2次,间隔2周,或100 mg/(次·周),连续4周)。有报道静脉输注RTX时,0.3%~37%的患者可以发生输液反应,必要时可在应用RTX前1 h给予甲泼尼松100 mg静脉点滴,前30 min内给予扑热息痛及抗组胺药物以减少输液反应的发生。应用RTX前应完善淋巴细胞亚群(CD19/CD20/CD27/CD4/CD8)以及丙种球蛋白水平(IgGM/IgA)的检测,并在第3个月及以后的每个月复查;对于低丙种球蛋白血症并反复感染的患者可以给予IVIG辅助治疗。由于RTX发挥免疫抑制作用可能需要2个月的时间,故一般建议激素在应用RTX的2个月以后再减量。
IVIG可以作为所有类型难治性AIM的添加治疗,用法为2 g/(kg·月),持续3~6个月。此外,静脉注射CTX、血浆置换也可以作为难治性和危重AIM患者的添加治疗。JAK抑制剂主要用于顽固性皮疹的DM患者,对于是否能够同时改善DM患者的肌肉症状,相关研究结果结论尚不统一。
其他新型靶向药T淋巴细胞激活抑制剂阿巴西普(abatacep),IL-1受体拮抗剂阿那白滞素(anakinra),IL-2α受体的单克隆抗体巴利昔单抗(basiliximab),人源化针对IL-6受体的单克隆抗体托珠单抗(tocilizumab),重组的全人源化IFNα单克隆抗体西法木单抗(sifalimumab),肿瘤坏死因子α抑制剂英夫利昔单抗(infliximab)、阿达木单抗(adalimumab)、依那西普(etanercept)等均有报道用于尝试治疗难治性AIM,但由于病例数较少,其确切疗效尚不能肯定。
7 妊娠和哺乳期AIM患者的治疗
妊娠和哺乳期AIM患者的治疗,需要兼顾母亲AIM疾病活动和胎儿及哺乳期婴儿的安全。既往其他自身免疫病的病例和病例系列报告研究结果显示,孕妇接受泼尼松治疗(孕期疗程>37周)期间,新生儿体重未受到明显的影响,且对胎儿无明显致畸作用。糖皮质激素(泼尼松和甲泼尼龙)可经胎盘代谢,进入胎儿体内的活性药物浓度不足10%。有报告显示,哺乳期女性口服80 mg/kg泼尼松,婴儿体内的药物浓度可能也仅为10 μg/kg,低于婴儿自身分泌可的松量的10%。故女性在孕期和哺乳期使用泼尼松或甲泼尼松是相对比较安全的。
既往多项回顾性研究结果显示,治疗剂量的HCQ(200~400 mg/d)不增加任何不良的妊娠结局,对孕妇、胎儿及母乳喂养的婴儿均无明显不良影响,可用于孕期及哺乳期的女性患者。孕期服用低剂量的AZA[<2 mg/(kg·d)]不增加早产或致畸风险;AZA的代谢物6-巯基嘌呤到达母乳喂养的婴儿体内的含量不足母体剂量的1%[<0.008 mg/(kg·d)],故妊娠和哺乳期使用AZA是相对安全的。既往对器官移植及其他自身免疫病的观察研究发现,母亲孕期接受CsA[2~6 mg/(kg·d)]治疗并未增加胎儿畸形或低体重儿的风险;由于无法排除原发病的影响,无法评估CsA对早产的影响。CsA在乳汁中的分泌极少,宫内或母乳喂养时母亲应用CsA对婴儿的免疫系统并不造成明显的影响。在既往器官移植以及其他自身免疫病的观察研究中发现,孕期使用Tac并未明显增加流产或胎儿畸形的风险;Tac通过母乳喂养进入婴儿体内的含量极低,孕期和哺乳期应用他克莫司是相对安全的。IVIG在哺乳期应用的安全性目前尚无研究报道,但理论上,妊娠或哺乳期患者应用IVIG对孕产妇、胎儿或者婴幼儿不会造成不良后果,但应注意血栓栓塞的风险。
MTX(平均剂量10 mg/周)可显著增加胎儿自然流产和先天畸形的发生率;但在孕前3个月内停用MTX(平均剂量15 mg/周)的136例孕妇中,流产或先天畸形风险并没有明显增加。MTX不影响男性生育能力,男性患者服用MTX(≤30 mg/周)时,也不增加母亲流产及胎儿畸形的风险。CTX具有明确的性腺毒性及胎儿致畸作用,故有生育需求的男女双方均不推荐应用CTX。MMF具有明确的致畸作用,故不推荐孕期使用;根据药代动力学研究,服用MMF的患者应至少在受孕前6周停用该药;既往证据级别较低的队列研究结果中,未发现男性服用MMF对胎儿造成的不良影响。在一份全球药物安全数据库中的研究报告结果显示,大多数孕期接受RTX治疗的女性为血液系统疾病患者,胎儿先天畸形的发生率为2.2%,新生儿可发生一过性的血液系统异常(包括淋巴细胞减少、B细胞耗竭等),但这些婴儿并没有发生明确的感染。为了最大程度的减少RTX造成的妊娠不良结局,一般建议受孕前至少6个月停用RTX。
8 AIM患者的康复治疗
越来越多的证据表明,物理治疗在AIM患者中是安全、有益的。一项小样本对照研究结果显示,有氧耐力训练不仅可以通过提高AIM患者肌肉的有氧代谢能力、促进肌纤维重塑和毛细血管生长,同时可能还有抗炎、抗纤维化的作用。此外,一项针对活动期AIM患者的研究证实,居家抗阻训练并不会增加AIM患者的肌酸激酶水平,亦不会影响肌肉磁共振成像表现和肌肉病理中的炎细胞浸润程度。AIM患者在药物治疗的同时辅以适当的物理治疗不仅可以帮助患者提高肌力和改善日常生活功能,减少因长期服用激素或废用造成的肌肉萎缩及其他损害,还可以提高成骨细胞的活性而保护骨质。AIM患者的物理治疗主要以有氧运动和抗阻训练为主,其训练计划应该在以低负荷/低强度的运动开始,根据患者的耐受力和适应力逐渐增加运动强度。运动锻炼应该作为AIM患者的一项标准治疗,在专业医师的监督下开展并且进行规律的随访评估以达到最佳水平。
总之,AIM做为一种可治疗的自身免疫性疾病,激素和传统的免疫抑制剂仍然是一线用药,各种生物靶向药的出现将会在AIM尤其是难治性患者的治疗中发挥着越来越重要的作用。早期精准诊断、足量足疗程规范治疗和长程综合管理对AIM患者的预后至关重要。
参考文献
[1]Lundberg IE,Fujimoto M,Vencovsky J,et al. Idiopathic inflammatory myopathies[J]. Nat Rev Dis Primers,2021,7(1):86.
[2]Tanboon J,Uruha A,Stenzel W,et al. Where are we moving in the classification of idiopathic inflammatory myopathies?[J]. Curr Opin Neurol,2020,33(5):590-603.
[3]Meyer A,Meyer N,Schaeffer M,et al. Incidence and prevalence of inflammatory myopathies:a systematic review[J]. Rheumatology (Oxford),2015,54(1):50-63.
[4]van de Vlekkert J,Hoogendijk JE,de Visser M. Long-term follow-up of 62 patients with myositis[J]. J Neurol,2014,261(5):992-998.
[5]Kohsaka H,Mimori T,Kanda T,et al. Treatment consensus for management of polymyositis and dermatomyositis among rheumatologists,neurologists and dermatologists[J]. J Dermatol,2019,46(1):e1-e18.
[6]Espinosa-Ortega F,Holmqvist M,Dastmalchi M,et al. Factors associated with treatment response in patients with idiopathic inflammatory myopathies:a registry-based study[J]. Arthritis Care Res (Hoboken),2022,74(3):468-477.
[7]Saygin D,Oddis CV. Glucocorticoids in myositis:initiation,tapering,and discontinuation[J]. Curr Rheumatol Rep,2022,24(3):47-53.
[8]Uchino M,Yamashita S,Uchino K,et al. Long-term outcome of polymyositis treated with high single-dose alternate-day prednisolone therapy[J]. Eur Neurol,2012,68(2):117-121.
[9]Oddis CV,Aggarwal R. Treatment in myositis[J]. Nat Rev Rheumatol,2018,14(5):279-289.
[10]Hoff LS,de Souza FHC,Miossi R,et al. Long-term effects of early pulse methylprednisolone and intravenous immunoglobulin in patients with dermatomyositis and polymyositis[J]. Rheumatology (Oxford),2022,61(4):1579-1588.
[11]中华医学会风湿病学分会. 多发性肌炎和皮肌炎诊断及治疗指南 [J]. 中华风湿病学杂志,2010,14(12):828-831.
[12]van de Vlekkert J,Hoogendijk JE,de Haan RJ,et al. Oral dexamethasone pulse therapy versus daily prednisolone in sub-acute onset myositis,a randomised clinical trial[J]. Neuromuscul Disord,2010,20(6):382-389.
[13]Conticini E,Dourado E,Bottazzi F,et al. Idiopathic inflammatory myopathies:one year in review 2023[J].Clin Exp Rheumatol,2024,42(2):213-224.
[14]Vincze A,Gaál J,Griger Z. Bone health in idiopathic inflammatory myopathies:diagnosis and management[J]. Curr Rheumatol Rep,2021,23(7):55.
[15]Hsu E,Nanes M. Advances in treatment of glucocorticoid-induced osteoporosis[J]. Curr Opin Endocrinol Diabetes Obes,2017,24(6):411-417.
[16]Kenneth Murphy CW.Janeway’s Immunobiology [M]. 9th ed:Garland Publishing Inc,2016.
[17]Casal-Dominguez M,Pinal-Fernandez I,Huapaya J,et al. Efficacy and adverse effects of methotrexate compared with azathioprine in the antisynthetase syndrome[J]. Clin Exp Rheumatol,2019,37(5):858-861.
[18]Keyßer G,Zierz S,Kornhuber M. Treatment of adult idiopathic inflammatory myopathies with conventional immunosuppressive drugs:Results of a retrospective study[J]. Z Rheumatol,2019,78(2):183-189.
[19]Ruperto N,Pistorio A,Oliveira S,et al. Prednisone versus prednisone plus ciclosporin versus prednisone plus methotrexate in new-onset juvenile dermatomyositis:a randomised trial[J]. Lancet,2016,387(10019):671-678.
[20]Ueno KI,Shimojima Y,Kishida D,et al. Advantage of administering tacrolimus for improving prognosis of patients with polymyositis and dermatomyositis[J]. Int J Rheum Dis,2016,19(12):1322-1330.
[21]Yokoyama Y,Furuta S,Ikeda K,et al. Corticosteroid-sparing effect of tacrolimus in the initial treatment of dermatomyositis and polymyositis[J]. Mod Rheumatol,2015,25(6):888-892.
[22]Liao J,Peng X,Liu J,et al. The efficacy and safety of tacrolimus in patients with dermatomyositis/polymyositis:a meta-analysis and systematic review[J]. Eur J Intern Med,2023,110:35-40.
[23]Rouster-Stevens KA,Morgan GA,Wang D,et al. Mycophenolate mofetil:a possible therapeutic agent for children with juvenile dermatomyositis[J]. Arthritis Care Res (Hoboken),2010,62(10):1446-1451.
[24]Majithia V,Harisdangkul V. Mycophenolate mofetil (CellCept):an alternative therapy for autoimmune inflammatory myopathy[J]. Rheumatology (Oxford),2005,44(3):386-389.
[25]Quan XY,Chen HT,Liang SQ,et al. Revisited cyclophosphamide in the treatment of lupus nephritis[J]. Biomed Res Int,2022,2022:8345737.
[26]Oldroyd AGS,Lilleker JB,Amin T,et al. British Society for Rheumatology guideline on management of paediatric,adolescent and adult patients with idiopathic inflammatory myopathy[J]. Rheumatology(Oxford),2022,61(5):1760-1768.
[27]Allenbach Y,Mammen AL,Benveniste O,et al. 224th ENMC International workshop:Clinico-sero-pathological classification of immune-mediated necrotizing myopathies zandvoort,the netherlands,14-16 October 2016[J]. Neuromuscul Disord,2018,28(1):87-99.
[28]Sevim E,Kobrin D,Casal-Dominguez M,et al. A comprehensive review of dermatomyositis treatments-from rediscovered classics to promising horizons[J]. Expert Rev Clin Immunol,2024,20(2):197-209.
[29]Quain RD,Werth VP. Management of cutaneous dermatomyositis[J]. Am J Clin Dermatol,2006,7(6):341-351.
[30]Aggarwal R,Charles-Schoeman C,Schessl J,et al. Trial of intravenous immune globulin in dermatomyositis[J]. N Engl J Med,2022,387(14):1264-1278.
[31]Werth VP,Aggarwal R,Charles-Schoeman C,et al. Efficacy of intravenous immunoglobulins (IVIg) in improving skin symptoms in patients with dermatomyositis:a post-hoc analysis of the ProDERM study[J]. EClinicalMedicine,2023,64:102234.
[32]Kuye IO,Smith GP. The use of rituximab in the management of refractory dermatomyositis[J]. J Drugs Dermatol,2017,16(2):162-166.
[33]Paik JJ,Lubin G,Gromatzky A,et al. Use of Janus kinase inhibitors in dermatomyositis:a systematic literature review[J]. Clin Exp Rheumatol,2023,41(2):348-358.
[34]Beckett M,Tan J,Bonnardeaux E,et al. Tofacitinib therapy in refractory inflammatory myositis:a retrospective cohort study of 41 patients[J]. Rheumatology (Oxford),2024,63(5):1432-1436.
[35]Davuluri S,Duvvuri B,Lood C,et al. Calcinosis in dermatomyositis:Origins and possible therapeutic avenues[J]. Best Pract Res Clin Rheumatol,2022,36(2):101768.
[36]Traineau H,Aggarwal R,Monfort JB,et al. Treatment of calcinosis cutis in systemic sclerosis and dermatomyositis:a review of the literature[J]. J Am Acad Dermatol,2020,82(2):317-325.
[37]江薇,李嗣钊,杨阚波,等.成人皮肌炎合并皮下钙化的治疗、生存率及预后因素分析[J].临床内科杂志,2018,35(7):4.
[38]Kul Cinar O,Papadopoulou C,Pilkington CA. Treatment of calcinosis in juvenile dermatomyositis[J]. Curr Rheumatol Rep,2021,23(2):13.
[39]Nowaczyk J,Zawistowski M,Fiedor P. Local,non-systemic,and minimally invasive therapies for calcinosis cutis:a systematic review[J]. Arch Dermatol Res,2022,314(6):515-525.
[40]Wendel S,Venhoff N,Frye BC,et al. Successful treatment of extensive calcifications and acute pulmonary involvement in dermatomyositis with the Janus-Kinase inhibitor tofacitinib-A report of two cases[J]. J Autoimmun,2019,100:131-136.
[41]Shneyderman M,Ahlawat S,Christopher-Stine L,et al. Calcinosis in refractory dermatomyositis improves with tofacitinib monotherapy:a case series[J]. Rheumatology(Oxford),2021,60(11):e387-e388.
[42]Sözeri B,Demir F. A striking treatment option for recalcitrant calcinosis in juvenile dermatomyositis:tofacitinib citrate[J]. Rheumatology (Oxford),2020,59(12):e140-e141.
[43]王亚飞,李红霞,吴振彪. 肌炎相关间质性肺病的治疗进展 [J]. 中华风湿病学杂志,2022,26(7):480-485.
[44]Kondoh Y,Makino S,Ogura T,et al. 2020 guide for the diagnosis and treatment of interstitial lung disease associated with connective tissue disease[J]. Respir Investig,2021,59(6):709-740.
[45]Liu L,Zhang Y,Liu S,et al. Compounded sulfamethoxazole improved the prognosis of dermatomyositis patients positive with anti-melanoma differentiation-associated gene 5[J]. Rheumatology (Oxford),2023,62(9):3095-3100.
[46]So H,Wong VTL,Lao VWN,et al. Rituximab for refractory rapidly progressive interstitial lung disease related to anti-MDA5 antibody-positive amyopathic dermatomyositis[J]. Clin Rheumatol,2018,37(7):1983-1989.
[47]Tsuji H,Nakashima R,Hosono Y,et al. Multicenter prospective study of the efficacy and safety of combined immunosuppressive therapy with high-dose glucocorticoid,tacrolimus,and cyclophosphamide in interstitial lung diseases accompanied by anti-melanoma differentiation-associated gene 5-positive dermatomyositis[J].Arthritis Rheumatol,2020,72(3):488-498.
[48]Shirakashi M,Nakashima R,Tsuji H,et al. Efficacy of plasma exchange in anti-MDA5-positive dermatomyositis with interstitial lung disease under combined immunosuppressive treatment[J]. Rheumatology (Oxford),2020,59(11):3284-3292.
[49]Abe Y,Kusaoi M,Tada K,et al. Successful treatment of anti-MDA5 antibody-positive refractory interstitial lung disease with plasma exchange therapy[J]. Rheumatology (Oxford),2020,59(4):767-771.
[50]Romero-Bueno F,Del Campo PD,Trallero-Araguás E,et al. Recommendations for the treatment of anti-melanoma differentiation-associated gene 5-positive dermatomyositis-associated rapidly progressive interstitial lung disease[J].Semin Arthritis Rheum,2020,50(4):776-790.
[51]Vicente-Rabaneda EF,Serra López-Matencio JM,Ancochea J,et al. Efficacy and safety of biological drugs in interstitial lung disease associated with connective tissue diseases[J]. Expert Opin Drug Saf,2022,21(3):311-333.
[52]He C,Li W,Xie Q,et al. Rituximab in the treatment of interstitial lung diseases related to anti-melanoma differentiation-associated gene 5 dermatomyositis:a systematic review[J]. Front Immunol,2022,12:820163.
[53]Ge Y,Li S,Tian X,et al. Anti-melanoma differentiation-associated gene 5 (MDA5) antibody-positive dermatomyositis responds to rituximab therapy[J].Clin Rheumatol,2021,40(6):2311-2317.
[54]Duarte AC,Cordeiro A,Fernandes BM,et al. Rituximab in connective tissue disease-associated interstitial lung disease[J]. Clin Rheumatol,2019,38(7):2001-2009.
[55]Chen Z,Wang X,Ye S. Tofacitinib in amyopathic dermatomyositis-associated interstitial lung disease[J]. N Engl J Med,2019,381(3):291-293.
[56]Kurasawa K,Arai S,Namiki Y,et al. Tofacitinib for refractory interstitial lung diseases in anti-melanoma differentiation-associated 5 gene antibody-positive dermatomyositis[J].Rheumatology(Oxford),2018,57(12):2114-2119.
[57]Wang LM,Yang QH,Zhang L,et al. Intravenous immunoglobulin for interstitial lung diseases of anti-melanoma differentiation-associated gene 5-positive dermatomyositis[J].Rheumatology (Oxford),2022,61(9):3704-3710.
[58]Wilfong EM,Aggarwal R. Role of antifibrotics in the management of idiopathic inflammatory myopathy associated interstitial lung disease[J]. Ther Adv Musculoskelet Dis,2021,13:1759720X211060907.
[59]Brandão M,Marinho A. Idiopathic inflammatory myopathies:definition and management of refractory disease[J].Autoimmun Rev,2011,10(11):720-724.
[60]Paik JJ,Casciola-Rosen L,Shin JY,et al. Study of tofacitinib in refractory dermatomyositis:an open-label pilot study of ten patients[J]. Arthritis Rheumatol,2021,73(5):858-865.
[61]Danieli MG,Pettinari L,Moretti R,et al. Subcutaneous immunoglobulin in polymyositis and dermatomyositis:a novel application[J]. Autoimmun Rev,2011,10(3):144-149.
[62]Oddis CV,Reed AM,Aggarwal R,et al. Rituximab in the treatment of refractory adult and juvenile dermatomyositis and adult polymyositis:a randomized,placebo-phase trial[J]. Arthritis Rheum,2013,65(2):314-324.
[63]Lundberg IE.Expert perspective:management of refractory inflammatory myopathy[J]. Arthritis Rheumatol,2021,73(8):1394-1407.
[64]Kassardjian CD,Lennon VA,Alfugham NB,et al.Clinical features and treatment outcomes of necrotizing autoimmune myopathy[J]. JAMA Neurol,2015,72(9):996-1003.
[65]Allenbach Y,Benveniste O,Stenzel W,et al. Immune-mediated necrotizing myopathy:clinical features and pathogenesis[J]. Nat Rev Rheumatol,2020,16(12):689-701.
[66]Ramanathan S,Langguth D,Hardy TA,et al. Clinical course and treatment of anti-HMGCR antibody-associated necrotizing autoimmune myopathy[J]. Neurol Neuroimmunol Neuroinflamm,2015,2(3):e96.
[67]Landon-Cardinal O,Allenbach Y,Soulages A,et al. Rituximab in the treatment of refractory anti-HMGCR immune-mediated necrotizing myopathy[J]. J Rheumatol,2019,46(6):623-627.
[68]Allenbach Y,Guiguet M,Rigolet A,et al. Efficacy of rituximab in refractory inflammatory myopathies associated with anti-synthetase auto-antibodies:an open-label,phase Ⅱ trial[J].PLoS One,2015,10(11):e0133702.
[69]Piehl F,Eriksson-Dufva A,Budzianowska A,et al. Efficacy and safety of rituximab for new-onset generalized myasthenia gravis:the RINOMAX randomized clinical trial[J]. JAMA Neurol,2022,79(11):1105-1112.
[70]Tahara M,Oeda T,Okada K,et al. Safety and efficacy of rituximab in neuromyelitis optica spectrum disorders (RIN-1 study):a multicentre,randomised,double-blind,placebo-controlled trial[J].Lancet Neurol,2020,19(4):298-306.
[71]Nepal G,Shing YK,Yadav JK,et al. Efficacy and safety of rituximab in autoimmune encephalitis:a meta-analysis[J]. Acta Neurol Scand,2020,142(5):449-459.
[72]Ciron J,Audoin B,Bourre B,et al. Recommendations for the use of Rituximab in neuromyelitis optica spectrum disorders[J]. Rev Neurol (Paris),2018,174(4):255-264.
[73]Moghadam-Kia S,Oddis CV. Current and new targets for treating myositis[J]. Curr Opin Pharmacol,2022,65:102257.
[74]Aggarwal R,Charles-Schoeman C,Schessl J,et al. Prospective,double-blind,randomized,placebo-controlled phase Ⅲ study evaluating efficacy and safety of octagam 10% in patients with dermatomyositis (“ProDERM Study”)[J].Medicine (Baltimore),2021,100(1):e23677.
[75]Gandiga PC,Ghetie D,Anderson E,et al. Intravenous immunoglobulin in idiopathic inflammatory myopathies:a practical guide for clinical use[J]. Curr Rheumatol Rep,2023,25(8):152-168.
[76]Papadopoulou C,Hong Y,Omoyinmi E,et al. Janus kinase 1/2 inhibition with baricitinib in the treatment of juvenile dermatomyositis[J]. Brain,2019,142(3):e8.
[77]Khoo T,Limaye V. Biologic therapy in the idiopathic inflammatory myopathies[J]. Rheumatol Int,2020,40(2):191-205.
[78]Mecacci F,Bianchi B,Pieralli A,et al. Pregnancy outcome in systemic lupus erythematosus complicated by anti-phospholipid antibodies[J]. Rheumatology (Oxford),2009,48(3):246-249.
[79]Hussein SZ,Jacobsson LTH,Lindquist PG,et al. Pregnancy and fetal outcome in women with primary Sjögren’s syndrome compared with women in the general population:a nested case-control study[J]. Rheumatology (Oxford),2011,50(9):1612-1617.
[80]Flint J,Panchal S,Hurrell A,et al. BSR and BHPR guideline on prescribing drugs in pregnancy and breastfeeding-Part I:standard and biologic disease modifying anti-rheumatic drugs and corticosteroids[J]. Rheumatology (Oxford),2016,55(9):1693-1697.
[81]Østensen M,Khamashta M,Lockshin M,et al. Anti-inflammatory and immunosuppressive drugs and reproduction[J]. Arthritis Res Ther,2006,8(3):209.
[82]Ruiz-Irastorza G,Ramos-Casals M,Brito-Zeron P,et al. Clinical efficacy and side effects of antimalarials in systemic lupus erythematosus:a systematic review[J]. Ann Rheum Dis,2010,69(1):20-28.
[83]Christensen LA,Dahlerup JF,Nielsen MJ,et al. Azathioprine treatment during lactation[J].Aliment Pharmacol Ther,2008,28(10):1209-1213.
[84]Biggioggero M,Borghi MO,Gerosa M,et al. Immune function in children born to mothers with autoimmune diseases and exposed in utero to immunosuppressants[J]. Lupus,2007,16(8):651-656.
[85]Motta M,Ciardelli L,Marconi M,et al. Immune system development in infants born to mothers with autoimmune disease,exposed in utero to immunosuppressive agents[J].Am J Perinatol,2007,24(8):441-447.
[86]Østensen M,Lockshin M,Doria A,et al. Update on safety during pregnancy of biological agents and some immunosuppressive anti-rheumatic drugs[J]. Rheumatology (Oxford),2008,47(Suppl 3):Ⅲ28-Ⅲ31.
[87]Weber-Schoendorfer C,Chambers C,Wacker E,et al. Pregnancy outcome after methotrexate treatment for rheumatic disease prior to or during early pregnancy:a prospective multicenter cohort study[J]. Arthritis Rheumatol,2014,66(5):1101-1110.
[88]Weber-Schoendorfer C,Hoeltzenbein M,Wacker E,et al. No evidence for an increased risk of adverse pregnancy outcome after paternal low-dose methotrexate:an observational cohort study[J]. Rheumatology (Oxford),2014,53(4):757-763.
[89]Armenti VT,Moritz MJ,Jarrell BE,et al. Pregnancy after transplantation[J]. Transplant Rev,2000,14(3):145-157.
[90]Jones A,Clary MJ,McDermott E,et al. Outcomes of pregnancies fathered by solid-organ transplant recipients exposed to mycophenolic acid products[J]. Prog Transplant,2013,23(2):153-157.
[91]Chakravarty EF,Murray ER,Kelman A,et al. Pregnancy outcomes after maternal exposure to rituximab[J]. Blood,2011,117(5):1499-1506.
[92]Alexanderson H. Physical exercise as a treatment for adult and juvenile myositis[J]. J Intern Med,2016,280(1):75-96.
[93]Munters LA,Loell I,Ossipova E,et al. Endurance exercise improves molecular pathways of aerobic metabolism in patients with myositis[J]. Arthritis Rheumatol,2016,68(7):1738-1750.
[94]Alexanderson H,Stenström CH,Jenner G,et al. The safety of a resistive home exercise program in patients with recent onset active polymyositis or dermatomyositis[J].Scand J Rheumatol,2000,29(5):295-301.
[95]蒋 澄,林永娟,李 凤,等.强直性肌营养不良I型临床、病理、骨骼肌磁共振特点[J].中风与神经疾病杂志,2022,39(1):33-37.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)