首页 > 医疗资讯/ 正文
光热治疗(PTT)是一种具有前景的微创肿瘤消融方法,其利用激光照射光热剂产生的局部热量来杀伤肿瘤细胞,具有微创和全身毒性低等优点。然而,PTT 在临床应用中存在一些挑战,包括光热剂在肿瘤中的积累不足以及肿瘤根除不彻底等问题,从而限制了PTT的抗肿瘤疗效。因此,迫切需要新的策略来最大限度地发挥 PTT 的抗肿瘤效果。
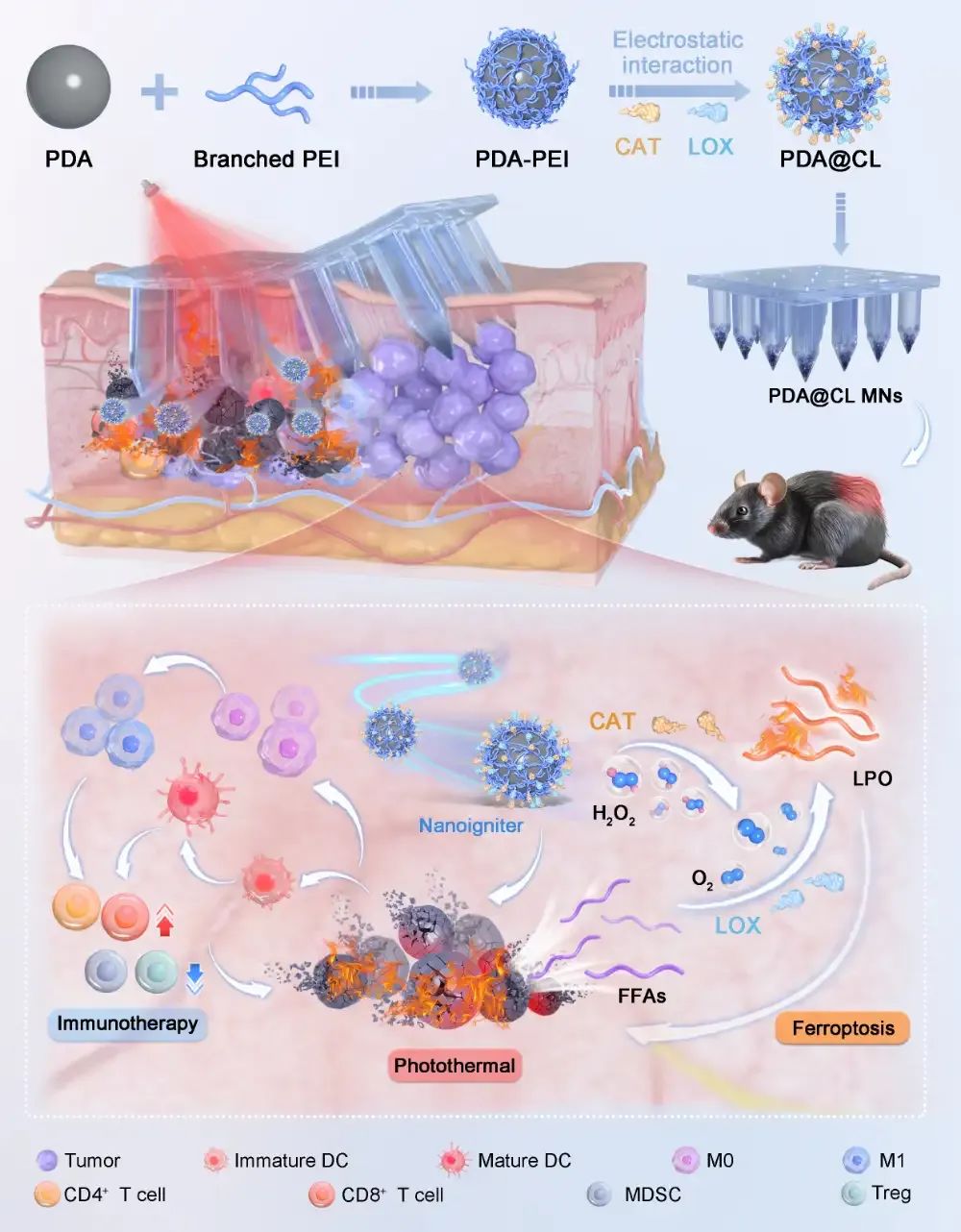
近日,中山大学潘昕教授团队在ACS NANO上发表了题为“Nanoigniter-Integrated Microneedle Patches for Boosted Photothermal Mediated Multimodal Therapy: In-situ Tumor Microenvironment Igniting Strategy”的研究性论文。文章第一作者是中山大学硕士研究生彭思远。本研究关注到PTT对肿瘤的细胞外代谢异质性的影响,构建了一种以聚多巴胺(PDA)与聚乙烯亚胺(PEI)共价结合为光热材料的共载脂肪氧化酶(LOX)和过氧化氢酶(CAT)的可溶微针递送系统PDA@CL MNs。一方面,该制剂基于TME中高表达过氧化氢和PTT后细胞外游离脂肪酸含量的增加,通过CAT催化过氧化氢为LOX催化FFAs持续供氧,以此形成级联催化点燃策略提高脂质过氧化物(LPO)的生成,诱导细胞铁死亡的发生,增强PTT的抗肿瘤效果;另一方面,PTT和细胞铁死亡后大量肿瘤相关抗原和损伤相关分子模式的释放,诱导免疫原性细胞死亡,激活抗肿瘤免疫,进一步放大PTT的治疗效果。最终利用可溶微针增强药物在病灶部位深部蓄积的能力,实现原位肿瘤微环境(TME)点燃策略,并联用免疫检查点抑制剂(αPD-L1)放大纳米点火器的全身免疫和抗肿瘤免疫,以增强光热/铁死亡/免疫多模态治疗的抗肿瘤疗效。
【本文要点】
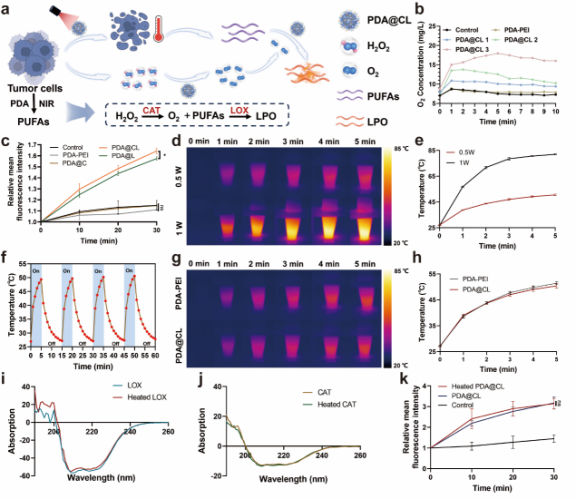
1. 首先验证LOX和CAT的级联催化能够促进LPO的生成。随后通过调节PDA和PEI的比例,筛选具有理想粒径和正电的PDA-PEI纳米粒,并通过静电作用将一定比例的CAT和LOX吸附到纳米粒表面。构建的纳米粒点火器PDA@CL的粒径分布均一,结构完整,并具有良好的级联催化效果和光热转换性能,满足设想的点燃需求。此外,所设置的光热升温温度不会影响酶的结构和催化活性。
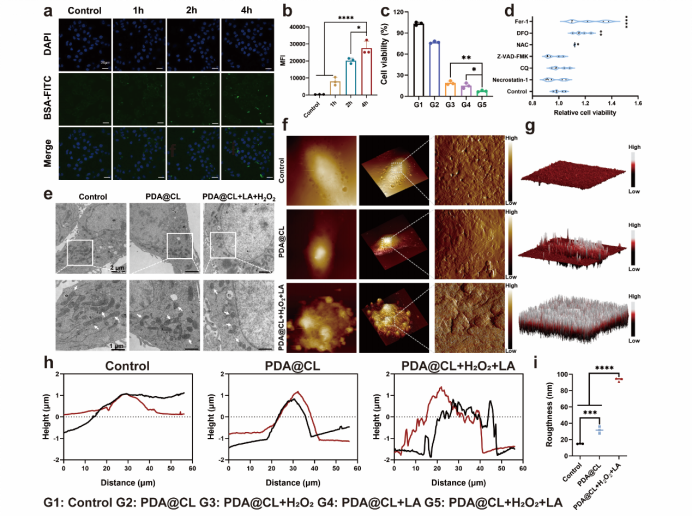
2. PDA@CL在模拟的光热环境中具有高效的细胞杀伤能力,显著降低细胞存活率。细胞死亡通路结果表明纳米点火器的高效杀伤主要来源于铁死亡和氧化应激途径。通过透射电子显微镜和原子力显微镜可以观察到线粒体的皱缩、膜密度增加、嵴的消失、细胞表面出现铁死亡孔等经典的铁死亡标志。
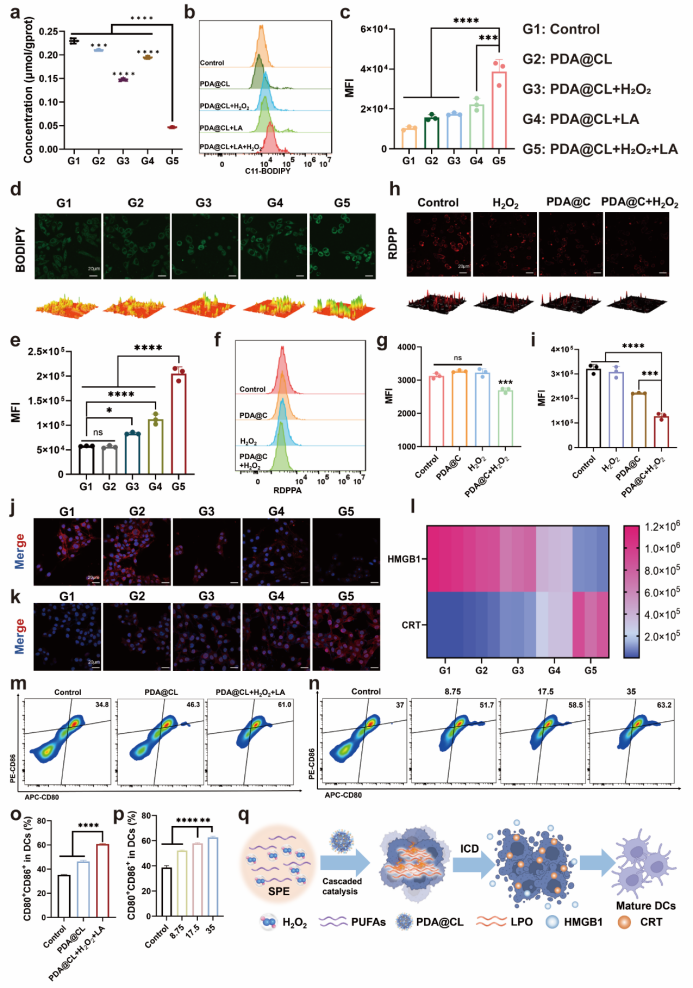
3. PDA@CL在模拟光热环境中通过LOX和CAT级联催化使细胞内的LPO和O2水平显著提高,导致肿瘤细胞的氧化还原系统崩溃,诱导细胞铁死亡的发生。点燃策略诱导铁死亡细胞中高迁移率组蛋白B1(HMGB1)从细胞核中释放,钙网蛋白(CRT)外翻,具有ICD特征。随后,该类细胞与树突状细胞(DCs)共孵育可以显著刺激DCs的成熟,说明PDA@CL纳米点火器具有激活抗肿瘤免疫的能力。
4. 通过多步离心法将纳米点火器载入可溶微针递送系统中。所制备的PDA@CL MNs形貌均一、结构完整,纳米点火器富集在微针针尖。PDA@CL MNs具有良好的机械性能,能有效穿刺大鼠腹部皮肤。通过BSA-Cy5.5代替酶进一步研究PDA@CL MNs的体内分布情况。结果表明,PDA@CL MNs局部给药后释放的纳米点火器能长时间蓄积在小鼠的肿瘤部位中,具有原位滞留能力。此外,PDA@CL MNs能保留纳米点火器的光热转化性能和级联催化能力,可以在显著提高肿瘤中LPO的含量并降低GPX4的表达,诱导铁死亡发生,有效杀伤肿瘤细胞并抑制其增殖。
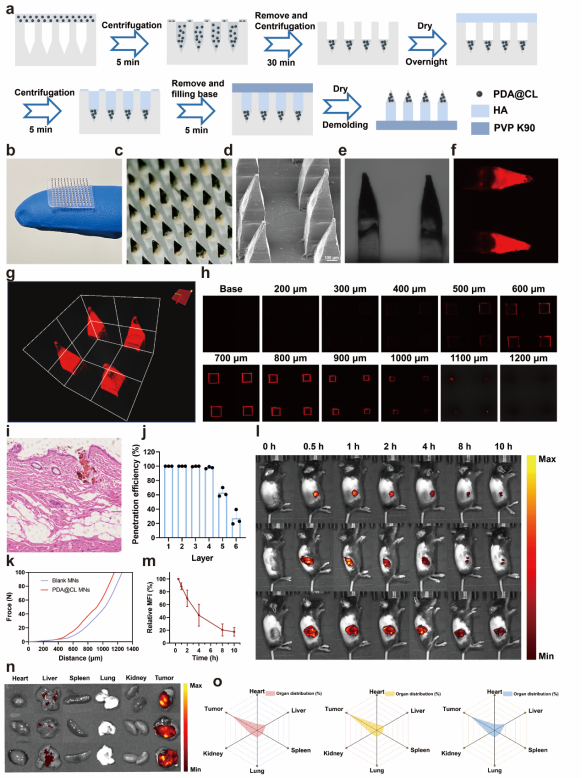
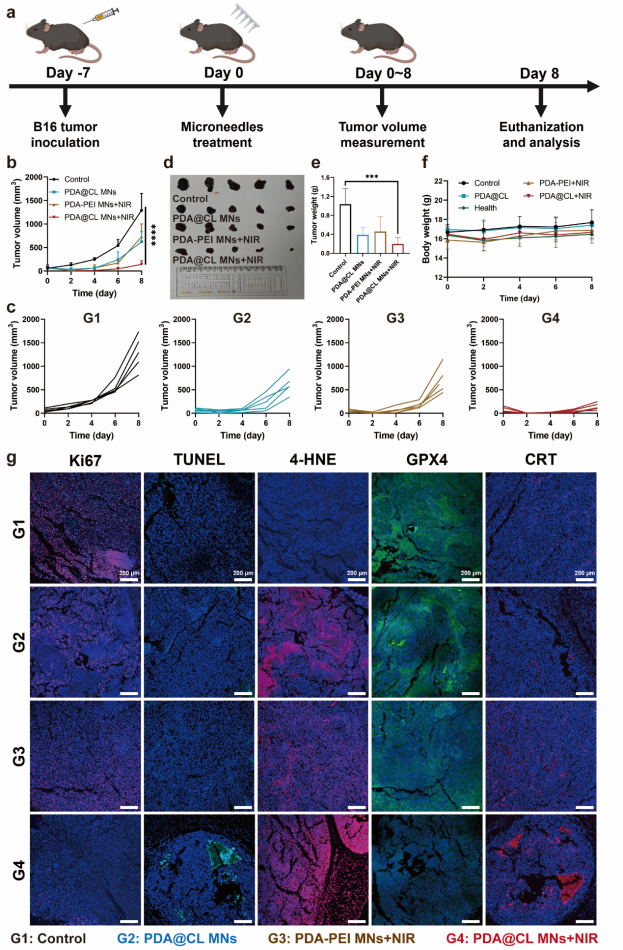
5. 构建黑色素瘤荷瘤小鼠,进一步研究纳米点火器MNs的体内抗肿瘤效果。实验结果表明,在激光照射下PDA@CL MNs展现出最强的抑制肿瘤生长的效果。免疫荧光实验结果显示,纳米点火器是通过提高LPO的水平,诱导铁死亡发生起到杀伤肿瘤作用。此外,注意到纳米点火器治疗下存在CRT的外翻等ICD特征,因此进一步通过流式细胞术分析肿瘤内免疫细胞浸润情况。结果显示,原位TME点燃策略可以有效刺激DCs细胞的成熟和肿瘤相关巨噬细胞(TAM)向M1型极化,并提高总T细胞、CD4+T细胞和CD8+T细胞在肿瘤内浸润比例,说明有效激活了抗肿瘤免疫,进一步增强PTT的抗肿瘤疗效。
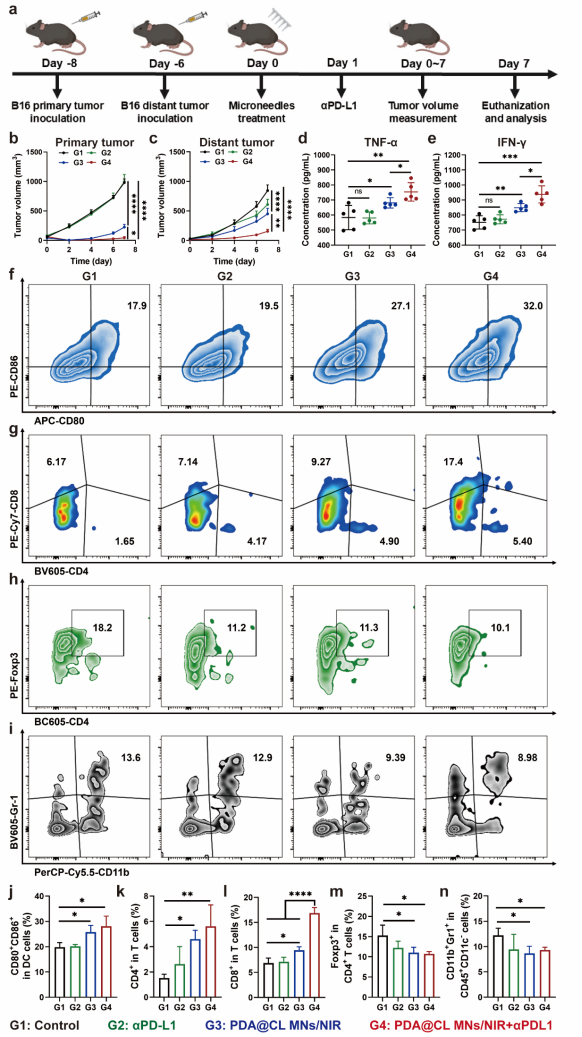
6. 最后,将纳米点火器MNs与临床常用的免疫治疗药物(αPD-L1)联用探究其临床应用价值。实验结果表明,PDA@CL MNs/NIR和αPD-L1联合治疗后,可以显著抑制荷瘤小鼠的原发肿瘤和远端肿瘤的生长,并上调血液中促炎因子的水平。远端肿瘤的流式细胞术分析的结果显示,联合αPD-L1后可以显著刺激DCs细胞的成熟,提高细胞毒性T细胞在肿瘤中的浸润比例,抑制肿瘤中免疫抑制性细胞(Treg和MDSC)的浸润,显著增强纳米点火器的抗肿瘤免疫。
论文第一作者为中山大学药学院硕士研究生彭思远,论文通讯作者中山大学药学院潘昕教授和王文浩博士,以及暨南大学药学院黄郑炜副教授。中山大学为论文第一完成单位,该研究得到国家自然科学基金和广东省自然科学基金的支持。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.5c01744
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)