首页 > 医疗资讯/ 正文
由于生物成像质量差且对标准疗法耐药,癌症治疗通常无效。多重低渗透性生物屏障限制了诊疗药物在肿瘤中的有效性,进一步加剧了这一问题。
2025 年 6 月 10 日,北京中医药大学生命科学学院华茜和武汉科技大学生命科学与健康学院李钰策共同通讯在Advanced Science 在线发表题为“Ultrasound-Induced Nitric Oxide-Propelled Nanomotor for Multimodal Theranostics of Cancer with Deep Penetration and Extended Lifetime”的研究论文,该研究通过一系列工艺制备了一种空心纳米马达PM-HMSN/Arg,包括:静电吸附Mn2+、负载l-Arg和涂覆血小板膜(PM)。
该纳米马达以l-Arg作为NO供体,超声(US)作为NO释放的触发因素。给药后,该马达通过“束缚-松弛-钻入”机制增强肿瘤渗透性,在从血管输送到肿瘤细胞的过程中克服生物屏障。NO调节肿瘤血管内皮细胞的代谢,促进松弛,并通过参与活性氧代谢增强细胞毒性。更重要的是,纳米马达的主动运动增强了组织渗透性和在癌症中的滞留性,从而提高了治疗效果。此外,持续的原位NO生成延长了超声成像信号寿命。这种创新的纳米马达显示出在低穿透性肿瘤的多模式治疗诊断方面的前景。

动态影像引导的癌症精准诊疗在临床应用中前景广阔。纳米材料可以通过主动和被动靶向策略增强肿瘤的蓄积,从而提高成像精度和治疗效果。多种兼具成像造影和治疗功能的多功能纳米材料已在肿瘤诊断和治疗中展现出巨大的潜力。然而,实体肿瘤通常面临组织穿透性差的挑战,纳米粒子往往只能到达肿瘤的周边区域,难以实现对整个肿瘤的精确成像和治疗。这是由多种生物屏障造成的,包括:肿瘤血管屏障,其血液灌注不良且内皮致密,导致大多数药物在肿瘤血管中的外渗率相对较低;间质液压(IFP)屏障过高,这源于丰富的透明质酸(HA)以及促纤维增生基质中大量的凝胶流体相,这构成了肿瘤内扩散和对流的最大障碍,导致药物移动性降低并滞留在肿瘤周边。
大多数用于癌症诊疗的纳米粒子,无论是通过被动还是主动靶向策略诱导,都是通过被动运动(例如在细胞外基质内的自由扩散)实现肿瘤递送。因此,纳米粒子可能被困在肿瘤某些流动性较差的周边区域,例如基底膜。合成的纳米级和微米级马达能够自我推进,由于其能够通过非布朗运动主动运输货物而备受关注。这些纳米马达可以通过外力或内部机制驱动主动运动,显著增强其穿越细胞膜的能力,并促进细胞内货物的递送。此外,纳米马达可以改善其在肿瘤微环境 (TME) 中的运动能力,提高识别和结合肿瘤细胞和组织成分的可能性,从而增强肿瘤选择性。更重要的是,纳米马达产生的巨大推力使其能够克服肿瘤组织内的各种障碍,提高组织穿透能力。这些特性使纳米马达成为肿瘤诊断和治疗的卓越纳米平台。
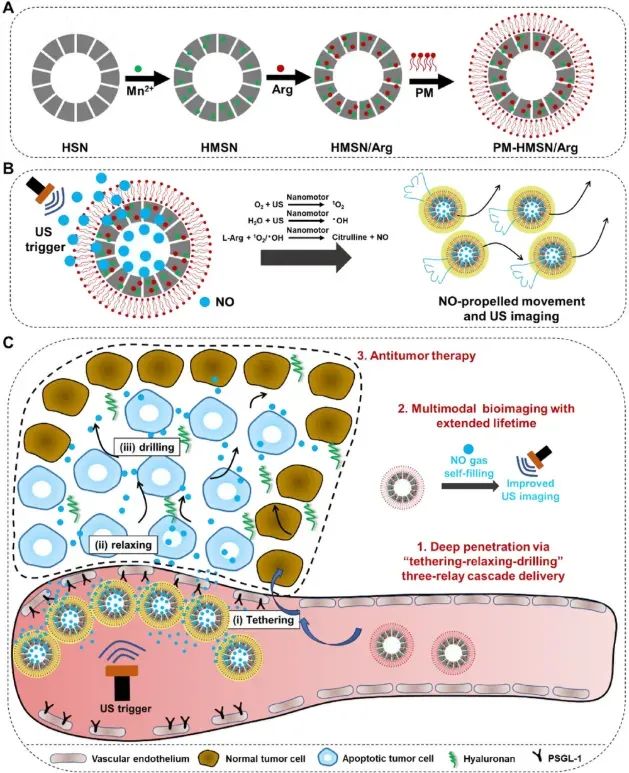
方案 1(图源自Advanced Science )
超声 (US) 成像是一种常用的成像技术,可用于检测或术中评估肿瘤扩散。然而,某些纳米材料介导的超声成像通常效果不佳,因为渗入肿瘤的纳米气泡不稳定,会迅速塌陷并泄漏气体,导致超声诊断过早终止。尽管许多研究致力于通过增加气体含量来克服气体耗尽问题,但这些研究未能克服纳米核心固有的承载能力限制,无法承载足够的气体。因此,延长气体产生的持续时间以延长超声信号的寿命并进而提高成像能力至关重要。
在本研究中,我们开发了一种用于癌症多模态诊疗的纳米马达,它能够提高在肿瘤组织中的穿透性并延长成像寿命。该纳米马达由仿生血小板膜 (PM) 表面和强大的一氧化氮 (NO) 纳米发生器组成,前者能够快速特异性地粘附于肿瘤血管,形成稳定的肿瘤血管滞留,后者能够产生大量的一氧化氮 (NO) 来驱动主动运动。 NO作为肿瘤气体治疗中的明星分子,参与肿瘤组织多种代谢活动,包括但不限于肿瘤血管内皮细胞的舒张、细胞内活性氧(ROS)代谢、DNA损伤、血红素铁核的亚硝化以及参与免疫反应等。NO作为纳米马达的运动能量来源,在超声治疗过程中通过以下机理产生:在超声的机械能作用下,空心硅酸锰纳米粒子(HMSN)诱导电子空穴分离,生成ROS,包括单线态氧(1O2)和羟基自由基(•OH);随后,l-精氨酸(l-Arg)被产生的ROS氧化,生成NO和瓜氨酸。这些NO气泡通过微观相互作用聚集在纳米马达表面,当纳米气泡达到一定阈值时,气泡与纳米马达分离,为纳米马达的运动提供能量。纳米马达的上述结构通过独特的“束缚-松弛-钻孔”三重中继级联传递机制,显著提升了肿瘤穿透能力。即,纳米马达首先利用对PM的亲和力,快速特异性地识别并锚定在肿瘤血管上。随后,超声诱导的NO分子扩散到肿瘤组织中,导致内皮细胞松弛。随后,这些纳米马达通过NO驱动的主动运动,钻入肿瘤深层组织。此外,作为纳米马达的“排气”,NO在超声治疗过程中持续原位生成,由于其气体自填充能力,大大延长了超声成像信号的寿命并增强了信号强度。因此,这种空心纳米马达可以深入肿瘤,并利用NO的自填充能力,智能地实现低穿透性肿瘤的多模态诊疗。
参考消息:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202416709
猜你喜欢
- 同卵双胞胎胚胎发育有遗传差异
- 髋关节疼痛的 7 种疾病和 7 个缓解动作
- 盘点国外十大健身美女 高颜值高收入
- Chest:所有肺动脉高压组当代风险评分的比较:肺血管研究所 GoDeep 元注册分析
- J Gastroenterol:尿二肽酶1和三叶因子1有望成为结直肠癌早期诊断的生物标志物
- 【EClinicalMedicine】伊布替尼+来那度胺+利妥昔单抗治疗R/R DLBCL的2期研究
- N Engl J Med:“三亲婴儿”的诞生:一次细胞级别的“偷天换日”
- 拍打人体排污口祛湿排毒纯属炒作,怎么祛湿排毒才有效
- BMJ Open Diabetes Res Care.:血糖管理技术的使用率在不同种族和社会经济背景的1型糖尿病青少年中存在差异
- 美国新冠肺炎超556万例 秋冬季流感会抑制新冠病毒传播吗
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)