首页 > 医疗资讯/ 正文
冠状动脉心脏病(冠心病, CAD)是多因素慢性疾病,位列全球疾病负担的首位,主要由于冠状动脉粥样硬化导致。由于冠脉粥样硬化斑块不稳定所致的心肌梗死(MI)是冠心病的急性表征。高血脂、高血压是冠心病的主要风险因素,然而,人们对于二者如何影响冠状动脉粥样硬化知之甚少。这主要受制于领域内长期的技术瓶颈—目前广泛应用的单纯高血脂诱导的小鼠模型(如ApoE-/-和LdlR-/-)的动脉粥样硬化斑块主要发生部位不在冠状动脉(发生在主动脉),也没有自发斑块破裂和血栓形成,无冠心病和心梗表型。另一方面,目前MI动物模型是通过人为手术阻断冠脉血流,这无法反映人冠心病由于冠脉斑块形成导致心梗的自然病理过程。缺乏模拟人冠心病的动物模型相当程度制约了冠心病机制研究、以及药物发现与临床转化。
2025年6月9日,中国医学科学院阜外医院王淼教授团队在Circulation Research期刊在线发表题为“Novel Mouse Model of Coronary Atherosclerosis With Myocardial Infarction: Insights Into Human CAD”的研究论文。该论文报道了一种新型冠状动脉粥样硬化小鼠模型,该模型具有人冠心病典型特征和自发心梗,并揭示高血脂、高血压双重风险因素对于冠脉血管损伤的强烈协同效应,进一步证明了人冠脉血管存在类似易损特点,提示抗炎干预对于冠心病精准防治的重要性。

基于人冠心病遗传相关基因研究,研究人员首先构建了一种新型冠心病小鼠遗传突变模型(ApoESA/SA),实现可诱导高血脂和高血压(图1)。该模型在失活ApoE基因(相当于ApoE-/-)的同时,利用内源的ApoE基因启动子特异性敲低高密度脂蛋白受体基因Scarb1的功能,并引入多西环素诱导系统实现血管紧张素II (Ang II)的过表达。在此创新设计基础上,团队进一步研究了高血脂、高血压的冠脉血管损伤作用。
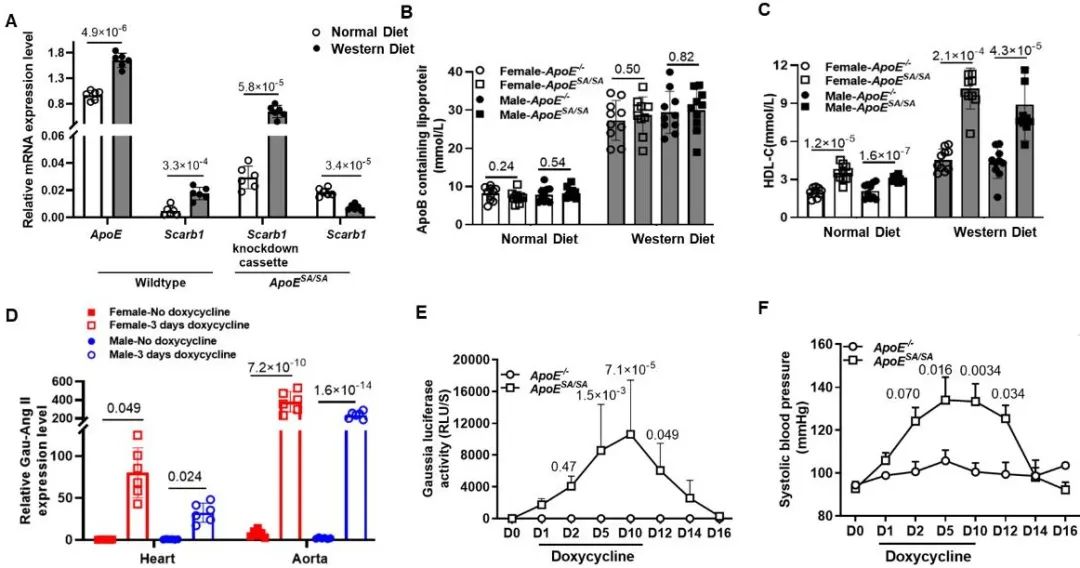
图1. 高脂饮食和多西环素饮水诱导ApoESA/SA小鼠发生高血脂与高血压表型
与传统的ApoE-/-小鼠相比,ApoESA/SA小鼠经16周高脂饮食喂养,发生轻度冠状动脉粥样硬化病变,并伴有心功能减低。联合高血脂和高血压,显著加速、加重冠状动脉粥样硬化病变,4周就出现明显的冠脉斑块,表现出内皮侵蚀、炎症细胞浸润、薄纤维帽、斑块破裂、斑块内血栓等不稳定斑块病理特征,并发生自发心梗和心衰(图2)。单纯高血脂或高血压不足以诱发如此严重的冠脉粥样硬化。与冠脉不同,股动脉血管未见明显的动脉粥样硬化斑块,显示不同血管床的易损性差异。
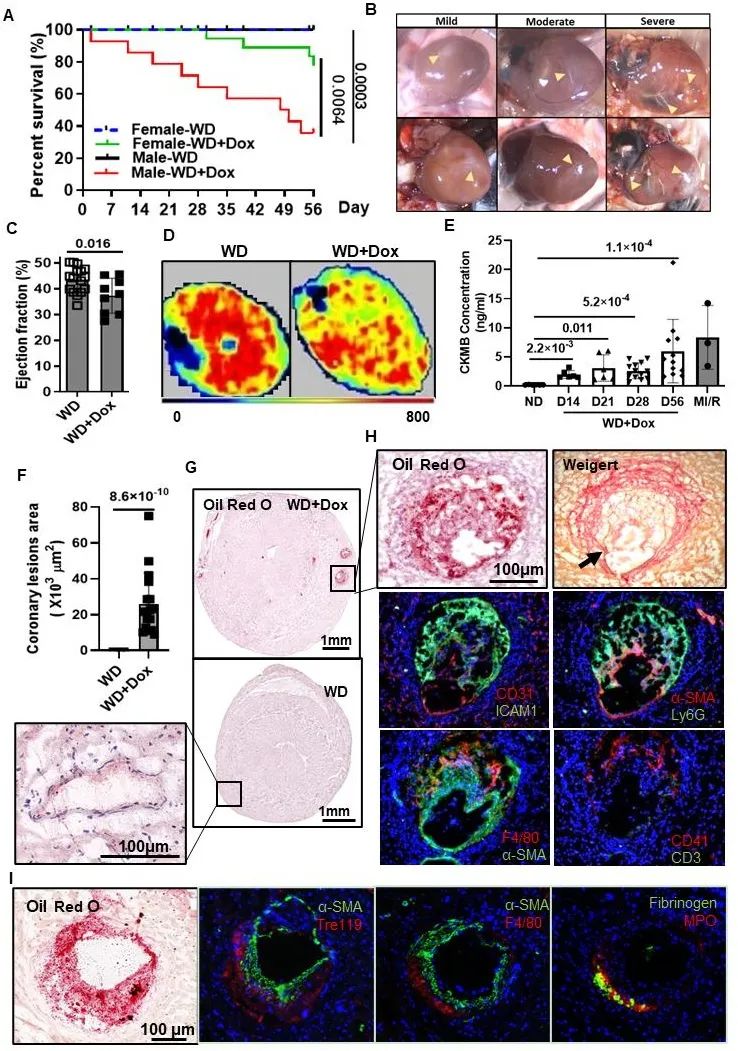 图2. 高血脂高血压ApoESA/SA小鼠发生明显的冠状动脉粥样硬化(不稳定斑块、斑块破裂)、自发心梗和心衰,并伴随冠脉微循环障碍
图2. 高血脂高血压ApoESA/SA小鼠发生明显的冠状动脉粥样硬化(不稳定斑块、斑块破裂)、自发心梗和心衰,并伴随冠脉微循环障碍
蛋白质组学分析结果显示,冠状动脉与股动脉在血管舒缩和炎症反应方面存在显著差异(图3)。与股动脉相比,冠状动脉在高血脂和高血压双重作用下,其内皮依赖性舒张功能受损尤其严重,这种内皮易损性也得到了人冠脉血管样本的验证。冠脉血管特殊的病理生理与其动脉粥样硬化敏感性密切相关。
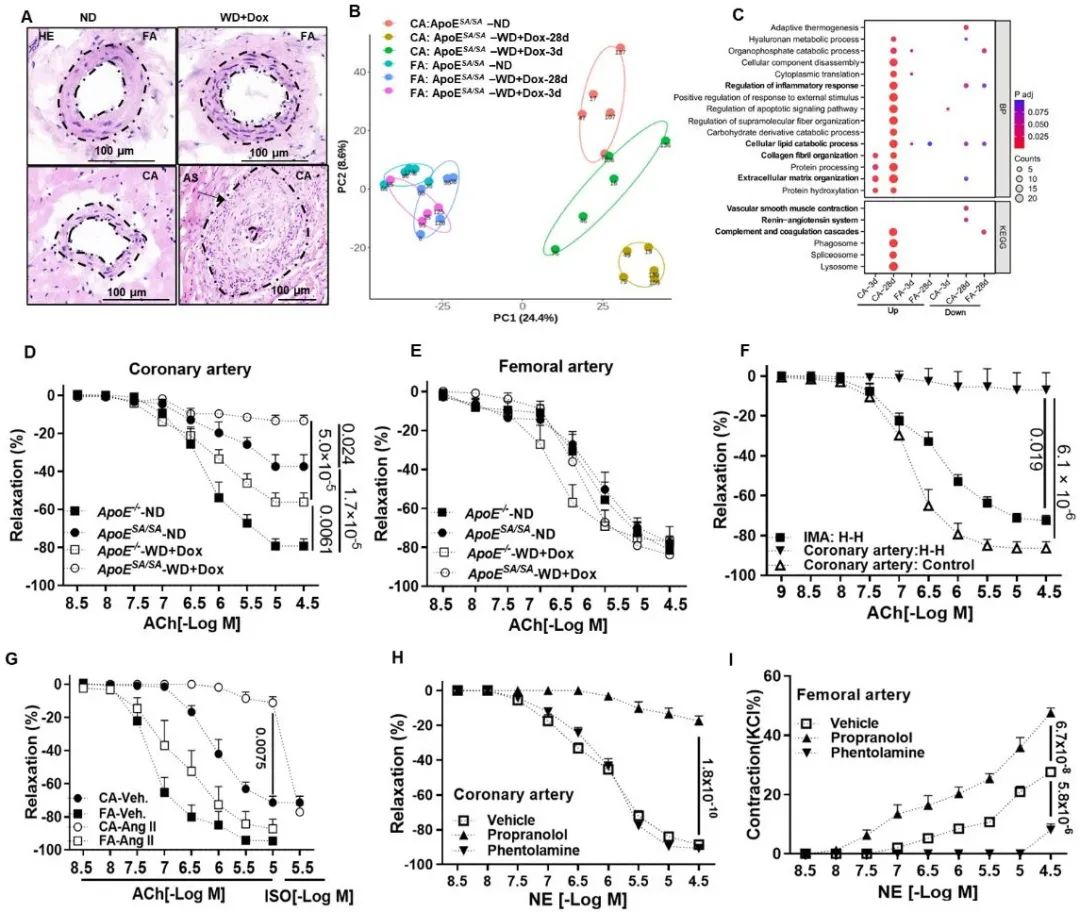
图3. 冠脉血管的动脉粥样硬化易损性及其特殊的病理生理特性
机制上,Ang II导致冠脉内皮依赖性舒张功能明显受损,这依赖于AT1受体。另一方面,前列腺素在冠状动脉血管功能中发挥关键作用。合并高血脂和高血压会显著升高系统性炎症水平,抑制心脏合成前列腺素(PGE2和 PGI2),而使用免疫炎症调节剂甲氨蝶呤(MTX)可抑制系统性炎症,通过前列腺素显著改善冠脉内皮依赖性舒张,降低心血管疾病导致死亡的风险(图4)。
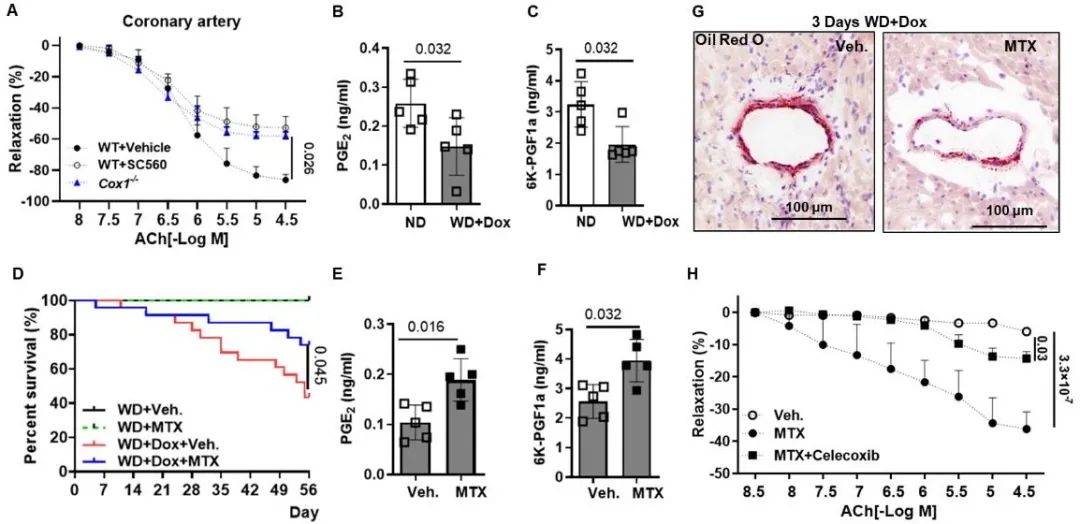
图4. 前列腺素调控冠脉血管功能的关键作用,免疫炎症调节剂改善心血管疾病预后
综上所述,该研究发现高血脂与Ang II介导的高血压对冠状动脉粥样硬化有强烈协同促进效应,这归因于Ang II暴露、前列腺素合成抑制对冠状动脉内皮依赖性舒张功能的损伤及炎症反应(图5)。
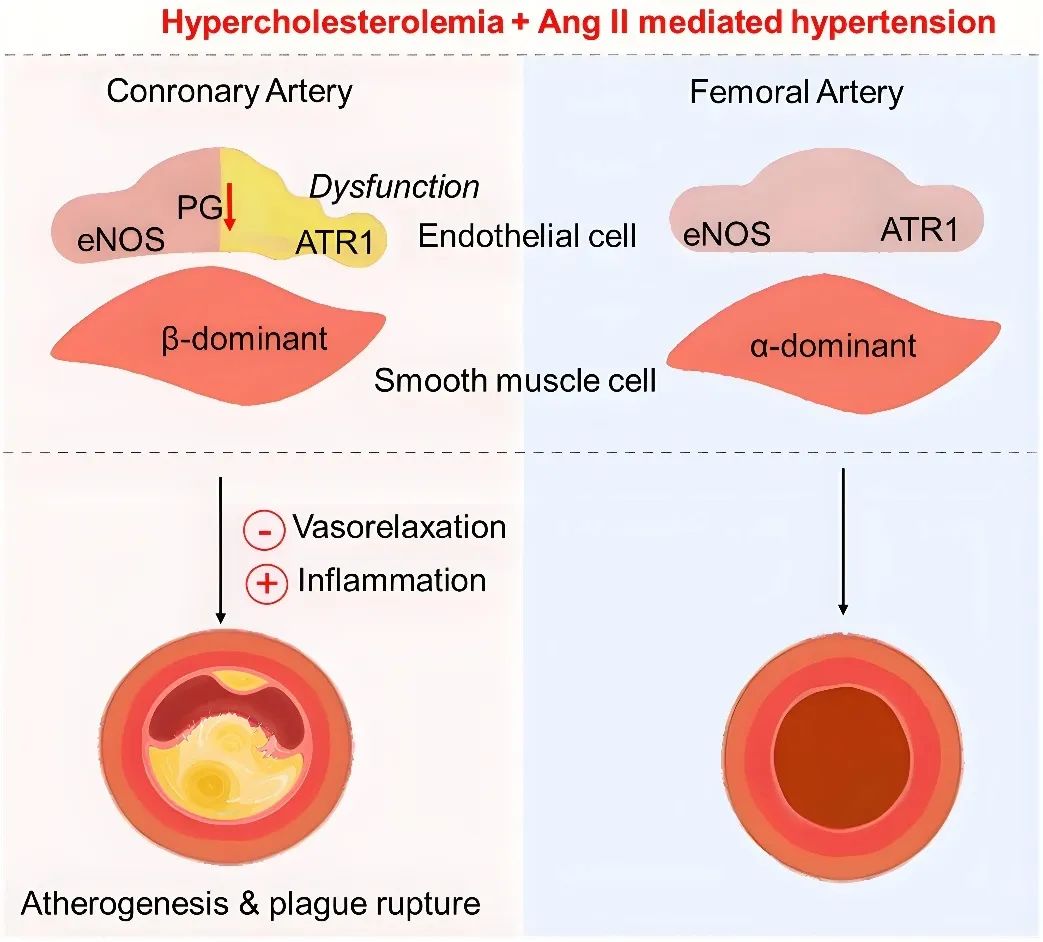
图5. 高血脂与Ang II介导的高血压协同促进冠状动脉发生动脉粥样硬化和斑块破裂
这项研究为防治冠状动脉粥样硬化/冠心病提供了重要启示。要特别重视合并高血脂和高血压的人群、以及治疗不达标/治疗失败的患者管理,及时应用各种降胆固醇药、降压药尽快治疗达标;对于无法达标的,特别是炎症水平高的患者,考虑应用免疫炎症抑制药。
该研究为冠心病机制与药物发现研究提供了突破性动物模型。相对于迄今为止所有动脉粥样硬化硬化小鼠模型而言,ApoESA/SA小鼠表现出人冠心病的典型特征。具有如下突出优势:1) 可诱导高血脂、高血压;2) 发生明显的冠状动脉粥样硬化,形成不稳定斑块;3) 自发心梗;4) 发生心衰;5) 雄性易感;6) 发育和生育正常,适用于长期慢性风险因素与药物干预评价;7) 所有遗传突变均在同一个遗传位点引入,方便扩繁或者与其它突变小鼠杂交。
该研究得到国家科技重大专项、国家重点研发计划及政府间国际合作重点专项、国家自然科学基金重点项目、中国医学科学院医学与健康科技创新工程等基金支持,依托中国医学科学院阜外医院、国家心血管病中心、心血管疾病全国重点实验室完成。
中国医学科学院阜外医院陈虹博士、万青博士、杨建峰和饶昊杰为该论文的共同第一作者,王淼教授为通讯作者。该研究得到了香港城市大学黄聿教授、宾夕法尼亚大学Garret FitzGerald教授、肯塔基大学Alan Daugherty和Hong S Lu教授、纽约州立大学Weijun Jin等教授的大力支持。
王淼课题组致力于冠心病、心衰的机制转化研究与新药发现。
来源:
Novel Mouse Model of Coronary Atherosclerosis With Myocardial Infarction: Insights Into Human CAD. Chen H, Wan Q, Yang J, Rao H, Xu C, Xu P, Yang X, Wang H, Feng W, Wang L, Bäck M, Widdop RE, Liu F, Lu HS, Daugherty A, Hu S, FitzGerald GA, Liu DP, Huang Y, Jin W, Wang M. Circ Res. 2025 Jun 9. doi: 10.1161/CIRCRESAHA.125.326409. Online ahead of print.
论文链接:
https://www.ahajournals.org/doi/10.1161/CIRCRESAHA.125.326409
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)