首页 > 医疗资讯/ 正文
肿瘤内异质性引起的代谢异质性介导了肿瘤治疗的大量不良后果,包括化疗耐药性,但其机制在很大程度上仍然未知。
2025年5月30日,厦门大学医学院附属中山医院洪雪辉、中国医科大学王振宁、宋永喜、厦门大学药学院李福男共同通讯在Nature Communications上在线发表题为“Cleavage of CAD by caspase-3 determines the cancer cell fate during chemotherapy”的研究论文。研究发现从头嘧啶合成途径决定了化疗敏感性。化疗药物促进胞质氨基甲酰磷酸合成酶II、天冬氨酸转氨甲酰酶和二氢羟化酶(CAD)的降解,CAD是一种限制嘧啶合成的酶,导致细胞凋亡。
研究还发现,CAD在降解之前需要被caspase-3在其Asp1371残基上裂解。在异种移植和Cldn18-ATK胃癌模型中,过表达CAD或突变Asp1371以阻断caspase-3的裂解可导致化疗耐药。重要的是,在新辅助化疗失败的肿瘤样本中发现了与CAD-Asp1371相关的突变,使用RMY-186药物靶向CAD-Asp1371突变可改善化疗疗效。研究工作揭示了在化疗过程中从头合成嘧啶的脆弱性,突显了CAD作为一个有前景的治疗靶点和生物标志物。

胃癌(GC)和结直肠癌(CRC)是发生在消化系统中的两种主要恶性肿瘤。随着发病率的增加,这些癌症具有高度侵袭性、高转移率和不良预后。不幸的是,GC和CRC由于有效靶点有限难以治疗,只有少数患者受益于免疫治疗和靶向治疗,这两种治疗都有不同的临床效果。这使得化疗成为主要的治疗选择。然而,GC和CRC化疗通常会导致化疗耐药,这在很大程度上降低了患者的长期临床益处。GC和CRC的死亡率一直很高。因此,了解赋予GC和CRC对化疗药物耐药的机制以降低化疗耐药的发生率至关重要。
最近的研究表明,GC和CRC的高内在异质性,特别是内部代谢重编程的失调,可能赋予它们对化疗药物的耐药性。虽然仍处于初步阶段,但研究表明嘌呤和嘧啶核苷酸的合成可能在导致耐药性的失调代谢途径中发挥作用。临床证据表明,在对术前新辅助放化疗(nCRT)表现出异质反应的局部晚期直肠癌(LARC)患者中,肿瘤组织中负责核苷酸合成的酶水平、血液中核苷酸生物合成相关代谢物的浓度和化疗耐药程度呈正相关。此外,已观察到补充核苷可保护培养的LARC细胞免受化疗药物5-氟尿嘧啶(5-FU)的影响。
核苷酸合成的上调对GC和CRC细胞的存活也至关重要,这是化疗预后不良的主要原因之一。例如,在高转移性结直肠癌(mCRC)组织中,已发现嘧啶生物合成中的各种中间代谢物显著上调,这可以通过在这些肿瘤组织中观察到的营养剥夺微环境中作为糖酵解途径的替代燃料来支持mCRC细胞的存活。这种机制也可能在CRC细胞转移期间的存活中发挥作用,因为磷酸烯醇式丙酮酸羧激酶1(PCK1)驱动的嘧啶生物合成在mCRC肝脏定植模型中显著上调,使用患者来源的转移瘤异种移植。来氟米特通过抑制二氢乳清酸脱氢酶(DHODH)来抑制嘧啶的生物合成,在很大程度上阻断了mCRC14的肝转移。
核苷酸合成的促进也有助于GC和CRC细胞的增殖。之前发现GC细胞表达高水平的U2AF同源基序激酶1(UHMK1),该激酶在Ser1062和Thr1067位点磷酸化核受体共激活因子(NCOA3)。磷酸化的NCOA3与转录因子相互作用,激活转录因子4(ATF4),促进ATF4的核转位和转录活性。这导致从头嘌呤代谢相关靶基因的上调,最终促进GC的发生和进展。有趣的是,NCOA3-ATF4对在肝细胞癌(HCC)中也是增加嘌呤从头合成所必需的,其负调节因子,磷酸化NCOA3并阻断ATF4核转位的双特异性酪氨酸磷酸化调节激酶3(DYRK3)显著下调。至少在HCC中,核苷酸合成的这种上调已被证明与HCC细胞的5-FU耐药性有关。
在这里,研究者确定多功能酶CAD充当从头嘧啶合成的限速酶,当caspase-3被化疗药物激活时,CAD是caspase-3的底物。caspase-3介导的CAD切割和降解是GC和CRC化疗药物诱导的癌细胞死亡的必要步骤。CAD或其突变的过表达及其切割位点1371天冬氨酸(Asp1371或D1371)突变,使其不能被caspase-3裂解,从而增强化疗耐药性。此外,研究发现药理学诱导切割抗性CAD的降解可以增加GC和CRC对临床相关化疗药物的敏感性。因此,CAD是化疗诱导的细胞死亡的关键抑制因子,也是治疗耐药性的有前途的分子靶点。
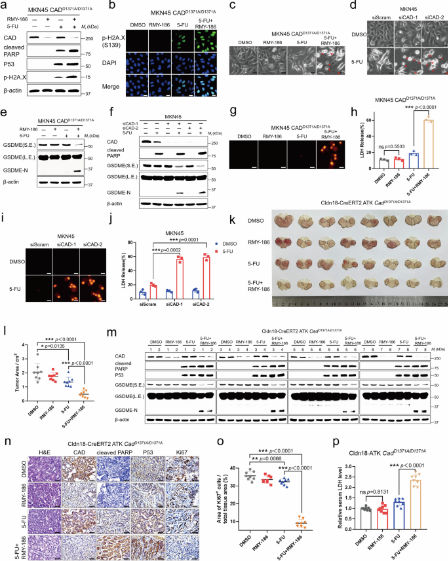
图1RMY-186作为克服化疗耐药性的有前途的疗法(摘自Nature Communications)
参考消息:
https://doi.org/10.1038/s41467-025-60144-2
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)