首页 > 医疗资讯/ 正文
本研究评估根治性膀胱切除术(RC)前未检测到肿瘤知情(tumour-informed)循环肿瘤DNA (ctDNA)的患者的无复发生存期(RFS),并评估那些在RC后ctDNA状态从可检测到转为未检测到的患者是否与持续未检测到ctDNA状态的患者具有相似的RFS结局。2021-2023年期间,对接受RC的患者进行前瞻性和纵向收集tumour-informed ctDNA分析。ctDNA状态由RC前的标本确定。最小残留疾病(MRD)窗口定义为RC后的最初90天。使用Kaplan-Meier方法评估RFS。进行Cox回归分析以寻找疾病复发的预测因子。
该队列包括135例患者,进行了647次ctDNA分析。中位年龄(四分位距[IQR])为71(63-77)岁。在中位(IQR)随访11(7-18)个月期间,41例患者(30%)出现复发。54例患者(40%)存在RC前ctDNA未检测到的状态。6个月、12个月和21个月的RFS率分别为98%、93%和82%。在可进行转换动态分析的MRD窗口中ctDNA状态未检测到的77例患者中,43例具有持续未检测到的ctDNA状态(RC前和MRD窗口均未检测到),31例从RC前可检测到ctDNA状态转为MRD窗口未检测到状态(转换组)。持续未检测到组的RFS显著优于转换组(对数秩检验,P < 0.001),12个月RFS率分别为97%和51%,18个月RFS率分别为88%和51%。在Cox多变量分析中,仅转换组状态可预测疾病复发。
RC前ctDNA未检测到状态的患者预后良好,可能成为降阶梯治疗的候选者。与转换组相比,持续未检测到ctDNA的患者具有更好的RFS。RC前ctDNA状态应纳入检验ctDNA在临床决策中应用的试验中。
研究背景
肌肉浸润性膀胱癌患者的当前治疗方案建议进行新辅助治疗,随后进行根治性膀胱切除术(RC)。对于根治性膀胱切除术时具有特定高危特征的患者,例如≥ypT2(如果先前已进行新辅助治疗)、≥pT3和/或淋巴结受累,建议进行辅助治疗。因此,当前的临床决策主要由病理分期驱动。IMvigor010试验(NCT02450331)探讨了阿替利珠单抗(程序性死亡配体1检查点抑制剂)与单纯观察在RC后辅助治疗中的作用。尽管与单纯观察相比,阿替利珠单抗在无病生存期(DFS)或总生存期(OS)方面未显示出优越性,但在事后分析中,根据RC后MRD窗口期间ctDNA阴性/阳性状态对每个治疗组的患者进行分层后显示,ctDNA状态阳性的患者与单纯观察相比,加用阿替利珠单抗可获得DFS和OS获益。相比之下,ctDNA状态阴性的患者中,各治疗组之间未发现DFS差异。这些发现说明了ctDNA状态在优化辅助治疗患者选择中的潜在用途。然而,基于经尿道膀胱肿瘤切除术(TURBT)标本的RC前ctDNA状态的预后效用尚未得到研究,RC后从术前阳性状态转为MRD窗口阴性状态的患者的预后也未得到研究。在研究者之前的出版物中,证明了基于TURBT标本的RC前ctDNA状态可预测病理结果、淋巴结受累和RFS。鉴于研究者之前的研究和IMvigor010试验的结果,无法检测到的ctDNA状态可能界定了一群可从降阶梯治疗中获益的患者。
本研究旨在评估ctDNA状态无法检测到的患者的生存预后(采用延长的随访期),并分析RC后从可检测到ctDNA状态转为无法检测到状态的患者与在RC前和MRD窗口均持续无法检测到ctDNA状态的患者是否具有相似的RFS预后。
研究方法
在该机构接受RC的患者术前均进行 Signatera™(Natera Inc., Austin, TX, USA)ctDNA检测并实时分析。简而言之,Signatera™ ctDNA检测是一种基于tumour-informed的定制化多重PCR - 下一代测序检测方法,通过对原发肿瘤和匹配的正常全血样本进行全外显子测序来识别克隆变异。为每位患者生成包含 16 个肿瘤特异性克隆体细胞变异的定制化检测,从而形成该患者的个性化 “肿瘤特征”。该机构对计划接受RC或正在接受新辅助治疗的膀胱癌患者常规收集ctDNA分析样本。RC前的 TURBT 标本用于评估术前 ctDNA 状态,并在患者的整个监测过程中使用(除外 1 例严重尿道狭窄未行 TURBT、临床推测为≥cT2 并直接接受 RC 的患者)。RC 后每 6-12 周采集系列 ctDNA 样本。tumour-informed术前ctDNA 状态参考RC当天或1个月内采集的血清分析结果。术后纵向采集ctDNA血样,包括:MRD窗口,即RC后最初90天内;监测窗口,即最初90天后。患者根据不同时间点的ctDNA未检测到/可检测到状态进行分类。ctDNA状态转换动态分析分为两组:持续未检测到组和转换组。持续未检测到组是指RC前窗口ctDNA未检测到且MRD窗口仍未检测到的患者。转换组是指RC后从RC前可检测到ctDNA状态转为MRD窗口未检测到状态(血清ctDNA清除)的患者。
研究结果
基线特征与ctDNA未检测到队列的描述:
该队列包括135例患者,中位年龄(IQR)为71(63-77)岁;男性109例(80.7%),女性26例(19.3%)。总体中位(IQR)随访时间为11(7-18)个月,在此期间41例患者(30.3%)出现远处疾病复发(表1)。共有54例患者(40%)RC前ctDNA状态未检测到。最终病理显示,24.1%为pT0期,63%为<pT2期,88.9%为pN0期;RC前ctDNA未检测到队列的中位(IQR)随访时间为13(8-19)个月(表2)。生存分析显示,RC前ctDNA未检测到患者的6个月、12个月、18个月和21个月RFS率分别为98%、93%、82%和82%(图1)。其中,6例患者(11.1%)出现疾病复发:2例在MRD窗口转为ctDNA可检测状态(均复发),另外7例在监测期出现ctDNA阳性信号(其中4例发生远处转移,3例无复发证据且仍在监测中)。值得注意的是,9例ctDNA复发患者中有2例为卡介苗(BCG)无反应性疾病,最终病理均为<pT2和pN0期。

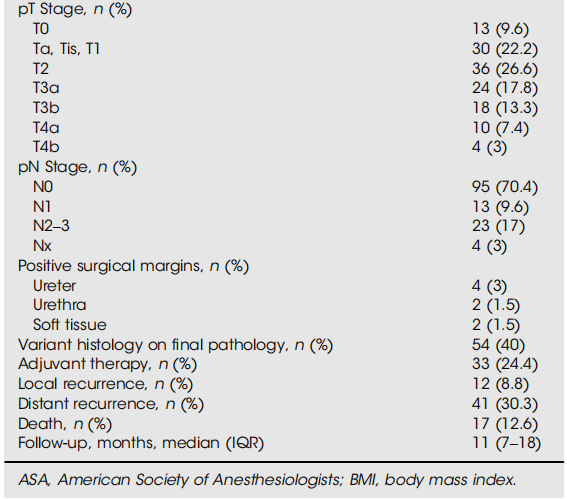
表1

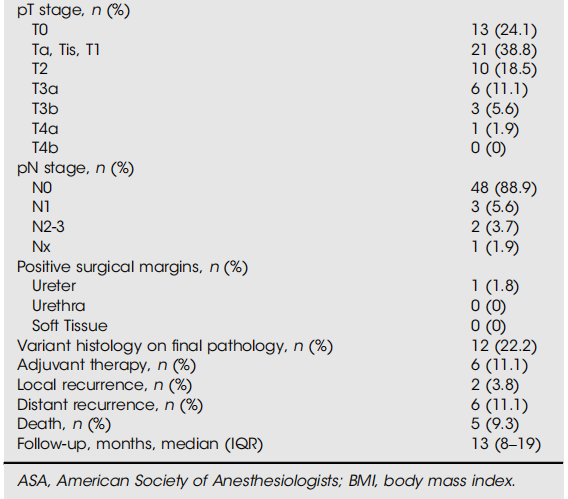
表2
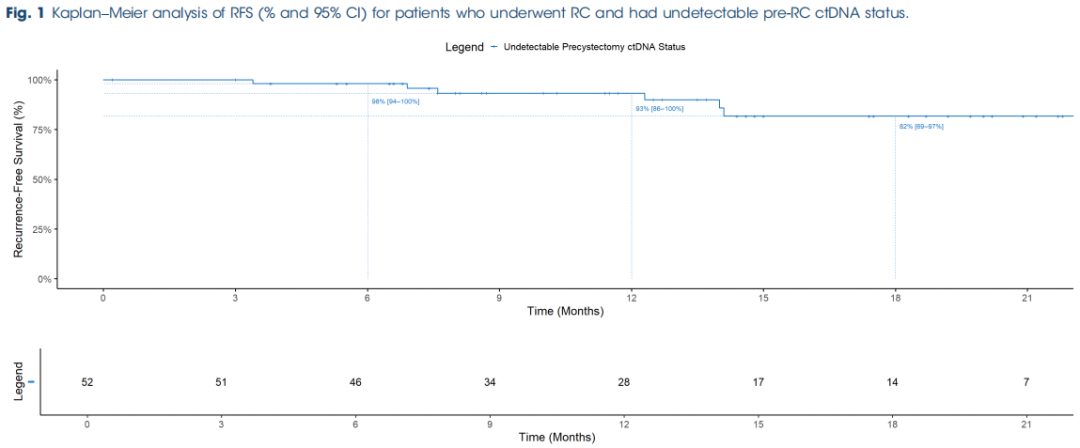
图1
ctDNA转换动态、生存分析与多变量分析:
共有74例患者在MRD窗口ctDNA状态未检测到且随访时间>3个月,可进行转换分析:持续未检测到组43例,转换组31例。两组的术前基线特征(包括RC前临床分期、TURBT变异组织学比例、新辅助治疗率)具有可比性(表3)。与持续未检测到组相比,转换组患者的最终病理pT分期更高或疾病升级更为常见(69.6% vs 31.1%,P=0.001),远处复发率更高(35.5% vs 6.8%,P=0.002)。转换组的中位进展时间较短(8个月 vs 持续未检测到组12个月),但未达统计学显著差异。生存分析显示,持续未检测到组的RFS显著优于转换组(对数秩检验,P<0.001),6个月、12个月、18个月RFS率分别为100% vs 82%、97% vs 51%、88% vs 51%(图2)。Cox多变量分析显示,在纳入重要最终病理变量(≥pT3/pN+和变异组织学)后,仅转换组状态可预测疾病复发(HR=5.79,95% CI 1.55–21.7;P=0.009);而在另一项针对全身治疗(新辅助 / 辅助治疗)进行校正的独立分析中,结果亦然(HR=8.2,95% CI 2.22–30.3;P=0.002)。

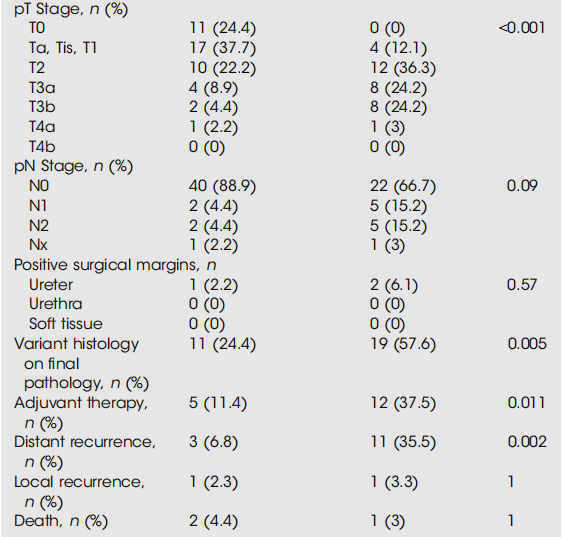

表3
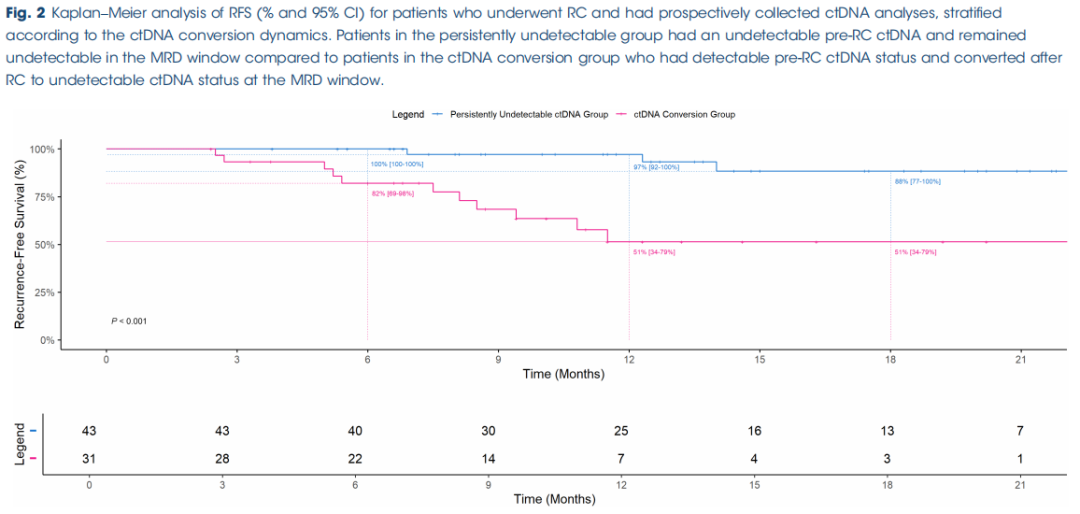
图2
讨 论
目前高危尿路上皮癌患者的治疗决策方案完全由病理分期驱动。tumour-informed ctDNA的应用已成为一种有前景的新型生物标志物,其可将患者分层至不同的进展和复发风险组,有可能减少治疗负荷和经济毒性。本研究证明了在RC前获取ctDNA的实用性。研究者发现,术前ctDNA状态未检测到的患者具有良好的疾病预后,在中位(IQR)随访13(8-19)个月时,其12个月和18个月的RFS分别为93%和82%。在该队列中,18.5%的患者最终病理为pT2期疾病,另有18.5%的患者为≥pT3a期疾病,9.3%的患者最终病理显示淋巴结阳性。值得注意的是,9例患者出现可检测到的ctDNA状态复发,其中2例在MRD窗口内,7例在监测窗口期间。有趣的是,44%的患者接受了新辅助治疗,且在最终病理中,44%的患者为≥pT3a期,44%的患者为变异组织学。在9例患者中,6例经影像学证实复发,3例患者目前正在接受监测,影像学检查未发现可测量疾病的证据。在根据从术前到MRD窗口ctDNA状态转换来检查预后的亚组分析中,转换组患者在最终病理上更常见更高的pT分期、疾病升级、变异组织学,以及更高频率的远处转移性复发。在生存分析中,与持续ctDNA未检测到组相比,转换组患者的RFS预后更差(对数秩检验,P < 0.001,图2),其12个月和18个月的RFS率分别为97% vs 51%和88% vs 51%。最后,在Cox多变量分析中,当针对全身新辅助或辅助治疗进行校正时,ctDNA转换状态可预测疾病复发(HR 8.2,95%CI 2.22-30.3;P = 0.002),而在另一项针对Cox单变量分析中发现具有统计学意义的预测因子(变异组织学、≥pT3或最终病理pN+疾病)进行校正的独立分析中,结果亦然(HR 5.79,95% CI 1.55-21.7;P = 0.009)。
Powles等人在IMvigor010试验及随后关于延长随访和OS结果的出版物中,探讨了阿替利珠单抗在RC后辅助治疗中的作用。该研究的设计具有创新性,因为它在两个治疗组中均纳入了MRD窗口的ctDNA分析。总体而言,阿替利珠单抗在辅助治疗中未能证明优于单纯观察。然而,在事后分析中,对治疗组进行分析时发现,MRD窗口ctDNA状态阳性的患者接受阿替利珠单抗治疗相比单纯观察组具有DFS和OS获益(OS,HR 0.59,95% CI 0.42-0.83)。相比之下,当分析ctDNA状态阴性的患者时,两个治疗组的DFS和OS结果相似。尽管IMvigor010试验未使用ctDNA来指导临床决策,但它为研究ctDNA状态在指导治疗决策中的作用的新试验铺平了道路。这些试验包括正在进行的IMvigor011试验(NCT04660344)和MODERN试验(NCT05987241)。值得注意的是,MODERN试验探讨了RC后ctDNA状态在辅助治疗中指导患者选择不同治疗组的作用。该研究根据RC后MRD窗口ctDNA状态将患者分层至四个不同的治疗组:对于ctDNA MRD阴性状态,为单纯观察 vs 纳武利尤单抗;对于MRD窗口ctDNA阳性状态,为纳武利尤单抗 vs 纳武利尤单抗联合瑞拉利单抗(relatlimab)。特别令人关注的是ctDNA阴性组,这可能减少患者的过度治疗。
IMvigor011试验和MODERN试验在ctDNA状态用于确定辅助治疗的潜在应用方面均前景广阔。然而,两者都仅使用RC后(即MRD窗口)的ctDNA状态来将患者选择至不同的治疗组。根据研究者目前的研究结果,术前ctDNA状态似乎仍然是RFS预后的重要决定因素,仅使用MRD窗口状态可能不够。尽管转换组和持续ctDNA未检测到组在MRD窗口均为ctDNA未检测到/阴性状态,但转换组患者的RFS预后更差,并且在针对重要变量进行校正后,相对于持续ctDNA未检测到状态,ctDNA转换可预测疾病复发。因此,当前MODERN试验和IMvigor011试验的设计会导致将持续未检测到组和转换组合并为一个组,即MRD阴性组,因为未参考术前ctDNA状态。如果本研究结果得到进一步验证,上述试验的当前设计可能导致转换组的治疗不足。因此,研究者认为术前ctDNA状态的信息至关重要。此外,在持续未检测到的患者中,有3例确实发生了复发。虽然ctDNA状态通常在检测到疾病复发之前转为可检测状态,但似乎有一小部分患者可能被当前Signatera™检测的预后能力遗漏,这些患者更常接受新辅助治疗,并且在最终病理上具有变异组织学。
本研究存在一些固有局限性。首先,尽管这是就该主题报告的相对较大的队列,但当前的队列规模和回顾性性质限制了本研究结果的统计效力,此外,新辅助或辅助治疗的治疗决策并非根据ctDNA状态,而是根据当前指南。其次,不同ctDNA检测的灵敏度不同;研究者使用了先前已验证的Signatera™检测。其他灵敏的检测可能会检测到更多血清中可检测到ctDNA的患者,从而提高生存预后的预测率。然而,这可能以特异性为代价。此外,由RC标本提供的肿瘤特征是否与由TURBT标本提供的肿瘤特征表现相似仍有待确定,因为所选择的特征将在患者的整个监测期间使用。此外,由于膀胱癌是一种异质性疾病,在最终标本中对一个区域进行采样可能无法代表驱动更具侵袭性生物学行为的标本部分。因此,尽管当前ctDNA的预后性能较高,但在决定对原发肿瘤的哪些区域进行采样方面的进一步标准化可以提高检测的预后能力,有助于降低检测的假阴性率。
PC前ctDNA状态未检测到与良好的肿瘤预后相关,其可能有助于降低高危膀胱癌患者的治疗方案强度。仅依赖MRD窗口未检测到状态可能导致治疗不足,应通过术前ctDNA状态来补充评估转换状态。这在优化患者选择不同辅助治疗组的临床决策中可能至关重要。未来的研究应考虑同时纳入术前和MRD窗口的ctDNA状态,以实现对新辅助治疗、辅助治疗和单纯RC治疗的最佳患者选择。
参考文献:
Ben-David R, Lidagoster S, Geduldig J, et al. Undetectable pre-radical cystectomy circulating tumour DNA status predicts improved oncological outcomes. BJU Int. 2025;135(3):473-480. doi:10.1111/bju.16556

- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)