首页 > 医疗资讯/ 正文
摘 要 实时功能磁共振成像神经反馈是一种无创神经调控技术,通过实时监测和反馈大脑活动,帮助个体自我调节脑功能。该技术包括传统神经反馈、解码神经反馈和基于功能连接的神经反馈,应用于如重性抑郁障碍、强迫症、Tourette综合征、物质成瘾、精神分裂症等精神障碍的治疗。然而,目前研究方法、反馈算法和目标靶点的差异影响了研究的可靠性和可重复性。未来研究应优化研究设计,明确最佳神经靶点,评估长期疗效,以提升实时功能磁共振成像神经反馈在精神疾病治疗中的应用价值。
关键词
功能磁共振成像;精神障碍;神经反馈;生物反馈;神经调控;脑功能;神经可塑性
精神障碍是全球公共卫生领域的重要挑战,现有药物治疗虽能缓解部分症状,但仍存在疗效不足的问题。开发更精准、高效的干预策略具有重要临床意义,如脑深部电刺激[1]、脑机接口[2]已在抑郁症治疗中应用。实时功能磁共振成像神经反馈(real time functional magnetic resonance imaging-nuerofeedback,rtfMRI-nf)是一种新兴的神经调控方法。相较于传统药物治疗,rtfMRI-nf具有非侵入性的优势,为精神障碍治疗提供了新的可能。本文探讨rtfMRI-nf对精神症状的干预效果,评估其是否能改善精神症状,并进一步揭示其潜在神经机制,以期为精神障碍的精准干预提供科学依据,并推动rtfMRI-nf技术在临床实践中的应用。
1 研发历史
rtfMRI-nf是一种无创神经反馈技术,其通过MRI实时记录大脑活动,提取目标脑区的血氧水平依赖(blood-oxygen-level dependent,BOLD)信号或功能连接强度,转化为视觉或听觉反馈呈现给受试者。受试者根据反馈调整认知策略,逐步实现大脑功能的自我调节。rtfMRI-nf的实施过程包括受试者准备、MRI数据采集、实时处理脑活动信号、提供视觉或听觉反馈、受试者自我调节。rtfMRI-nf包括传统神经反馈、解码神经反馈(decoded neurofeedback,DecNef)和基于功能连接的神经反馈(functional connectivity neurofeedback,FCNef)。DecNef和FCNef与传统神经反馈的主要区别在于内隐性神经反馈的应用和外部奖励的应用。其中内隐性神经反馈的应用可减少实验者效应[3]和非特异效应,外部奖励的应用促进了神经反馈的学习[4]。DecNef应用了多变量分析[5],传统神经反馈调节感兴趣区(region of interest,ROI)fMRI信号的平均幅度,而DecNef通过调节感兴趣区中fMRI体素模式增强空间敏感性;FCNef应用连接性分析[6],传统神经反馈调节局部脑区,而FCNef调节大脑网络连接[7]。新技术的出现和应用拓宽了rtfMRI-nf的应用范围和功能。
2 rtfMRI-nf的作用机制
基于fMRI信号的实时神经反馈训练的过程:通过fMRI信号对大脑的自我调节情况进行监测,当大脑自我调节到理想值时给予及时的反馈,由此形成学习效应,促进神经通路的连接,最终改善脑环路功能和行为。
2.1 大脑习得性自我调节的机制 研究普遍认为,在面对不同的外界刺激时,大脑具有自我调节能力。从行为主义的视角来看,习得性大脑调节机制包括三要素:刺激-反应-强化,即在神经反馈训练中,刺激指外显的具体指令或内隐的心理策略,反应指大脑受到刺激后的自我调节,而强化指大脑接收反馈后不断重复并习得这种自我调节。上述机制可以归因于反馈强化的操作性条件反射[8]。从神经生理的视角来看,有研究表明慢性疼痛患者用实时fMRI来指导训练,试验组通过控制前扣带回皮质的激活可以调节慢性疼痛体验,对照组没有经过训练则不具有调节慢性疼痛体验的能力[9]。
2.2 神经反馈训练基于神经的可塑性 神经反馈对神经可塑性和行为有长期影响,例如利用大脑皮质回路的可塑性可控制啮齿动物的听觉光标音调[10]。
3 研究设计方法学因素对研究可靠性和可重复性的影响
许多rtfMRI-nf研究的结果难以在不同实验室或受试者之间重复,主要原因在于研究方法、反馈算法和ROI选择的差异,使得不同研究结果难以直接比较。未来的研究可从以上三方面进行规范,以提高研究的可靠性和可重复性。
3.1 研究方法的差异 不同实验室在设计rtfMRI-nf研究时,采用的研究方法可能存在多方面的差异,例如试验范式的不同。试验范式的不同是指一些研究采用任务驱动的神经反馈,而另一些研究则采用自发脑活动的神经反馈训练。任务设计的不同可能导致受试者接受神经反馈时激活的大脑区域有所不同,从而影响训练效果。
3.2 反馈算法的差异 神经反馈的核心在于实时计算并提供大脑活动的反馈,但不同研究使用的反馈算法可能存在显著差异。例如,DecNef采用模式分类算法来训练特定的神经活动模式,而传统神经反馈方法通常仅关注平均BOLD信号的整体变化。不同反馈算法的差异可能导致训练效果的差异,影响研究结果的一致性和可重复性,从而限制rtfMRI-nf的临床推广和应用。
3.3 目标靶点的差异 在利用rtfMRI-nf研究同一种精神疾病时,研究者有时选择不同的ROI以实现特定的情绪调节目标。例如,选择杏仁核作为ROI,旨在直接调节情绪反应;而选择楔前叶/后扣带回皮质和右颞顶交界处之间的功能连接作为ROI,则侧重于改善重复性消极思维(repetitive negative thinking,RNT)。不同研究选择的ROI不同,可能导致神经反馈训练效果的差异,从而影响研究结果的可比性和可重复性,限制了对其疗效普遍性的评估。
4 rtfMRI-nf在精神障碍中的应用
rtfMRI-nf已应用于重性抑郁障碍(major depressive disorder,MDD)、强迫症、Tourette综合征(Tourette syndrome,TS)、物质成瘾、精神分裂症、注意缺陷多动障碍(attention-deficit/hyperactivity disorder,ADHD)等精神疾病(表1)。
表1 基于fMRI的神经反馈治疗精神障碍的临床试验总结
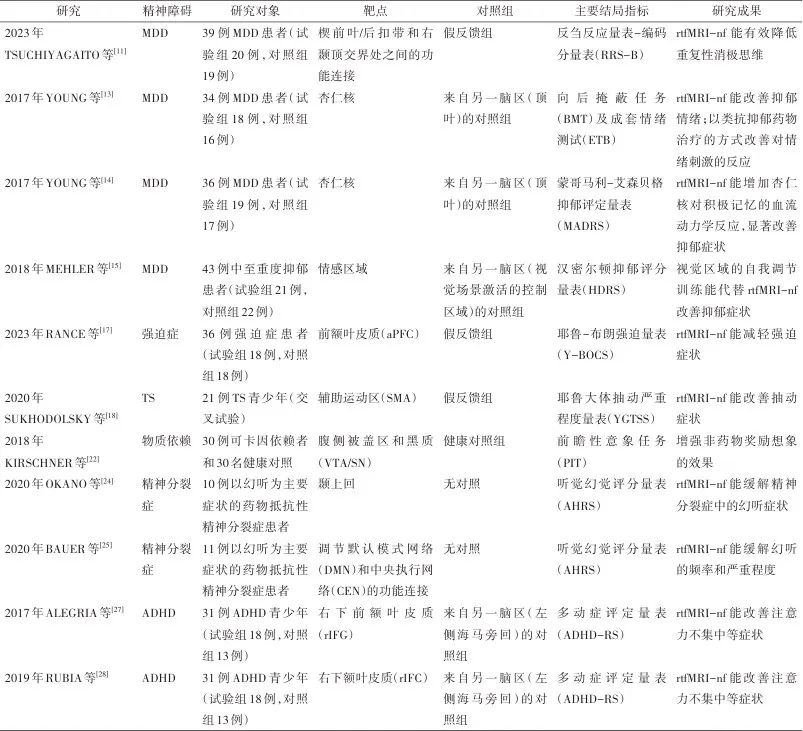
4.1 MDD rtfMRI-nf在降低RNT和缓解抑郁情绪方面有一定贡献。2023年,TSUCHIYAGAITO等[11]开展针对MDD的研究,共纳入39例患者,其中试验组20例,对照组19例。该研究以楔前叶/后扣带回皮质与右颞顶交界处之间的功能连接为调控靶点,受试者运用情绪调节策略进行基于功能连接的神经反馈。研究主要通过反刍反应量表-编码分量表评估干预效果,结果显示该方法能够有效改善RNT,且随访1周后疗效仍部分维持。2020年MISAKI等[12]也得出相似的结论。这提示全脑功能连接分析是探索神经机制的有效方法。MDD的情绪低落是研究关注的重点。2017年YOUNG等[13-14]先后进行了两次临床研究,两次研究的试验组神经调控靶点都是杏仁核,但两次研究设置了不同的结局变量:以向后掩蔽任务及成套情绪测试调控为结果指标的研究,能更好地定量解释杏仁核在缓解抑郁情绪中的机制;以蒙哥马利-艾森贝格抑郁评定量表为结果指标的另一项研究,其结论同样支持rtfMRI-nf训练能提高抑郁症患者杏仁核对积极情绪的血流动力学反应。目前研究尚未明确对情绪调节有效的确切神经调控靶点或神经回路。有学者通过调节高级视觉区域改善患者抑郁情绪:2018年MEHLER等[15]纳入两组MDD患者,分别以视觉场景激活的脑区和以情绪调节的脑区作为靶点,结论是两组患者抑郁情绪的改善效果未发现明显差异。rtfMRI-nf对MDD的干预具有一定效果,可减少RNT并缓解抑郁情绪。未来研究需要进一步确定最有效的神经靶点和回路,以提升rtfMRI-nf治疗MDD的精确性。
4.2 强迫症 一项meta研究显示,神经反馈对强迫症状有积极干预效果,但该研究同时揭示了纳入研究的局限性,例如小样本量、研究之间的高度异质性以及报告偏倚[16]。2023年RANCE等[17]的一项研究招募36例强迫症患者,将其随机分为试验组(18例)和对照组(18例)。受试者在神经反馈过程中观看引发强迫症状的图像,并尝试调节前额叶皮质(anterior prefrontal cortex,aPFC)的平均BOLD信号。研究表明与对照组相比,接受aPFC神经反馈训练的患者强迫症状显著减少,这表明针对aPFC的rtfMRI-nf可能是治疗强迫症有效的手段。但试验组在神经反馈后并未获得良好的aPFC控制能力。这意味着强迫症状的改善并不完全依赖于患者对aPFC活动的直接控制,而可能涉及更复杂的神经机制。
4.3 TS TS的先兆冲动与刺激辅助运动区(supplementary motor area,SMA)所产生的运动和运动冲动极为相似,这提示SMA可能作为TS神经回路的刺激靶点。基于此,一项双盲随机对照试验[18]得出:与对照组相比,试验组的抽动症状减少且有统计学意义。但在评估受试者对SMA的控制能力时,试验组与假对照组未表现出显著差异。这表明SMA神经反馈的疗效不依赖于患者对该区域活动的直接调节,而可能涉及其他神经网络的间接调节机制。对于TS发病机制的探索,一研究聚焦于患儿的静息态功能连接,结果表明相较于健康对照,患儿的默认模式网络(default mode network, DMN)的局部效率和聚类系数明显较低[19]。MAZZONE等[20]指出TS患者在控制眨眼时表现出更强的前额叶和纹状体激活。这可能为神经反馈靶点的选择给出了新方向。需要注意的是,TS的症状随着年龄变化而改变[21],研究设计需严格控制受试者的年龄分布。
4.4 物质成瘾 将心理意象和rtfMRI-nf相结合的治疗,在改善非药物奖励反应性方面具有巨大的潜力。可卡因使用者可以通过非药物奖励图像诱导多巴胺能中脑活动,并利用rtfMRI-nf强化这种能力[22]。但在其他类型的物质成瘾中,如酒精成瘾,rtfMRI-nf的作用并不理想[23]。
4.5 精神分裂症 rtfMRI-nf能缓解精神分裂症患者的幻听症状。2020年,OKANO等[24]和BAUER等[25]分别通过神经反馈训练调节颞上回的血流量,以及调节DMN和中央执行网络的功能连接,缓解精神分裂症患者的幻听症状。前者局限于颞上回这一脑区,后者着眼于大脑区域网络的异常。尽管两项研究均提示rtfMRI-nf对缓解幻听可能具有一定的积极作用,但由于样本量较小、未设置对照组且缺乏长期随访,仍需进一步研究以验证治疗的有效性和持续性[26]。
4.6 ADHD rtfMRI-nf对ADHD可能没有特殊效果。2017年ALEGRIA等[27]招募31例ADHD青少年(试验组18例,对照组13例)。试验组以右下前额叶皮质为ROI,对照组则接受来自左侧海马旁回的对照反馈,受试者通过自我调节策略增强ROI活动。研究表明试验组多动症评定量表评分有显著改善,但无组间效应。RUBIA等[28]在ALEGRIA等[27]研究的基础上进行基于功能磁共振的全脑功能连接分析,结果认为神经反馈改善ADHD症状的根本原因是前扣带回-纹状体网络强化及其与DMN后部区域的功能连接减弱。2020年CHEN等[29]对ADHD青少年的全脑磁共振功能连接分析结果也支持这一观点。未来需开展大样本、多中心研究,以明确ADHD相关脑网络的特异性调控靶点。
5 总结与展望
5.1 rtfMRI-nf的作用 rtfMRI-nf不仅是一种非侵入治疗手段,还可探索性地寻找精神障碍的治疗靶点[30]。近年来,基于精神障碍的网络模型,精神障碍的概念发生了重大转变。以前精神障碍的分类主要基于描述性诊断标准,未来则可能基于FCNef的神经生物学方法,例如异常DMN活性已被提出作为精神分裂症的标志物[31-32]。
5.2 没有规范化研究步骤所带来的问题 在结局指标选择上,除将精神障碍的临床量表作为主要结局指标外,对目标脑区的调控能力可作为次要结局指标,以阐明神经反馈在特定精神障碍中的作用机制。在试验范式的选择上,目前仍有学者认为,基于fMRI信号的神经反馈对于临床症状的改善属于非特异效应[33]。未来研究应尝试制定统一的研究范式,明确何种神经反馈训练更适用于特定精神障碍的治疗。在研究设计上,设置随机双盲安慰剂对照试验是十分必要的。最近的meta研究指出在其所收集的22项对照研究中仅有2项采用了双盲随机安慰剂对照设计[34]。这提示在未来的研究中需要更严格的双盲随机安慰剂对照试验来证明rtfMRI-nf训练治疗精神障碍的临床疗效果。
5.3 临床改善的持续时间 未来的研究需延长随访时间并评估症状改善的持续时间,以期能更好地描述神经反馈治疗在不同精神障碍中的时间进程,并根据随访症状的缓解情况来制定最佳的疗程[35]。随访临床改善的持续时间提供了未来的研究方向:需要多少次rtfMRI-nf才能在神经行为反应中引入长期变化。
5.4 rtfMRI-nf的局限性 rtfMRI-nf虽在精神障碍干预中展现潜力,但仍存在多项局限性,包括成本高昂且依赖昂贵的fMRI设备,扫描过程中噪声较大影响受试者的专注力和训练效果,以及长程疗效尚待进一步验证。现有研究多为短期干预,未来应推进大规模临床验证。
参考文献:
1. 吕鑫, 叶匡浩, 王宇涵, 等. 脑深部电刺激治疗难治性抑郁障碍临床疗效及机制研究进展[J]. 中国神经精神疾病杂志, 2023, 49(11): 675-681.
2. 王升升, 谭忠林, 吴月, 等. 脑机接口在抑郁症诊治应用研究进展[J]. 中国神经精神疾病杂志, 2023, 49(4): 251-256.
3. RAMOT M, GROSSMAN S, FRIEDMAN D, et al. Covert neurofeedback without awareness shapes cortical network spontaneous connectivity[J]. Proc Natl Acad Sci U S A, 2016, 113(17): E2413-E2420.
4. SEPULVEDA P, SITARAM R, RANA M, et al. How feedback, motor imagery, and reward influence brain self-regulation using real-time fMRI[J]. Hum Brain Mapp, 2016, 37(9): 3153-3171.
5. YAMASHITA O, SATO M A, YOSHIOKA T, et al. Sparse estimation automatically selects voxels relevant for the decoding of fMRI activity patterns[J]. NeuroImage, 2008, 42(4): 1414-1429.
6. KOUSH Y, ROSA M J, ROBINEAU F, et al. Connectivity-based neurofeedback: Dynamic causal modeling for real-time fMRI[J]. NeuroImage, 2013, 81: 422-430.
7. KORGAONKAR M S, GOLDSTEIN-PIEKARSKI A N, FORNITO A, et al. Intrinsic connectomes are a predictive biomarker of remission in major depressive disorder[J]. Mol Psychiatry, 2020, 25(7): 1537-1549.
8. SKINNER B F. Superstition in the pigeon[J]. J Exp Psychol, 1948, 38(2): 168-172.
9. DECHARMS R C, MAEDA F, GLOVER G H, et al. Control over brain activation and pain learned by using real-time functional MRI[J]. Proc Natl Acad Sci U S A, 2005, 102(51): 18626-18631.
10. KORALEK A C, JIN X, LONG J D, et al. Corticostriatal plasticity is necessary for learning intentional neuroprosthetic skills[J]. Nature, 2012, 483(7389): 331-335.
11. TSUCHIYAGAITO A, MISAKI M, KIRLIC N, et al. Real-time fMRI functional connectivity neurofeedback reducing repetitive negative thinking in depression: A double-blind, randomized, sham-controlled proof-of-concept trial[J]. Psychother Psychosom, 2023, 92(2): 87-100.
12. MISAKI M, TSUCHIYAGAITO A, AL ZOUBI O, et al. Connectome-wide search for functional connectivity locus associated with pathological rumination as a target for real-time fMRI neurofeedback intervention[J]. NeuroImage Clin, 2020, 26: 102244.
13. YOUNG K D, MISAKI M, HARMER C J, et al. Real-time fMRI amygdala neurofeedback changes positive information processing in major depressive disorder[J]. Biol Psychiatry, 2017, 82(8): 578.
14. YOUNG K D, SIEGLE G J, ZOTEV V, et al. Randomized clinical trial of real-time fMRI amygdala neurofeedback for major depressive disorder: Effects on symptoms and autobiographical memory recall[J]. Am J Psychiatry, 2017, 174(8): 748-755.
15. MEHLER D M A, SOKUNBI M O, HABES I, et al. Targeting the affective brain - a randomized controlled trial of real-time fMRI neurofeedback in patients with depression[J]. Neuropsychopharmacology, 2018, 43(13): 2578-2585.
16. FERREIRA S, PÊGO J M, MORGADO P. The efficacy of biofeedback approaches for obsessive-compulsive and related disorders: A systematic review and meta-analysis[J]. Psychiatry Res, 2019, 272: 237-245.
17. RANCE M, ZHAO Z, ZABOSKI B, et al. Neurofeedback for obsessive-compulsive disorder: A randomized, double-blind trial[J]. Psychiatry Res, 2023, 328: 115458.
18. SUKHODOLSKY D G, WALSH C, KOLLER W N, et al. Randomized, sham-controlled trial of real-time fMRI neurofeedback for tics in adolescents with Tourette syndrome[J]. Biol Psychiatry, 2020, 87(12): 1063-1070.
19. OPENNEER T J C, MARSMAN J B C, VAN DER MEER D, et al. A graph theory study of resting-state functional connectivity in children with Tourette syndrome[J]. Cortex, 2020, 126: 63-72.
20. MAZZONE L, YU S, BLAIR C, et al. An fMRI study of frontostriatal circuits during the inhibition of eye blinking in persons with Tourette syndrome[J]. Am J Psychiatry, 2010, 167(3): 341-349.
21. NIELSEN A N, GRATTON C, CHURCH J A, et al. Atypical functional connectivity in Tourette syndrome differs between children and adults[J]. Biol Psychiatry, 2020, 87(2): 164-173.
22. KIRSCHNER M, SLADKY R, HAUGG A, et al. Self-regulation of the dopaminergic reward circuit in cocaine users with mental imagery and neurofeedback[J]. EBioMedicine, 2018, 37: 489-498.
23. KARCH S, KRAUSE D, LEHNERT K, et al. Functional and clinical outcomes of fMRI-based neurofeedback training in patients with alcohol dependence: A pilot study[J]. Eur Arch Psychiatry Clin Neurosci, 2022, 272(4): 557-569.
24. OKANO K, BAUER C C C, GHOSH S S, et al. Real-time fMRI feedback impacts brain activation, results in auditory hallucinations reduction: Part 1: Superior temporal gyrus—Preliminary evidence[J]. Psychiatry Res, 2020, 286: 112862.
25. BAUER C C C, OKANO K, GHOSH S S, et al. Real-time fMRI neurofeedback reduces auditory hallucinations and modulates resting state connectivity of involved brain regions: Part 2: Default mode network - Preliminary evidence[J]. Psychiatry Res, 2020, 284: 112770.
26. ZHANG J, RAYA J, MORFINI F, et al. Reducing default mode network connectivity with mindfulness-based fMRI neurofeedback: A pilot study among adolescents with affective disorder history[J]. Mol Psychiatry, 2023, 28(6): 2540-2548.
27. ALEGRIA A, WULFF M, BRINSON H, et al. Real-time fMRI neurofeedback in adolescents with attention deficit hyperactivity disorder[J]. Hum Brain Mapp, 2017, 38(6): 3190-3209.
28. RUBIA K, CRIAUD M, WULFF M, et al. Functional connectivity changes associated with fMRI neurofeedback of right inferior frontal cortex in adolescents with ADHD[J]. NeuroImage, 2019, 188: 43-58.
29. CHEN M H, CHEN Y L, BAI Y M, et al. Functional connectivity of specific brain networks related to social and communication dysfunction in adolescents with attention-deficit hyperactivity disorder[J]. Psychiatry Res, 2020, 284: 112785.
30. MACINNES J J, DICKERSON K C, CHEN N K, et al. Cognitive neurostimulation: Learning to volitionally sustain ventral tegmental area activation[J]. Neuron, 2016, 89(6): 1331-1342.
31. GARRITY A G, PEARLSON G D, MCKIERNAN K, et al. Aberrant “default mode” functional connectivity in schizophrenia[J]. Am J Psychiatry, 2007, 164(3): 450-457.
32. ZILVERSTAND A, SORGER B, KAEMINGK A, et al. Quantitative representations of an exaggerated anxiety response in the brain of female spider phobics - A parametric fMRI study[J]. Hum Brain Mapp, 2017, 38(6): 3025-3038.
33. SCHÖNENBERG M, WEINGÄRTNER A L, WEIMER K, et al. Believing is achieving - On the role of treatment expectation in neurofeedback applications[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2021, 105: 110129.
34. PINDI P, HOUENOU J, PIGUET C, et al. Real-time fMRI neurofeedback as a new treatment for psychiatric disorders: A meta-analysis[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2022, 119: 110605.
35. RANCE M, WALSH C, SUKHODOLSKY D G, et al. Time course of clinical change following neurofeedback[J]. NeuroImage, 2018, 181: 807-813.
【引用格式】刘思言,王继军. 基于功能磁共振信号实时神经反馈技术在精神障碍中研究进展[J]. 中国神经精神疾病杂志,2025,51(3):174-179.
【Cite this article】LIU S Y,WANG J J.The application of real-time neurofeedback interventions based on functional magnetic resonance imaging signals in mental disorders[J]. Chin J Nervous Mental Dis,2025,51(3):174-179.
DOI:10.3969/j.issn.1002-0152.2025.03.009
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)